用于1型糖尿病細胞治療的胰島低溫保存進展
韓恒鑫 占太杰 崔夢冬 楊加敏 陳 亮 胥 義
(上海理工大學醫療器械與食品學院 上海 200093)
1型糖尿病(type 1 diabetes mellitus,T1DM)是一種自身免疫疾病,免疫系統會攻擊胰腺中產生胰島素的β細胞,β細胞大量死亡導致胰島素分泌不足,從而造成患者血糖調控能力喪失[1]。據國際糖尿病聯盟數據,2019年超過110萬兒童和青少年患有1型糖尿病[2]。目前,T1DM治療的主要方法是監測血糖水平,在水平過高時進行胰島素注射。頻繁的胰島素注射費時費力,且可能會導致嚴重的并發癥,如血管疾病[3]和無意識性低血糖[4]等。
對于T1DM,胰島移植是十分具有潛力的治療方法,該方法可以恢復患者的血糖調控能力,避免定期的胰島素注射,很大程度上提高患者的生活質量。但由于供體短缺以及供體與受體之間時間的不匹配,限制了胰島移植的廣泛應用。目前已經探索了胰島供體的其他來源[5],例如豬胰島[6-8]和干細胞衍生的胰島類器官[9-11]。有望解決胰島移植供體短缺的問題,也對高質量的胰島低溫保存提出了更為迫切的需求。
低溫保存是高質量保存生物樣本的重要方法,液氮下的低溫可以使細胞代謝完全停滯,是長期保存胰島的理想條件[12-15]。現用胰島低溫保存方案存在許多問題,例如回收率較低且功能較差,添加的有毒CPA需要復雜的洗脫步驟,此外還缺乏高質量的、自動化的和高通量的胰島低溫保存技術。近年來,由于材料科學、低溫生物學和跨學科研究的發展,出現了一些新的低溫保存方法,如開發出了天然來源的新型保護劑[16-18]、非滲透性保護劑胞內遞送方法[19-22]和快速復溫方式[22-28]等。這些新技術方法提升了胰島的低溫保存質量,在一定程度上降低了低溫保存過程中引起的胰島損傷。本文綜述了近年來胰島低溫保存領域出現的新材料新方法,這些新的低溫保存方法有助于建立隨用隨取的高質量胰島庫,為后續T1DM的細胞治療提供可靠的胰島來源。
1 低溫保存機理
目前胰島的低溫保存方法主要有兩類:一類是慢速冷凍保存,另一類是玻璃化保存。
1)慢速冷凍保存,是通過添加低濃度(本文涉及的“濃度”如無特殊說明均為摩爾濃度)的冷凍保護劑(cryoprotective agents,CPA)結合兩步法降溫使胰島處于胞外結冰胞內玻璃化的狀態。圖1(a)所示為在慢速降溫過程中降溫速率對于胰島低溫保存的影響,在該慢速降溫過程中,需要摸索適合胰島的最佳降溫速率[29-30]。若降溫速率過快,會在胰島細胞內部產生冰晶,這些胞內冰在復溫過程中會產生再結晶而使細胞受損;若降溫速率過慢,則胰島細胞收縮過度,加重溶質損傷。最佳降溫速率下,胰島的整體損傷最小。
2)玻璃化保存,是通過添加高濃度CPA結合小樣本快速的降溫速率,使體系達到整體的玻璃化狀態。玻璃化是指液體轉變為非晶態(玻璃態)的固化過程。實現玻璃化有兩種途徑,一是極大的提高冷卻速率,二是增加溶液濃度。玻璃化狀態是胰島保存的理想狀態,細胞內外完全避免了結晶,但要達到完全的玻璃化,需要很高的CPA濃度,也會對胰島細胞產生毒性損傷,此外復溫過程中的反玻璃化現象也會對細胞產生損傷,如圖1(b)所示。

圖1 低溫保存原理Fig.1 Principle of cryopreservation
2 胰島低溫保存中損傷因素的抑制
胰島結構較為復雜,單個胰島約含1 000~10 000個細胞[31-32],平均直徑為150 μm,由多種細胞構成。這種復雜結構增加了胰島高質量低溫保存的難度,首先熱傳遞限制導致了降溫和復溫過程中冰晶更加難以控制[29,33]。其次CPA滲透更加困難,較長的平衡時間加重了其對胰島的毒性損傷[31]。此外在胰島分離和體外培養過程中,其血管系統被破壞[34-35],氧氣的輸送效率大大降低,復溫時氧氣供應不足將導致胰島內部細胞死亡。
造成胰島低溫保存過程中損傷的因素主要有冰晶損傷、保護劑損傷及缺氧損傷。近些年來出現了新的低溫保存方法,如天然無毒的新型保護劑、非滲透性保護劑的胞內遞送和快速復溫方式等,從不同方面抑制了低溫保存過程中胰島的損傷,提高了胰島低溫保存效果。
2.1 冰晶損傷的抑制
胰島低溫保存過程中,冰晶的生成會產生機械應力[29],對細胞膜[30]和胰島結構造成破壞。由于過冷度、冷卻速率、溶質性質和保護劑濃度的不同,冰晶的生長速率和形態也不同,冰晶可能呈現針狀、羽狀、不規則枝狀以及多種過渡形式的結構,不同結構的冰晶對胰島形態結構的損傷也不同。S.Matsumoto等[17]將不同濃度的合成抗凍蛋白類似物(sy AFGP)添加到保護劑中,研究其對低溫保存中胰島形態結構的保護作用。低溫顯微結果顯示,當sy AFGP質量濃度為500 μg/mL時,冰晶形態從鋒利的刀片狀變為一系列羽狀分支結構,羽狀結構中晶體間未凍結區域更大,胰島處于冰晶間隙中,形態結構保存較為完整;當sy AFGP質量濃度進一步增加,達到1 000 μg/mL以上時,會促使冰晶大量生長且晶體形態從樹枝狀轉變為針尖狀,對胰島結構造成了嚴重損傷。所以在胰島低溫保存過程中,控制冰晶生長是十分必要的,可以通過優化降溫程序、微囊化包封及玻璃化保存等方法來減輕低溫保存過程中冰晶對于胰島的損傷。
2.1.1 降溫程序的優化
冰核的產生和冰晶的生長過程與降溫速率有關,較慢的降溫速率形成少而大的冰晶;較快的降溫速率形成多而小的冰晶。圖2所示為慢速低溫保存中出現的過冷度示意圖,在實際降溫操作中,樣品體系可能會出現較大的過冷度,在釋放潛熱后出現很高的冷卻速率(圖2 e-f段),導致胞內冰的生成,對胰島造成損傷。
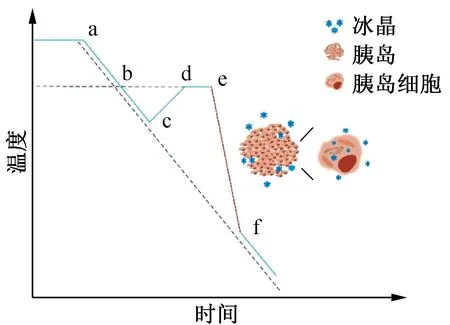
圖2 高過冷度導致胞內冰的生成Fig.2 High degree of under cooling leads to the formation of intracellular ice
研究表明[36-37],胰島最適降溫速率約為0.25~1.00 ℃/min。為了減輕體系在較大過冷度下釋放潛熱后出現的快速降溫階段的影響,通常采用“置核”來控制晶核的生成。目前主要的置核方法有兩種,一是通過冷媒在體系局部形成較大的過冷度來實現[38],二是通過調節降溫程序來實現[39]。
2.1.2 微囊化胰島
微囊化胰島是將胰島包封在具有選擇透過性的微囊中,最早由F.Lim等[40]提出。微囊在胰島外部形成一層保護屏障,既可以最小化免疫反應,又可以顯著減輕冰晶形成對胰島造成的機械損傷。
液滴生成器是最常用的液滴生成方式。常規液滴生成器(圖3(a))生成的液滴范圍通常為100~1 000 μm,液滴中通常包含不同數量的胰島且微囊的大小不一難以控制。同軸氣流液滴發生器(圖3(b))可以獲得尺寸較均勻的微囊,S.Schneide等[41]利用同軸氣流液滴發生器獲得的微囊直徑約為700~800 μm。靜電液滴發生器(圖3(c))在噴嘴和膠凝溶液之間施加靜電勢有助于制造更小的微囊[42-44]。近年來,微流體設備也已用于胰島封裝[22,43-45]。使用微流體包囊胰島可更好的控制膠囊大小,且可以利用多種包封材料形成核殼結構的多層微囊,同時避免了胰島可能出現在微囊外部的問題(圖3(d))。J.D.Weaver等[43],使用微流控技術將小鼠胰島封裝在300 μm PEG膠囊中,對照組使用靜電液滴發生器產生的最小膠囊為500 μm。此外,A.A.Tomei等[46]開發了基于流動聚焦的保型封裝方法(圖3(e)),可以貼合胰島形狀形成更薄、更穩定且厚度均勻的微囊,大幅減小了微囊的體積,改善了氧氣及養分的獲取[47-48]。構成微囊的材料通常有藻酸鹽水凝膠、殼聚糖、葡聚糖、超分子或其它合成聚合物[49-50]。這些材料的3D網絡結構可以限制冰晶生長[51],并在復溫中抑制冰重結晶,最大限度地減少冰晶對細胞的物理損害[52]。A.A.Haridkar等[53]使用殼聚糖-海藻酸鹽水凝膠包封小鼠胰島,封裝組存活率為95.4%,而未包封組為69.4%。侯軍等[54-55]也得到類似的結論,侯軍等[54]的研究中,CPA為含有2 mol/L二甲基亞砜(dimethyl sulfoxide,DMSO)的RPMI 1640溶液,降溫過程首先將樣本快速降溫至-7.4 ℃,然后以0.25 ℃/min降至-40 ℃,隨后投入液氮中保存。1個月后將樣本利用37 ℃水浴復溫,使用0.75 mol/L的蔗糖溶液洗脫DMSO,雙硫腙染色結果顯示,微囊化組的胰島回收率可以達到94.7%±1.4%,顯著高于裸露組(68.6%±2.9%)。K.D.Inaba等[55]優化了降溫程序,將樣本以-0.2 ℃/min的降溫速率從4 ℃冷卻至-45 ℃,并在-7.5 ℃處置核,然后將樣品置于液氮中保存。保護劑均為含有2 mol/L DMSO的RPMI 1640溶液。結果顯示微囊化組胰島(97.2%±1.3%)的回收率顯著高于裸露組(79.5%±9.8%),通過降溫程序的優化,微囊化胰島的回收率得到進一步的改善。此外,S.Schneide等[41]優化了微囊化胰島低溫保存所需的DMSO濃度及降復溫程序,結果顯示在DMSO終濃度為2.0 mol/L時,在0 ℃下平衡15 min,37 ℃水浴并通過梯度蔗糖溶液逐步洗脫去除DMSO,結果最優,這些條件與之前針對非微囊化大鼠胰島優化的最優低溫保存條件相當[56]。
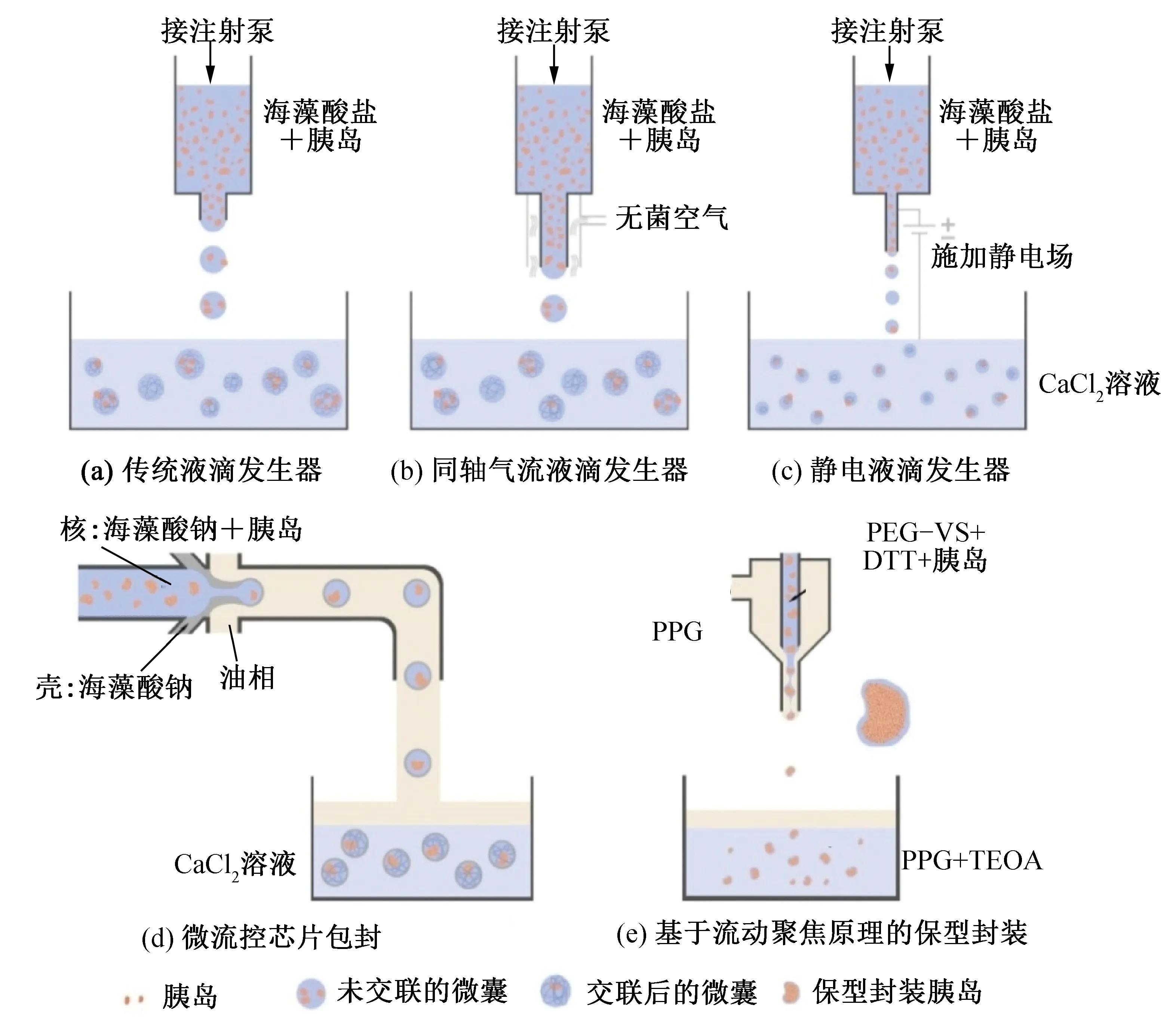
圖3 微囊化包封方法Fig.3 Microencapsulation encapsulation method
圖4所示為微囊化降低冰晶對胰島損傷的示意圖,微囊化可以顯著減輕胰島在低溫保存過程中受到的冰晶損傷,保護胰島形態,提高胰島低溫保存后的回收率,改善胰島細胞低溫保存后的功能,并在后續移植過程中避免免疫反應。但微囊也增加了氧氣及養分的運輸距離[57-59],限制了移植后的再血管化,加劇了胰島內部細胞的缺氧死亡[60-61],不利于胰島在體內長期發揮功能。此外,微囊包封也顯著增加了胰島的體積,限制了移植的部位。保型封裝在一定程度上改善了氧氣及養分的輸送且減小了移植物的體積,但仍對再血管化存在限制,且其在冷凍過程中對于胰島的保護作用還需要進一步研究。

圖4 微囊對冰晶損傷的抑制原理Fig.4 Inhibition principle of ice crystal damage by microcapsules
2.1.3 玻璃化保存胰島
玻璃化保存是克服低溫保存過程中冰晶損傷的有效方法,近年來,一些新的玻璃化裝置應用于胰島低溫保存領域,顯著提高了降溫速率,降低了對于高濃度CPA的依賴,改善了玻璃化保存胰島的功能性。
冷表面玻璃化是將包含樣本的小液滴直接滴在冷表面實現玻璃化。H.Sasamoto等[36]將100個胰島懸浮于40 μL的保護劑溶液中,然后立即滴至液氮預冷的鋁皿上實現玻璃化。復溫后胰島達到92.4%的高存活率。
麥管加熱后拉伸得到拉伸麥管(open pulled straw,OPS),外徑約為0.27~0.40 mm,管壁約為0.05 mm。拉伸麥管降溫速率可達11 400~18 400 ℃/min,復溫速率為12 200~32 300 ℃/min[62]。與普通麥管相比,使用拉伸麥管的降溫速率和復溫速率都快了約4倍,但拉伸麥管的容積也大幅減小,有效容積從普通麥管的約150 μL降至約10 μL,只能保存少量的胰島。
冷凍載桿(cryotop)由附著在耐液氮的塑料手柄上的細透明薄膜條及外套管組成,可以提供23 000 ℃/min的降溫速率和42 000 ℃/min的升溫速率,可以減輕對于高濃度CPA的依賴,提高玻璃化保存效果。但在降溫過程中樣本需要直接與液氮接觸,可能造成污染[63]。目前利用cryotop設備已經成功保存了卵母細胞[64-66]以及胚胎[67-68]等生物樣本。近年來,cryotop也被用于胰島玻璃化保存[18,37]。
中空纖維(hollow fiber,HF)是一種由三乙酸纖維素材料制成的中空管,管壁約為15 μm;近些年來有研究者將中空纖維玻璃化應用于胰島保存領域。M.Nagaya等[69]對比了冷表面、OPS和HF玻璃化對于胰島功能的影響,結果顯示HF組胰島功能最優。
目前的玻璃化設備為了達到足夠快的降溫速率,一般容積都很小,單次保存的胰島量對于臨床應用遠遠不夠,所以需要開發高通量的胰島玻璃化方法,冷表面玻璃化顯示出了高通量保存胰島的潛力,后續可以通過高精度的3D打印噴射成液滴矩陣來進一步降低液滴大小,提高保存效果,實現高通量的玻璃化保存。
2.2 保護劑損傷的抑制
冷凍保護劑損傷包括細胞膜損傷[70],增殖和分化能力減弱[71-74],線粒體功能降低[75-77],DNA、蛋白質或其他大分子受損等[78-82]。這些損傷可能是CPA本身的毒性以及CPA引起的滲透壓沖擊所造成的。通過復配使用多種CPA,無毒低毒保護劑結合胞內遞送等方法可以減輕這些損傷。
2.2.1 保護劑的復配使用
不同CPA具有不同的膜滲透能力[83]、玻璃化能力以及細胞毒性。通過不同CPA的復配使用可以降低CPA的整體濃度,在抑制冰晶的同時降低CPA對于細胞的毒性損傷以及滲透沖擊。G.Kojayan等[38]的研究結果顯示與目前的標準2 mol/L DMSO相比,復配使用CPA(1 mol/L DMSO + 0.5 mol/L EG)可獲得更高的存活率和細胞活力。此外,大鼠體內實驗顯示,復配組可以更快的使血糖恢復正常。
了解CPA損傷機理和CPA功能特性是尋找更優CPA配方的基礎。不同細胞對于CPA的滲透性差異很大,為了開發出更適合胰島的CPA配方,各種CPA對于胰島的損傷機理以及胰島與不同CPA的相互作用還需要進一步研究。
2.2.2 非滲透冷凍保護劑胞內遞送
目前用于胞內遞送的非滲透CPA主要是天然糖類如海藻糖、蔗糖和棉子糖[84]。應用最多的是海藻糖,海藻糖首先在極端耐寒和干燥的生物中發現[85-86],它可以與生物大分子形成氫鍵促進生物大分子的水合作用,充當水以使細胞成分構象保持穩定;還可通過大幅降低分子流動性促進玻璃態的形成來暫停代謝活動[87-88]。
通常海藻糖無法透過哺乳動物的細胞膜,且僅胞外的海藻糖不能起到良好的保存效果[89]。研究者探索了將海藻糖遞送至胞內的方法,例如誘導磷脂相變[20]、電穿孔、超聲、顯微注射和納米粒子遞送[21,90]等。G.M.Beattie等[91]利用胰島細胞膜的脂質相變將海藻糖遞送至胞內,結果表明冷凍保存后的胰島在復溫后顯示出良好的活力和功能,移植到糖尿病大鼠模型中的效果與移植新鮮胰島無顯著差異。V.Mutsenko等[84]利用電穿孔將海藻糖、蔗糖和棉子糖分別遞送進細胞內,對比了3種糖在細胞冷凍保存中的效果,結果表明蔗糖和棉子糖與海藻糖一樣有效。
Cheng Yue等[22]利用冷響應納米膠囊(CR-NCs)遞送海藻糖,CR-NCs具有冷響應特性,在溫度低于10 ℃時,CR-NCs會裂解釋放海藻糖,可使胞內海藻糖濃度達到0.4 mol/L。該項研究還將胰島包封在海藻酸鹽水凝膠中,并通過磁熱復溫提高了復溫速率,進一步降低對胰島的損傷。結果顯示,僅0.4 mol/L的游離海藻糖,冷凍保存后的細胞活力僅為30%,通過CR-NCs將海藻糖運送至細胞內后,細胞活力達到60%以上。再加上海藻酸鹽封裝后,冷凍保存后細胞活力增至75%,最后引入磁熱復溫后,細胞活力進一步提高至85%。海藻糖胞內遞送,微囊封裝以及磁熱復溫的綜合使用,減少了對有毒CPA的需求,僅使用0.4 mol/L的海藻糖即可達到80%以上的細胞活力。該項工作體現了綜合利用多種工程方法保存胰島細胞的巨大潛力。
2.2.3 低毒性的冷凍保護劑
近年來,一些無毒或低毒的CPA應用于胰島低溫保存領域,例如不同來源的抗凍蛋白以及聚兩性電解質等。這些CPA具有較低的生物毒性且可以提高胰島低溫保存后的存活率和功能性,展現出了替代傳統有毒保護劑的潛力[92]。
抗凍蛋白是一種天然來源的保護劑,其保護機理可能為通過疏水相互作用與膜磷脂締合,起到穩定細胞膜的作用[93],減少了胞外冰對膜造成的損傷。目前抗凍蛋白也已應用于胰島低溫保存領域,并取得了良好的保存效果[17,93-95]。聚兩性電解質也稱兩性聚電解質,已成功實現了胰島[18]、紅細胞[96]、人肺腺癌細胞[97]、小鼠成纖維細胞[98]、小鼠胚胎[99]等樣本的冷凍保存。聚兩性電解質具有較強的冰重結晶抑制作用[98,100-101],可以減少胰島低溫保存過程中冰晶形成對于胰島的損傷;CPA配方中引入聚兩性電解質可以降低保護劑的滲透壓[102],從而減輕滲透沖擊對于胰島的損傷;且聚兩性電解質具有較低的細胞毒性,可以降低有毒CPA的用量,減輕其對于胰島的毒性損傷;此外有觀點認為聚兩性電解質可以在胞外形成無冰的緩沖區域[103],減輕冰晶對胰島的機械損傷。
2.3 缺氧損傷的抑制
胰島的血管網絡在分離過程會被破壞,被動擴散成為分離的胰島獲取氧氣的主要方式[34-35,104]。氧氣輸送受限導致胰島功能下降,內部細胞缺氧死亡,最終導致整個胰島死亡。
在復溫過程中,細胞恢復代謝需要消耗大量能量,ATP耗盡導致細胞功能不足也會導致胰島的損傷[105-106]。H.Komatsu等[107]研究發現在高氧(50% 體積濃度的O2)下解凍可以降低胰島炎癥相關基因的表達,更好的保存胰島功能。減輕炎癥細胞因子對于胰島細胞活力和功能的不利影響[108-109],可能是提高胰島存活率和功能性的關鍵。
ROS(reactive oxygen species,ROS)是冷凍保存過程中細胞損傷的另一個重要因素[110-114]。通過添加姜黃素和牛磺酸等抗氧化物質可以降低ROS水平,減輕細胞損傷。姜黃素是一種多酚化合物[115],具有細胞保護和抗凋亡特性[116-117]。K.Meghana等[116]觀察到低溫保存胰島ROS水平是新鮮胰島的5倍,且加入姜黃素后低溫保存胰島的ROS水平降至與新鮮胰島ROS水平相當。姜黃素增強了胰島中血紅素加氧酶-1(HO-1)和熱休克蛋白70(Hsp 70)基因的表達,這兩種蛋白在低溫保存中對細胞具有保護作用[118]。A.A.Hardikar等[119]研究了在低溫保存之前添加牛磺酸對胰島的保護作用,結果表明,在低溫保存之前添加0.3 mmol/L和3.0 mmol/L牛磺酸可提高胰島的存活率(0.3 mmol/L為91.9%±2.3%,3.0 mmol/L為94.6%±1.58%)。
天然胰島復雜結構給低溫保存帶來了諸多限制[120-123]。胰島的大小是影響低溫保存后胰島質量的一個重要因素,在M.A.Mach等[56]將胰島根據直徑分為Small(<200 μm)、Medium(200~400 μm)和Large(>400 μm)3組,研究不同DMSO濃度和不同加載、去除方式對于胰島活力的影響,結果顯示,在中等DMSO濃度(1.4 mol/L,2 mol/L)下,胰島活力整體與胰島大小呈負相關。且經過不同加載、洗脫方式處理后,不同大小的胰島對于處理方式改變的響應程度也不同。經過不同加載方式(45 min,4 ℃;15 min,4 ℃;45 min,22 ℃)處理的胰島低溫保存再復溫后,與22 ℃加載組(r=-0.79)相比,4 ℃加載組(45 min,r=-0.84;15 min,r=-0.84)的負相關性更強。該研究表明胰島大小對胰島低溫保存后的質量影響顯著,對以后胰島低溫保存方案的優化,特別是干細胞分化來源的胰島的低溫保存具有借鑒意義。
將胰島分解為單細胞可以顯著降低低溫保存中的缺氧損傷。但胰島功能實現高度依賴于細胞間通訊以及不同細胞類型間的旁分泌相互作用[124-126]。針對這些特點,研究者們研究了將胰島分解成單細胞進行低溫保存,復溫后再將其聚合成胰島的保存方法。S.Rawal等[83]對比了將胰島分解為單細胞保存與整體保存后的胰島存活率與功能,結果表明胰島直接低溫保存和胰島單細胞保存的最終存活率均穩定在約80%,但單細胞保存后再聚集的胰島比直接保存的完整胰島具有更高的代謝活性。A.A.Stock等[46]發現在胰島分解成單細胞再聚集的過程中會損失掉一部分細胞,有報道[127]稱該種細胞丟失可以消除與胰島素分泌無關的細胞類型,從而增加細胞群中胰島素分泌細胞的比例,起到純化的作用。
雖然將胰島分解為單細胞保存可以提高胰島細胞整體的功能性,但酶解成單細胞也破壞了胰島原本的細胞構成與結構,這些破壞對于胰島整體功能以及后續存活的影響還不清楚,有待進一步研究。
3 總結與展望
近年來,由于材料科學、低溫生物學和跨學科研究的發展,諸多新材料新方法應用于胰島低溫保存領域,胰島低溫保存技術得到進一步發展。但現有方案與臨床細胞治療的需求還有一定差距。首先是仍然缺乏高通量玻璃化保存胰島的方法,一些技術方法如冷表面玻璃化展現出了高通量保存胰島的潛力,但仍需要進一步研究。其次對于胰島低溫保存過程中損傷的機理的研究尚不夠深入,了解損傷機理對于后續低溫保存程序的設計具有一定的指導意義。
胰島低溫保存是一個系統性工程,高質量保存需要綜合考慮保存過程中的各個方面。胰島低溫保存過程存在諸多損傷因素,最終胰島的損傷是這些損傷因素相互作用的共同結果。這些損傷的抑制方法很多,如保護劑的多步加載、降溫過程的控制、非滲透性保護劑胞內遞送以及快速復溫等。胰島低溫保存要通過多種技術的協同作用,將強烈的損傷盡可能分化成為處于胰島耐受范圍內的輕微損傷,避免引入單一強烈的處理方式。
在后續研究中,開發新材料新技術以及對于損傷機理的深入研究均具有重要意義。在利用現有的保護劑以及技術方法來設計胰島低溫保存方案時,需要綜合考慮保存過程中的各種損傷,各種保護方法帶來的不利影響以及其協同作用。

