異黃腐酚與順鉑聯合用藥對肺癌順鉑耐藥A549/DDP細胞的協同抑制作用
郭亞楠,郭紅云,王 濤,張永東,郭文靜,蔣 兵,蘇海翔
(1.甘肅省醫學科學研究院,甘肅省腫瘤醫院,甘肅 蘭州 730050;2.甘肅中醫藥大學基礎醫學院,甘肅 蘭州 730000)
肺癌的病死率居癌癥死因的首位[1],因其早期臨床癥狀不明顯,因此多數肺癌患者臨床確診時已到中晚期,從而失去了手術治療機會。化療是治療肺癌的主要療法之一[2],臨床上肺癌的化療以鉑類藥物為主,鉑類中DDP是有效并廣泛應用的一線用藥,但是DDP治療一段時間后,耐藥性的出現往往導致藥物失效和預后不良,尤其是非小細胞肺癌(non-small cell lung cancer,NSCLC)較容易對化療藥物產生耐藥性[3],因此,尋找高效安全的多藥耐藥(multiple drug resistance,MDR)逆轉劑是目前臨床肺癌治療的迫切需要。
異黃腐酚(isoxanthohunol,IN)作為一種異戊二烯基黃酮類物質[4],其主要存在于中藥蛇麻花(humuluslupulus俗稱:啤酒花)中,分子式C21H22O5,分子量354.4,其主要是黃腐酚(xanthohumol,XN)加熱過程產生的一種同分異構體。在啤酒釀造的麥汁煮沸過程中,大部分XN被異構化為IN,因此啤酒中IN含量遠高于XN[5]。體外實驗研究報道,IN具有抗腫瘤[6]、抗炎[7]以及參與脂質代謝調節[8]等多種生物學功能。在國內外的食品、保健品、藥品中受到廣泛的關注。但目前關于IN聯合DDP對人肺癌耐順鉑細胞株A549/DDP的作用及相關機制仍未有報道。本實驗旨在觀察IN聯合DDP對A549/DDP細胞的增敏作用以及細胞周期、凋亡的影響,并探討其分子機制,為中醫藥治療NSCLC提供新的實驗基礎。
1 材料
1.1 細胞株人肺癌順鉑耐藥株A549/DDP購自上海富衡生物科技有限公司。
1.2 藥品與試劑異黃腐酚,玉門拓璞科技開發有限責任公司;順鉑規格:100 mg,批號:SC8452,齊魯制藥有限公司;DMEM培養基,美國Hyclone公司;10%胎牛血清,美國BI公司;100×青鏈霉素混合液規格:100 mL、CCK-8試劑盒、BCA蛋白濃度測定試劑盒、SDS-PAGE凝膠制備試劑盒,北京SoIarbio公司;細胞凋亡檢測試劑盒,美國BD公司;羊抗兔P-gp、LRP、MRP、PI3K、p-AKt、GAPDH,美國Proteintech公司;化學發光顯色液,美國Millipore公司。
1.3 儀器流式細胞儀(美國Becton Dickinson公司);凝膠成像系統、酶標儀(美國BIO-RAD公司);二氧化碳培養箱(德國BINDER公司);培養顯微鏡(日本OLYMPUS公司);臺式低速離心機(上海精宏有限公司);雙人單面超凈工作臺(蘇州蘇潔凈化有限公司)。
2 方法
2.1 細胞培養人肺癌A549/DDP細胞培養于含10%胎牛血清的DMED培養液中,置37 ℃、5% CO2培養箱中培養。為了保持A569/DDP細胞的DDP耐藥性,每次換液時在細胞培養液中均添加DDP(最終濃度為1 mg·L-1)。為了減少DDP對實驗的干擾,在實驗前更換成不加DDP的培養液。
2.2 A549/DDP細胞活性檢測當A549/DDP細胞達到對數生長期時,將細胞以8×103個/孔接種于96孔板。待細胞貼壁后,加入不同濃度的IN、DDP,每組6個復孔,培養48 h后,加入10 μL CCK-8溶液,繼續培養2 h,應用酶標儀測定各孔在450 nm波長處的吸光度值(A),計算各組細胞生長抑制率/%=1-(藥物組A值/空白組A值)×100%。
2.3 藥物協同作用Isobologram分析依據CCK-8的實驗結果,得出不同濃度IN、DDP對A549/DDP細胞的IC50濃度,分別設為a和b,位于橫坐標軸和縱坐標軸上,連接a、b兩點的直線為相加線。同時根據CCK-8實驗結果,求得不同濃度20 μmol·L-1IN與不同濃度DDP聯用時的IC50濃度c,若d (20,c)點在a b連線上,則表示兩藥聯用為相加作用,在該連線以下,表示兩藥聯用為協同作用;在該連線以上,表示兩藥聯用為拮抗作用[9-10]。
2.4 細胞凋亡檢測當A549/DDP細胞達到對數生長期時,將細胞以1×106個/孔接種于6孔板。待細胞貼壁后,分別加入IN組、DDP組和IN與DDP聯合用藥組,培養48 h后,加入1 mL的胰酶消化后收集細胞,用預冷的PBS洗2次,根據試劑盒說明書操作,加入500 μL Binding buffer,5 μL Annexin V-FITC和PI溶液,避光反應20 min,濾膜過濾至流式管中用流式細胞儀檢測。
2.5 細胞周期檢測當A549/DDP細胞達到對數生長期時,將細胞以1×106個/孔接種于6孔板。待細胞貼壁后,按照2.4上述各組藥物配置,分別加入到6孔板中,培養48 h后,收集細胞,用PBS洗滌2次,離心,每組樣品用100 μL預冷的PBS重懸,然后再加入300 μL預冷的乙醇,輕輕混勻以后,放入-20 ℃冰箱過夜,次日,取出固定的細胞,棄上清,并用預冷的PBS清洗3次,然后按照細胞周期試劑盒說明書操作,加入500 μL的PI-RNase染液混勻,室溫避光孵育20 min,濾膜過濾至流式管中用流式細胞儀檢測。
2.6 細胞內相關蛋白變化檢測細胞培養和分組處理同2.4。培養48 h后,收集細胞,用預冷的PBS洗滌細胞,每孔加入細胞裂解液,12 000 r·min-1離心20 min,用蛋白定量試劑盒定量,隨后加入5×蛋白上樣緩沖液置于90 ℃水浴鍋中煮沸10 min。15%的聚丙烯酰胺SDS凝膠電泳后,將PVDF膜封閉于5%的脫脂奶粉中,且在室溫條件下封閉2 h后依次加入一抗(稀釋比1 ∶1 000),4℃孵育過夜后,用TBST洗膜3次,每次5 min;二抗封閉(稀釋比1 ∶10 000),室溫下孵育2 h,TBST洗膜3次,每次5 min,滴加ECL發光試劑于凝膠成像系統曝光。
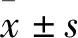
3 結果
3.1 IN與DDP聯用協同抑制A549/DDP細胞生長CCK-8實驗結果見Fig1所示,IN濃度≤20 μmol·L-1時,作用于人肺癌耐順鉑細胞株A549/DDP細胞48 h后,細胞增殖率在90%以上,當濃度增加至30~80 μmol·L-1時,IN以濃度依賴性明顯抑制A549/DDP細胞活性,差異具有統計學意義(P<0.05),IC50值為42.1 μmol·L-1。見Fig2結果所示,選擇無明顯細胞毒性的20 μmol·L-1IN與不同濃度的DDP聯合給藥48 h后,DDP對A549/DDP細胞的IC50從22.46 mg·L-1降為6.20 mg·L-1,并且發現與單獨使用DDP組比較,≥6 mg·L-1DDP與20 μmol·L-1IN聯用后,A549/DDP細胞的增殖率顯著降低,差異有統計學意義(P<0.05)。同時,通過Isobologram分析見(Fig3),6 mg·L-1DDP與20 μmol·L-1IN聯用對A549/DDP細胞的IC50坐標d (20,6.2)落在a (DDP IC50)和b (IN IC50)相加線左下方,再次證明了6 mg·L-1DDP與20 μmol·L-1IN聯用對A549/DDP細胞可以產生協同作用。因此選擇低濃度、低毒性的6 mg·L-1DDP與20 μmol·L-1IN聯用進行后續實驗研究。
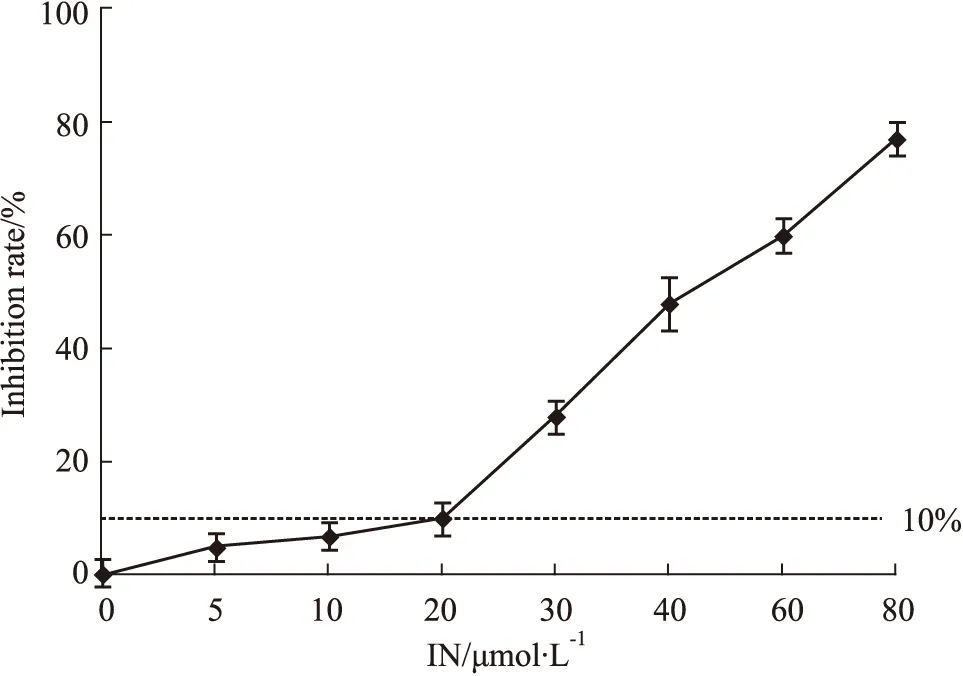
Fig 1 Effect of combination of IN and DDP on proliferation of A549/DDP cells
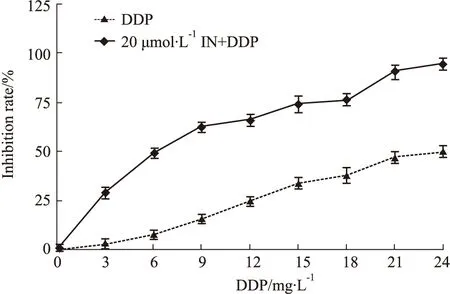
Fig 2 Effect of DDP alone or in combination with IN on proliferation of A549/DDP cells
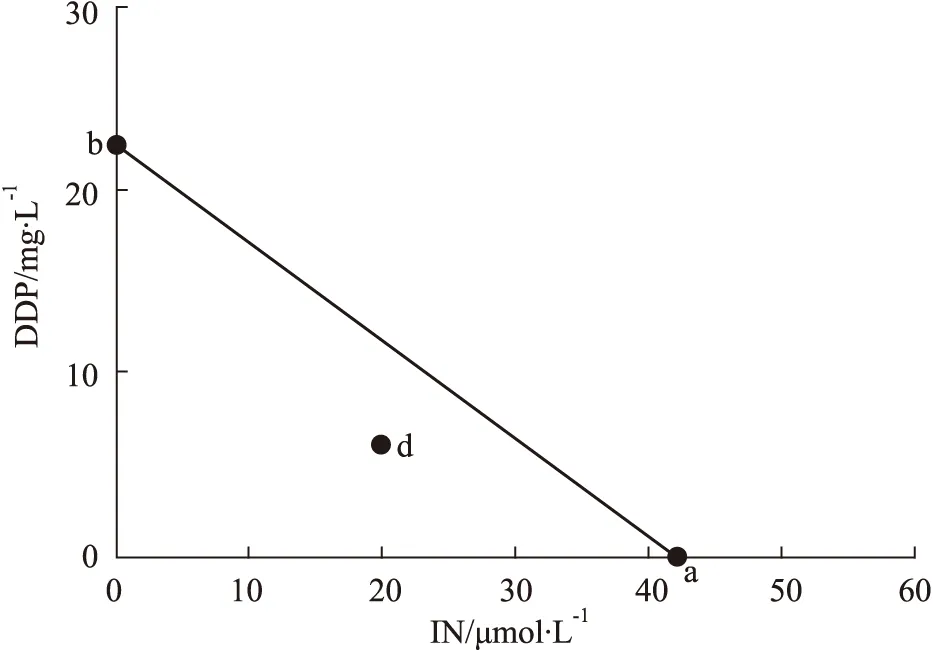
Fig 3 Synergism effect between IN and DDP analyzed with Isobolograma (42.1,0)and b (0,22.46)are the IC50 coordinates of IN and DDP to A549/DDP cells,respectively,d (20,6.20)are the IC50 coordinates of A549/DDP cells when 20 μmol·L-1 IN is combined with DDP.
3.2 IN與DDP聯用誘導A549/DDP細胞凋亡空白組、DDP、IN和IN+DDP組作用A549/DDP細胞48 h后,各組細胞凋亡率分別為(12.29±0.78)%、(14.26±0.25)%、(17.92±0.65)%和(26.73±0.62)%,與空白組、IN組和DDP組比較,聯合用藥組細胞凋亡率明顯升高,差異有統計學意義(P<0.01),見Fig4。
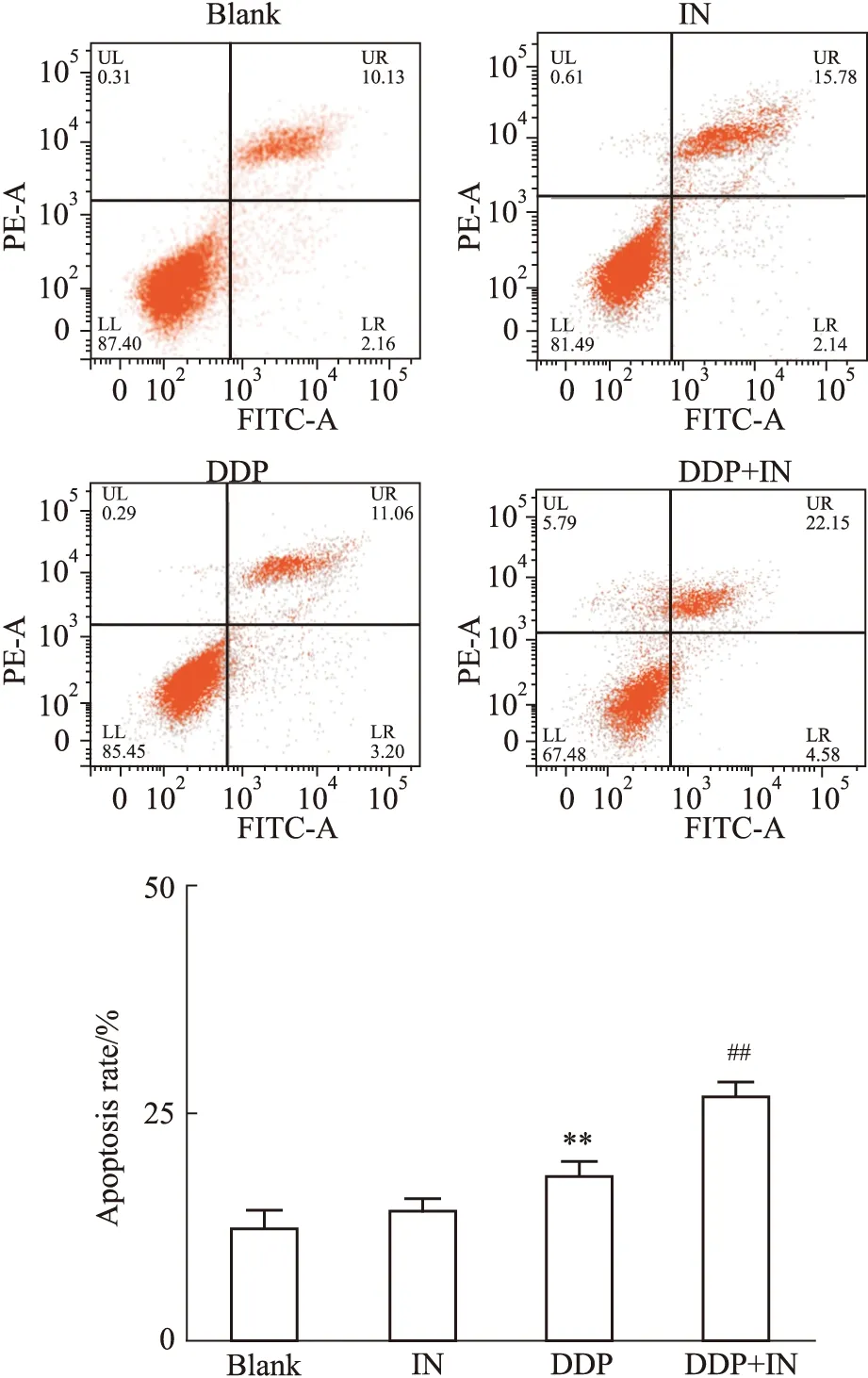
Fig 4 Effect of IN and combined DDP treatment on A549/DDP cell apoptosis**P<0.01 vs the blank group;##P<0.01 vs the other three groups.
3.3 IN與DDP聯用阻滯A549/DDP細胞周期空白組、DDP、IN和IN+DDP組作用A549/DDP細胞48 h后,各組細胞中的G0/G1期DNA含量百分比平均值分別為28.20%、39.06%、59.25%和75.22%。與空白組、IN組和DDP組比較,聯合用藥組作用A549/DDP細胞后,G0/G1期細胞比例明顯升高,細胞分裂周期停滯在G0/G1期的能力更強,差異有統計學意義(P<0.01)。見Fig5。
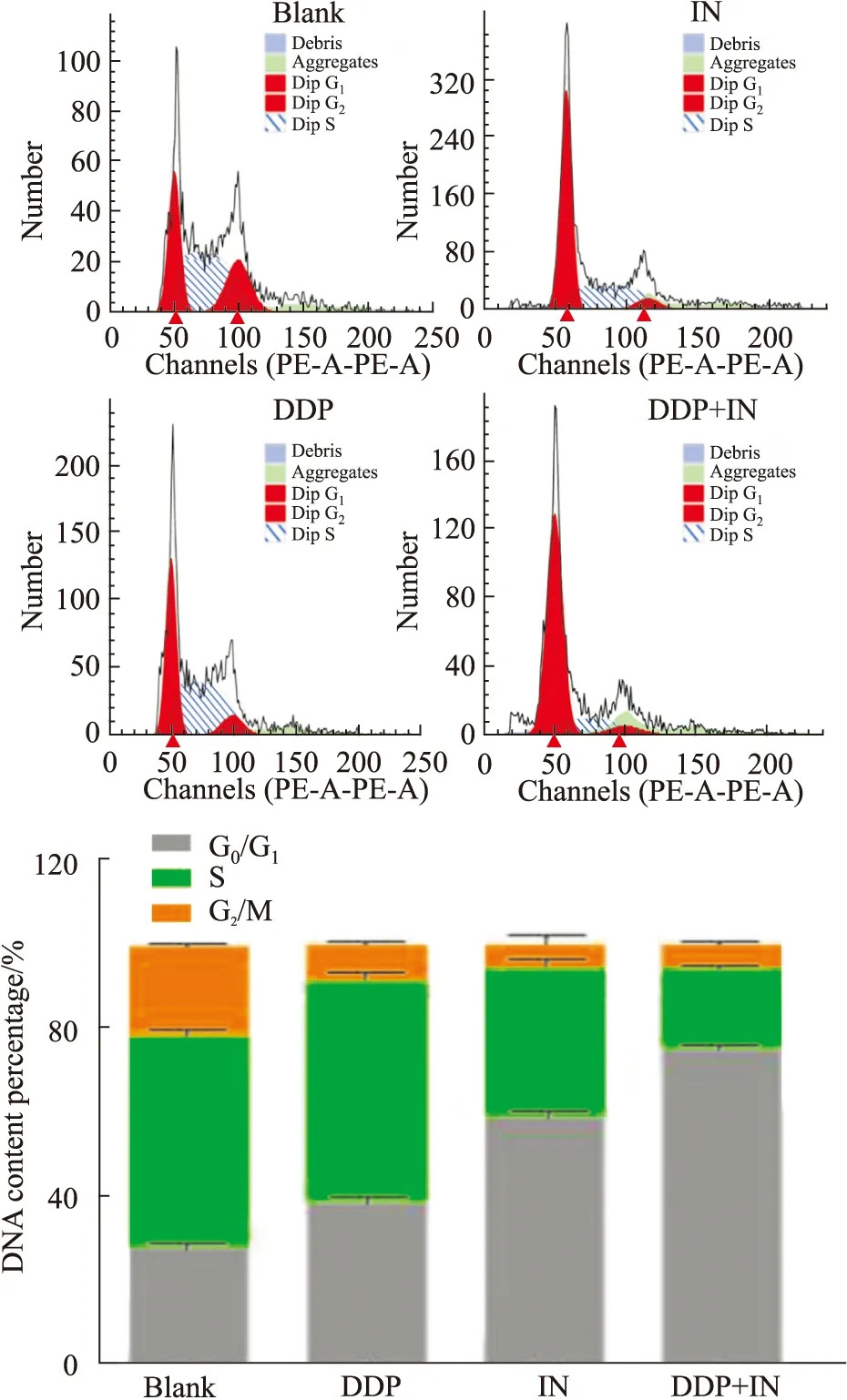
Fig 5 Cycle analysis of A549/DDP cells treated with IN combined with DDP
3.4 IN與DDP聯用降低A549/DDP細胞中P-gp、LRP、MRP、PI3K和p-AKt蛋白表達水平空白組、DDP、IN和IN+DDP組作用A549/DDP細胞48 h后,與空白組、IN組和DDP組比較,聯合用藥組作用細胞中的P-gp、LRP、MRP蛋白表達水平明顯降低,差異有統計學意義(P<0.01),見Fig6。同時,與空白組、IN組、DDP組3組比較,聯合用藥組對A549/DDP細胞中PI3K/AKT信號通路相關蛋白PI3K和p-AKt相對表達水平降低,差異有統計學意義(P<0.01),見Fig7。
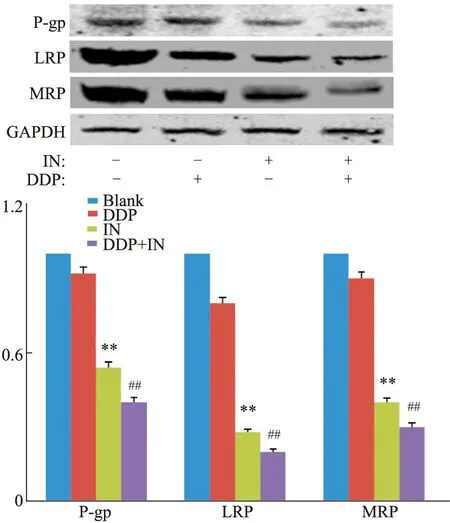
Fig 6 Effect of IN combined with DDP on expression of drug resistance-related proteins in A549/DDP cells**P<0.01 vs the blank group;##P<0.01 vs the other three groups.
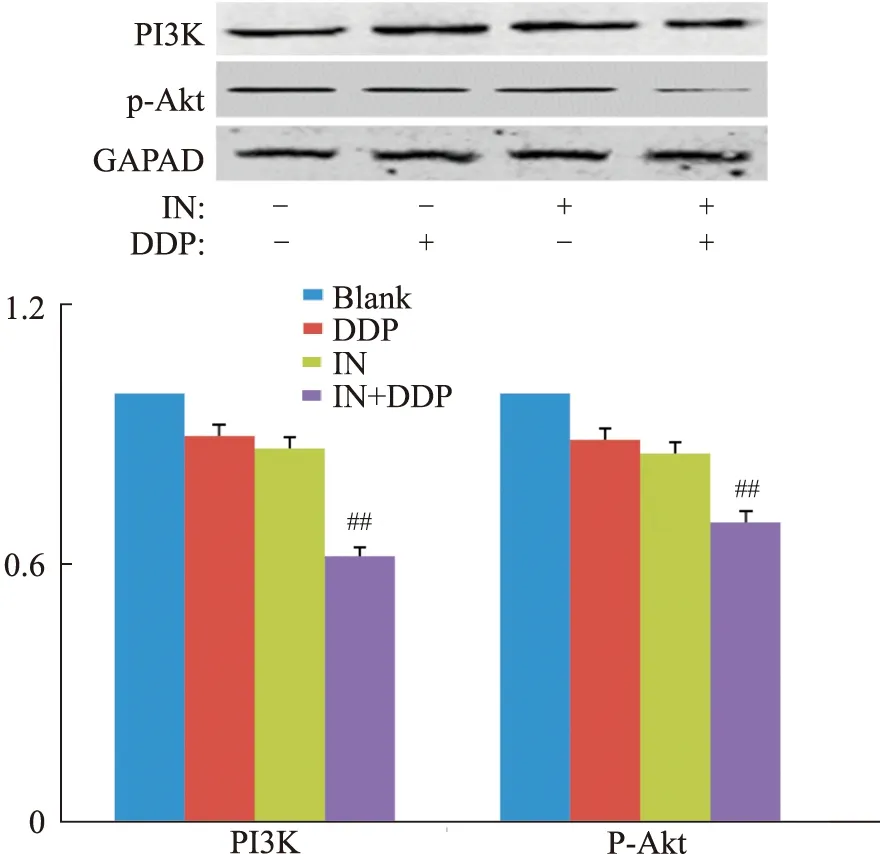
Fig 7 Effect of IN combined DDP on expression levels of PI3K and p-AKt in A549/DDP cells##P<0.01 vs with the other three groups.
4 討論
DDP是治療肺癌的標準化療藥物,但目前化療耐藥已成為提高肺癌患者整體生存率的關鍵制約因素之一[11]。臨床上肺癌患者尤其是NSCLC較容易對化療藥物產生耐藥性,對患者的預后造成極大的不良影響,因此,克服DDP耐藥或者增加其對癌細胞的敏感性對于治療NSCLC具有重要的意義。IN作為一種異戊二烯基黃酮類物質,因其有抗氧化、抑制癌細胞增殖、抗菌及免疫調節等多種生物活性。相關研究表明黃酮類物質與DDP聯合給藥可以減少DDP引起的毒副反應,增加DDP敏感性[12]。在本研究中,我們研究了IN與DDP聯用對人肺癌耐DDP細胞株A549/DDP的協同作用,并探討了其可能的相關機制。
首先,通過CCK-8實驗發現IN呈濃度依賴性明顯抑制A549/DDP細胞生長。IN和DDP單獨使用在低濃度時對A549/DDP細胞增殖無明顯抑制作用,但兩藥聯合應用后則明顯抑制A549/DDP細胞增殖,并通過Isobologram得出結果,發現低濃度的IN與DDP聯用具有協同作用。通過流式細胞儀實驗檢測IN與DDP兩藥聯用對A549/DDP細胞凋亡的作用,實驗結果表明IN與DDP兩藥聯用后促進A549/DDP細胞凋亡的能力更強,阻滯A549/DDP細胞G0/G1期的能力更明顯。
腫瘤的多藥耐藥是多基因多途徑多系統廣泛參與的復雜過程,機制至今尚未完全清楚,目前常見的主要包括P-gp、MRP和LRP等,LRP、MRP、P-gp介導的藥物外排機制已經被認為是最經典以及耐藥效應最明確的腫瘤MDR機制。LRP、MRP、P-gp蛋白是一種依賴ATP供能、具有藥物外排功能的跨膜糖蛋白,是研究的最早也是最深入的耐藥相關蛋白。LRP、MRP和P-gp作為一種具有外排作用的轉運體,降低了細胞內化療藥物的濃度和使藥物遠離鞭點等方式影響腫瘤的凋亡而逆轉MDR[13],相關研究表明,LRP、MRP、P-gp在肺癌耐藥中表達率很高,LRP、MRP、P-gp的高表達是肺癌多藥耐藥發生的主要機制[14]。研究表明,黃酮類化合物藤黃酸和DDP共同處理A549/DDP細胞后,可明顯下調細胞P-gp蛋白的表達,從而表明藤黃酸和DDP聯用發揮協同作用抑制P-gp的表達可使A549/DDP細胞對DDP的敏感增加[15]。本研究結果表明,IN和DDP聯用較空白組和單獨用藥組明顯降低LRP、MRP、P-gp蛋白表達水平,提示聯用可協同抑制人肺腺癌耐DDP細胞株A549/DDP的生長。
PI3K/Akt信號通路是細胞生存重要通路之一,PI3K/AKT通道的激活是腫瘤細胞對化療藥物如DDP、紫杉醇等產生耐藥的關鍵因素,在腫瘤MDR方面,很多研究都證實PI3K/AKT信號參與MDR的形成[16]。肺癌的多種生長因子主要通過PI3K/AKT信號轉導通路而發揮作用,腫瘤細胞經化療藥物作用后增加了AKT磷酸化水平,并激活PI3K/AKT信號通路,活化的AKT進一步激活其下游因子使癌細胞對化療藥物產生耐藥性。研究表明,黃酮類化合物水飛薊素與阿霉素聯合給藥可以增加耐藥乳腺癌細胞MDA-MB-435和MCF-7細胞對阿霉素的敏感性,其機制可能與水飛薊素和DDP聯用發揮協同作用抑制PI3K、AKT和ERK等致癌信號通路分子有關[17]。本研究結果表明,IN和DDP聯用較空白組和單獨用藥組明顯降低PI3K和p-AKt蛋白表達水平,提示兩藥聯用后可協同抑制PI3K/AKt信號通路的活性,從而增強DDP對耐藥細胞的作用。
綜上所述,IN與DDP聯合用藥可起到協同作用阻滯細胞于G0/G1期,促進細胞凋亡,抑制A549/DDP細胞增殖的作用,其可能的機制是通過抑制耐藥蛋白LRP、MRP、P-gp蛋白表達以及抑制PI3K/AKt信號通路的活性,增強DDP對耐藥細胞的作用,進而與DDP對A549/DDP細胞產生協同抗腫瘤作用,這為IN在未來具有作為治療NSCLC的輔助藥物或者DDP的化療增敏劑的潛力提供了科學依據及理論基礎。

