刺山柑總生物堿對系統性硬皮病小鼠Wnt2、Wnt3a及β-catenin的影響
趙宇涵,康小龍,何承輝
(1.新疆醫科大學藥學院,新疆 烏魯木齊 830000;2.新疆維吾爾自治區中醫醫院,新疆 烏魯木齊 830002;3.新疆維吾爾自治區藥物研究所,新疆 烏魯木齊 830004)
系統性硬皮病(systemic scleroderma,SSc)是一種慢性自身免疫性疾病,其特征表現為皮膚和內部器官的纖維化以及血管病變[1]。SSc死亡率極高,但尚未完全解釋其發病機制[2]。本課題組從刺山柑(CapparisspinosaL.)中提取了有效成分刺山柑總生物堿,在前期研究中,我們采用ELISA實驗檢測了SSc模型小鼠血清中Wnt相關蛋白Wnt10b的含量,發現刺山柑總生物堿可降低Wnt10b表達[3],采用ELISA實驗檢測SSc模型小鼠皮膚組織中Wnt1、Wnt2、Wnt3a的蛋白表達,發現刺山柑總生物堿可降低Wnt1、Wnt2、Wnt3a的蛋白表達;采用qRT-PCR法檢測了模型小鼠皮膚組織中β-catenin mRNA的表達,免疫組織化學法檢測了模型小鼠皮膚組織中β-catenin蛋白的表達,發現刺山柑總生物堿可降低β-catenin mRNA蛋白的表達[4-5]。為了確保實驗嚴謹性,避免假陽性,進一步探討刺山柑總生物堿對SSc Wnt通路的作用,本研究將采用更加準確的q-RT PCR方法檢測其對SSc小鼠Wnt通路中Wnt2 mRNA的表達,采用Western blot方法驗證其對SSc小鼠Wnt通路中Wnt3a及β-catenin蛋白表達的影響。
1 材料與儀器
1.1 試驗動物90只SPF級BALB/c雌性小鼠,合格證號:SCXK(京)2016-0006,體質量(18-22)g,北京維通利華實驗動物技術有限公司。
1.2 試驗藥物刺山柑購于新疆麥迪森維藥飲片廠;鹽酸博萊霉素注射劑(批號:17001711,規格:1.5萬U),海正輝瑞制藥有限公司;青霉胺片(批號:052160901,規格:125 mg/100片),上海上藥信誼藥廠。
1.3 試驗試劑SDS-PAGE凝膠制備試劑盒(批號:20181119)、脫脂奶粉(批號:702F0511)、Lowry法蛋白濃度測定試劑盒、SABC(IgG)-POD試劑盒(批號:20200929)(北京索萊寶科技有限公司);Real Time PCR EasyTM-SYBR GreenⅠ熒光實時定量PCR試劑盒、RT EasyTMⅠ反轉錄試劑盒(成都福際生物技術有限公司);β-catenin抗體(Cell signaling technology公司,批號:8480s);Wnt3a抗體(Abcam公司,批號:ab219412);β-actin抗體(武漢博士德生物工程有限公司,批號:BM0627);引物合成于上海生工股份有限公司。
1.4 試驗儀器低溫離心機(型號:LEDEND MICRO21)、核酸蛋白測定儀(型號:NANO DROP 2000)、實時定量PCR儀(型號:Step One PlusTM),美國Thermo Fisher公司;Western blot設備(型號:Mini-protean Tetra System),美國Biorad公司;BMJ-A型包埋機;旋轉式生物組織切片儀(型號:RM2016);顯微鏡(型號:Leica DM300)。
2 方法
2.1 制備原藥刺山柑果實加10倍95%的乙醇于80 ℃的水浴鍋加熱回流提取,30 min/次,提2次,過濾,2次濾液減壓濃縮至藥材藥液質量比為2 ∶1。提取物濃縮干燥后經紫外分光光度法(UV)測得總生物堿水平為32%(W/W),高效液相色譜法(HPLC)測得鹽酸水蘇堿水平為2.2%(W/W)。
精密稱取基質硬脂酸、月桂氮卓酮、白凡士林、單硬脂酸甘油酯作為油相,甘油與刺山柑總生物堿提取物濃縮液作為水相,十二烷基硫酸鈉、對羥基苯甲酸乙酯作為乳化劑。制備方法:將上述各相水浴加熱至90 ℃溶融,依次將水相和乳化劑加入油相中,邊加邊攪拌至完全乳化,乳膏顏色均勻、質地細膩為乳化完全,封口備用。
2.2 小鼠SSc模型的建立、分組及給藥BALB/c小鼠90只隨機分成空白組、SSc模型組、刺山柑總生物堿藥物低(225 mg·kg-1)、中(450 mg·kg-1)、高(900 mg·kg-1)劑量給藥組及青霉胺(125 mg·kg-1)陽性藥組等6組。除空白組外,剩余幾組小鼠背部皮下注射博來霉素(BLM)(劑量0.03 g·d-1),28 d建立SSc模型。給藥組背部外敷受試藥,陽性藥組小鼠青霉胺灌胃,空白組與模型組敷無藥乳膏基質,以上步驟每天1次×60 d。最后一天給藥后將小鼠處死,取其給藥處皮膚組織,分成2份,1份凍存于-80 ℃,1份置于10%福爾馬林中備用。
2.3 Western blot測定β-catenin蛋白表達取小鼠皮膚,每0.10 g+1 mL RIPA裂解液,勻漿至充分裂解,12 000 r·min-1低溫離心5 min取其上清液。取適量上清用Lowry法蛋白濃度測定試劑盒測定蛋白濃度,按照濃度確定上樣量,使每孔蛋白上樣量一致。樣品加入5×上樣緩沖液后水浴10 min使之變性,離心2 min點樣至各孔于80 V電壓下進行聚丙烯酰胺凝膠電泳。取凝膠在200 mA電流下電轉至PVDF膜,5%脫脂奶粉封閉1 h,β-catenin一抗孵育2 h,TBST洗脫3次(10 min/次),二抗孵育1 h后再用TBST洗脫3次,加化學發光劑ECL于暗室曝光,得β-catenin蛋白條帶。將曝光后的PVDF膜取出,用膜再生液洗去一抗后重新封閉,將一抗換成β-actin內參,重復上述步驟,得內參條帶。用ImageJ軟件掃描條帶,以灰度值做相對蛋白表達量分析。
2.4 RT-PCR測定Wnt2蛋白表達取小鼠皮膚每0.10 g加1 mL裂解液提取總RNA(OD260/OD280≈1.8-2.0),按照DNA/RNA濃度測定儀測定的RNA濃度加入DEPC水使每組的總RNA含量相同。總RNA反轉錄為cDNA進行RT-PCR,以Rn18s作為內參對照,95 ℃ 10min預變性,95 ℃ 15 s變性,60 ℃ 30 s退火,72 ℃ 10 s延伸,40個循環。相對定量結果分析采用比較熒光強度達閾值時的循環數(Ct)值法(2-△△Ct法),即相對表達量=2-△△Ct,△Ct=Ct目標基因-Ct內參基因,△△Ct=△Ct實驗組-△Ct對照組。
引物序列 :
Rn18s:F(5′-CTATTTTGGTTTTCGGAACTGAG-3′)
Rn18s:R(5′-TTGGCAAATGCTTTCGCTCTG-3′)
Wnt2:F(5′-GGATGGCACTGGCTTCACTGTAG-3′)
Wnt2:R(5′-CCTGCCTCTCGGTCCCTGATAC-3′)
2.5 測定Wnt3a蛋白表達
2.5.1免疫組化法 將福爾馬林液中固定小鼠皮膚取出進行蠟塊包埋、切片置5 mm于防脫載玻片,脫臘至水,按SABC(IgG)-POD試劑盒方法進行操作(一抗:Wnt3a抗體)后于顯微鏡下攝片。用Image Pro Plus軟件進行分析,以IOD/Area值做相對表達量分析。
2.6 統計學方法全部實驗數值導入Excel表,統計軟件為SPSS 21.0,方差分析比較各組間均數差異,方差齊用LSD法,方差不齊時用Duunett′s T3法比較組間差異。
3 結果
3.1 各組小鼠皮膚中β-catenin 蛋白表達比較Western blot檢測小鼠皮膚組織β-catenin蛋白表達結果如Fig1A、B,模型組相對于空白組表達量明顯增加(P<0.05),中、高劑量受試藥劑量組以及青霉胺組相對于模型組表達量明顯降低(P<0.05)。
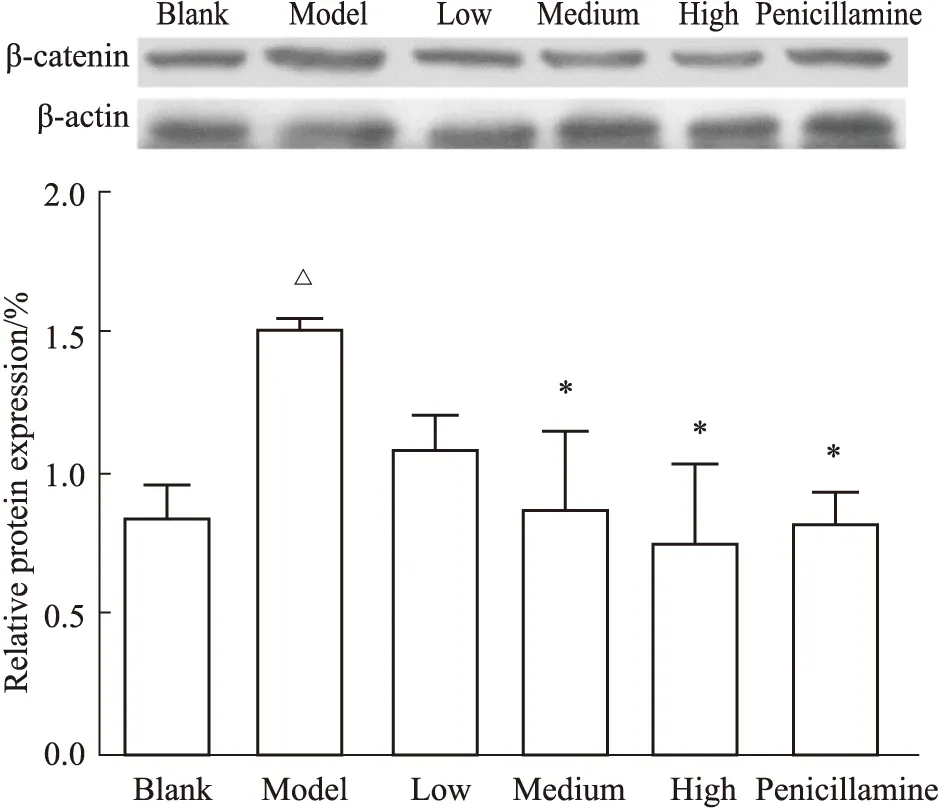
Fig 1 Comparison of relative expression of β-catenin protein in mouse skin by Western blot (n=5)△P<0.05 vs blank group;*P<0.05 vs model group.
3.2 各組小鼠Wnt2 mRNA表達比較qRT-PCR檢測結果顯示:各組小鼠皮膚組織Wnt2 mRNA的表達量如Fig2,模型組相較于空白組表達量增加(P<0.01),與模型組相比,受試藥各組與青霉胺組表達量降低(P<0.01)。
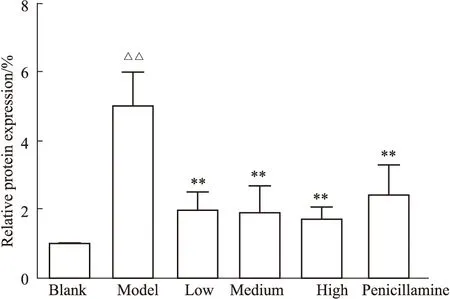
Fig 2 Comparison of Wnt2 mRNA relative expression in mouse skin (n=6)△△P<0.01 vs blank group;**P<0.01 vs model group.
3.3 各組小鼠皮膚中Wnt3a蛋白表達比較
3.3.1免疫組化法檢測小鼠皮膚組織Wnt3a蛋白表達 結果如Fig3,模型組相對于空白組表達量明顯增加(P<0.01),受試藥各劑量組及青霉胺組相對于模型組表達量明顯降低(P<0.01)。
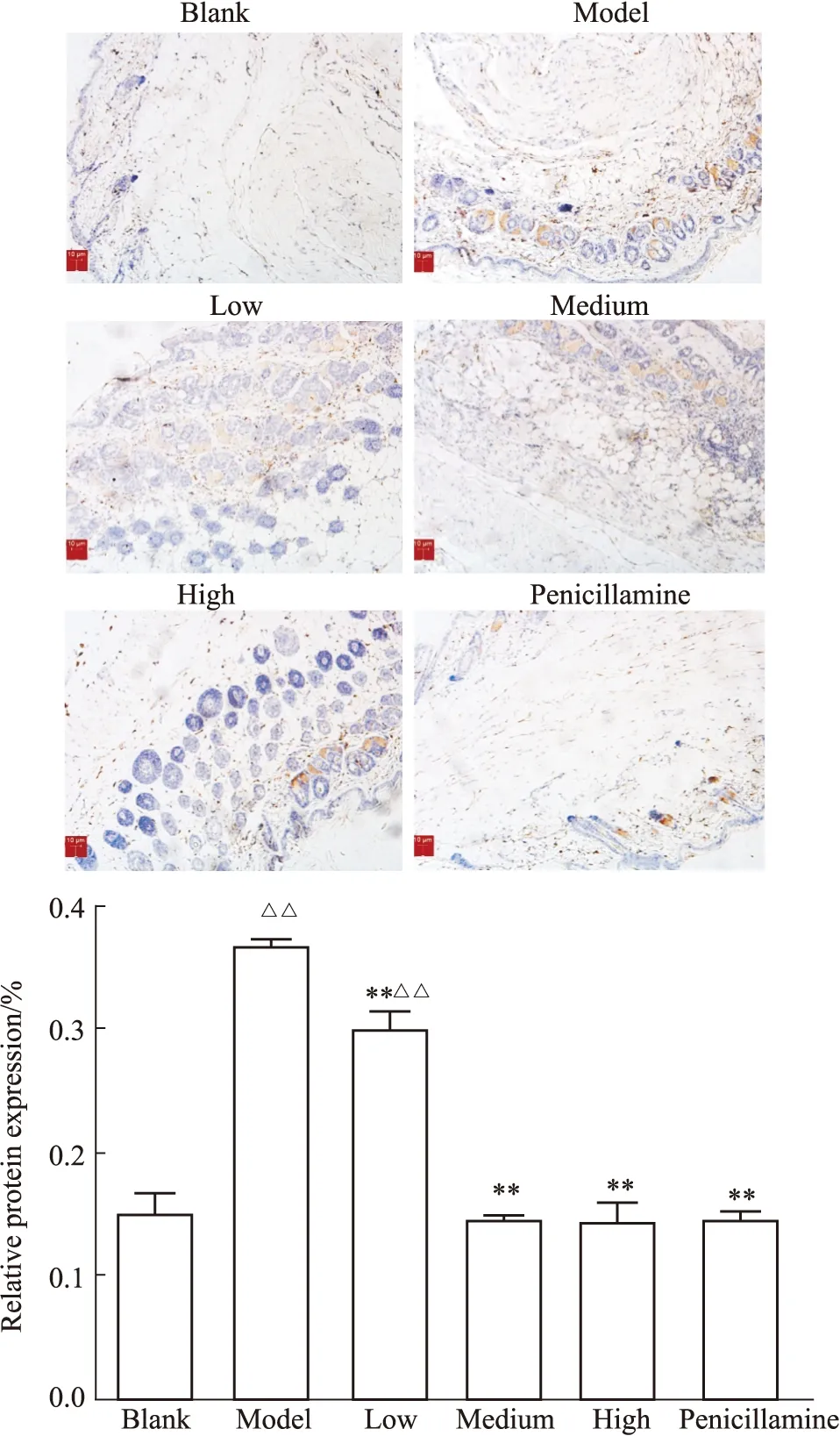
Fig 3 The relative expression of Wnt3a protein in mouse skin detected by immunohistochemistry (n=6)△△P<0.01 vs blank group;**P<0.01 vs model group.
3.3.2Western blot法檢測小鼠皮膚組織Wnt3a蛋白表達 結果如Fig4,模型組相對于空白組表達量明顯增加(P<0.01),中、高受試藥劑量組以及青霉胺組相對于模型組表達量明顯降低(P<0.01)。

Fig 4 Comparison of relative expression of Wnt3a protein in mouse skin by Western blot (n=5)△△P<0.01 vs the blank group;**P<0.01 vs the model group.
4 討論
SSc是一種復雜的臨床異質性疾病,與多個器官的纖維化有關[6]。肌成纖維細胞是高度收縮的間充質細胞,在SSc和其他纖維化疾病的纖維化發病機制中起著核心作用,研究證實Morphogen信號途徑的激活會導致肌成纖維細胞的過度表達[7-8]。Morphogen途徑包括Wnt、Notch和Hedgehog信號級聯,是胚胎發育和成人組織動態平衡的主要調節器[9]。
經典的Wnt途徑是高度保守的細胞間信號傳導途徑,出現在后生動物中,其信號傳導在發育,組織穩態的維持以及受損組織的再生中起著至關重要的作用[10]。在哺乳動物中已經描述了19種Wnt配體和10 種卷曲蛋白(FZD)受體,Wnt途徑包括經典的Wnt /β-catenin途徑和非經典的平面細胞極性(PCP)和Wnt /鈣途徑[11]。在細胞外沒有Wnt配體的情況下,轉錄激活因子β-catenin被胞質“破壞復合物”(由支架蛋白腺瘤性息肉病大腸桿菌(APC)和Axin以及蛋白激酶糖原合酶激酶-3(GSK3)和酪蛋白激酶1α(CK1α)組成)降解;在有Wnt配體時,其與共受體Frizzled和LRP5/6以及胞質蛋白Disheveled(Dvl)的結合誘導構象變化,從而傳遞到Wnt受體的胞內域。形成低聚卷曲蛋白LRP5/6復合物,用于形成活性受體的配合物。破壞復合物中β-catenin的磷酸化和降解最終被阻止,β-catenin積聚在細胞質中,并轉移到細胞核。一旦進入細胞核,β-catenin就可以作為靶基因中Wnt反應元件(WRE)上T細胞因子/淋巴增強因子(TCF/LEF)的共激活因子,從而傳遞Wnt轉錄程序[12]。
近年來,經典的Wnt信號已被深刻表征為纖維化疾病中持續的成纖維細胞活化的重要介體[13]。如通過抑制Wnt3a/β-catenin信號通路可以抑制肺成纖維細胞Ⅰ、Ⅲ型膠原合成[14],Tyler等[15]通過833名SSc患者的遺傳基因和臨床數據分析,發現Wnt子網絡中的部分基因與肺部疾病以及與SSc發病機制有關的分子過程有關。Laetitia等[16]通過實驗表明溶血磷脂酸(LPA1)受體阻滯劑的某些抗SSc纖維化作用可能是通過抑制Wnt信號通路中Wnt2來部分介導的。Wnt /β-catenin信號通路在BLM誘導的SSc小鼠模型中被過度激活,抑制Wnt /β-catenin信號通路的靶基因可以顯著改善SSc小鼠模型的皮膚 纖維化[17]。阻斷皮膚中的β-catenin信號傳導可能逆轉SSc皮膚的脂肪減少和纖維化[18]。本研究結果與其一致,SSc模型組Wnt2 mRNA和Wnt3a、β-catenin蛋白表達量均高于空白組。本次研究結果也與本課題組前期研究結果相一致,β-catenin作為Wnt通路的重要信號因子,所以本次實驗采用了Western blot的方法檢測其蛋白相對表達量,比采用ELISA和免疫組化更能準確的蛋白定量。而免疫組化檢測Wnt3a蛋白能更加準確的定位小鼠皮膚組織內抗原的表達位置,結果表明其在胞質內表達。以上測定方法比前期課題組實驗結果更加嚴謹準確,進一步驗證SSc小鼠皮膚Wnt通路被過度的激活,刺山柑總生物堿可以抑制其β-catenin、Wnt3a蛋白和Wnt2 mRNA的表達,本實驗結果為今后更深一步研究刺山柑總生物堿治療SSc的作用機制提供了參考。

