鹽脅迫對懷玉山三葉青2個栽培種試管苗生理特性和次生代謝產物的影響
洪森榮,陳軒宇,李文麗,張座棟,劉軍,劉佳,蔡紅,陳榮華
(1.上饒師范學院生命科學學院,江西 上饒 334001;2.上饒市藥食同源植物資源保護與利用重點實驗室/上饒市三葉青保育與利用技術創新中心/上饒農業技術創新研究院,江西 上饒 334001;3.上饒市紅日農業開發有限公司,江西 上饒 334700)
三葉青(TetrastigmahemsleyanumDiels et Gilg)為葡萄科崖爬藤屬植物,學名三葉崖爬藤,俗名金絲吊葫蘆,中國特有的藥用植物[1],其地下塊根的主要活性成分包括黃酮、多糖、山奈酚等,可清熱解毒、祛風化痰、活血止痛,具有抗病毒、抗炎、抗腫瘤等生物學功效,臨床上用于治療高熱驚厥、腹痛、肺炎、哮喘、肝炎等癥,被譽為“安全有效的植物抗生素”[2]。懷玉山可謂是“天然藥谷”,此處的三葉青成群落式分布,自古以來便是鄉醫郎中常用的一味退熱良藥[3]。
土壤鹽漬化已經成為全球的生態環境難題,且由工業污染、不合理的農業灌溉、施肥等引起的次生鹽漬化土壤面積仍在不斷擴大,全世界約有20%的耕地遭受鹽漬化脅迫,鹽脅迫與植物的種子萌發、生長發育及分化密切相關[4]。鹽脅迫下,植物會通過生理響應以減輕鹽脅迫帶來的影響[5]。但植物種類不同,其細胞組織結構和代謝機理迥異,鹽脅迫下其生理響應機制和活性成分含量變化存在差異[6]。目前關于三葉青鹽脅迫下生理響應和活性成分變化的研究尚未見報道。因此,本試驗以‘懷玉1號’和‘懷玉2號’懷玉山三葉青試管苗為研究對象,從生理生化和次生代謝兩方面開展其對不同濃度NaCl脅迫的響應研究,以確定2個栽培種的耐鹽能力并揭示其在鹽脅迫下的次生代謝產物(黃酮、多酚、多糖)含量變化規律,這不僅有利于促進懷玉山三葉青耐鹽種質鑒定和篩選,而且對其大棚基質扦插高效栽培具有重要意義。
1 材料與方法
1.1 試驗材料
懷玉山三葉青‘懷玉1號’和‘懷玉2號’試管苗,由上饒師范學院植物組織培養室提供,并由上饒市紅日農業開發有限公司陳榮華高級農藝師進行種質鑒定。
1.2 試驗方法
1.2.1 鹽脅迫培養基的配制和試管苗的鹽脅迫處理 鹽脅迫試驗選用的基礎培養基為MS+1.5 mg·L-1KT+0.3 mg·L-1NAA+30 g·L-1蔗糖+6 g·L-1瓊脂(pH 5.8~6.0),分別添加6種質量濃度的NaCl制得鹽脅迫培養基。NaCl質量濃度分別為0、2、4、6、8、10 g·L-1。在超凈工作臺內切取‘懷玉1號’和‘懷玉2號’試管苗帶2個腋芽、長約1.5~2.0 cm的莖段,接入上述6種固體培養基中,每瓶接種5~6個帶芽莖段,每個處理接種16瓶;置于培養室中培養,培養條件為光照14 h·d-1,光照強度1 500~2 000 lx,溫度(25±1)℃;鹽脅迫處理60 d后結束試驗,同時對其各項生理生化指標進行測定。
1.2.2 株高和生物量測定 株高用直尺測量;生物量參照Green[7]和Wu[8]等的方法測定,將6個鹽脅迫處理的‘懷玉1號’和‘懷玉2號’試管苗洗凈后分別放置于培養皿中,放入80℃烘箱6 h烘干至恒重,取出稱量植株干質量。
1.2.3 有機滲透調節物質含量和相對電導率測定 選取6個鹽脅迫處理的‘懷玉1號’和‘懷玉2號’試管苗葉片用于有機滲透調節物質含量和相對電導率測定。可溶性蛋白(SP)含量采用考馬斯亮藍G-250比色法測定[9];游離脯氨酸(Pro)和可溶性糖(SS)含量分別采用酸性茚三酮比色法和蒽酮比色法測定[10];葉片相對電導率(RC)的測定參照Chen等[11]的方法。
1.2.4 抗氧化酶活性和丙二醛含量測定 選取6個鹽脅迫處理的‘懷玉1號’和‘懷玉2號’試管苗葉片用于抗氧化酶活性及丙二醛(MDA)含量的測定。超氧化物歧化酶(SOD)、過氧化物酶(POD)、過氧化氫酶(CAT)活性以及丙二醛(MDA)含量的測定分別采用愈創木酚法[12]、氮藍四唑(NBT)比色法[13]、紫外分光光度法[14]和硫代巴比妥酸(TBA)比色法[10]。
1.2.5 黃酮、多酚、多糖含量測定 2個栽培種試管苗葉片中的黃酮、多酚、多糖含量用屠玲艷[15]的方法測定。
1.3 數據統計分析
以上試驗均重復3次,所有數據表示為平均值±標準差,并使用SPSS 19.0軟件進行統計分析,用單因素方差分析(One-way ANOVA)及Duncan’s多重比較檢驗處理間的差異顯著性(P<0.05)。
2 結果與分析
2.1 鹽脅迫對懷玉山三葉青2個栽培種試管苗株高和生物量的影響
從圖1可知,2個栽培種試管苗的株高和生物量均隨著NaCl脅迫處理濃度的升高呈先升高后降低的趨勢,‘懷玉1號’‘懷玉2號’分別在2~4、2~6 g·L-1NaCl范圍內與對照差異不顯著。低鹽脅迫(2~4 g·L-1NaCl)對‘懷玉1號’和‘懷玉2號’試管苗的株高和生物量均有促進作用;除6 g·L-1NaCl對‘懷玉2號’株高還有一定促進作用外,中鹽脅迫(6~8 g·L-1NaCl)和高鹽脅迫(10 g·L-1NaCl)對‘懷玉1號’和‘懷玉2號’試管苗的株高和生物量起到顯著抑制作用。特別是高鹽脅迫(10 g·L-1NaCl)造成了2個栽培種部分試管苗的死亡。
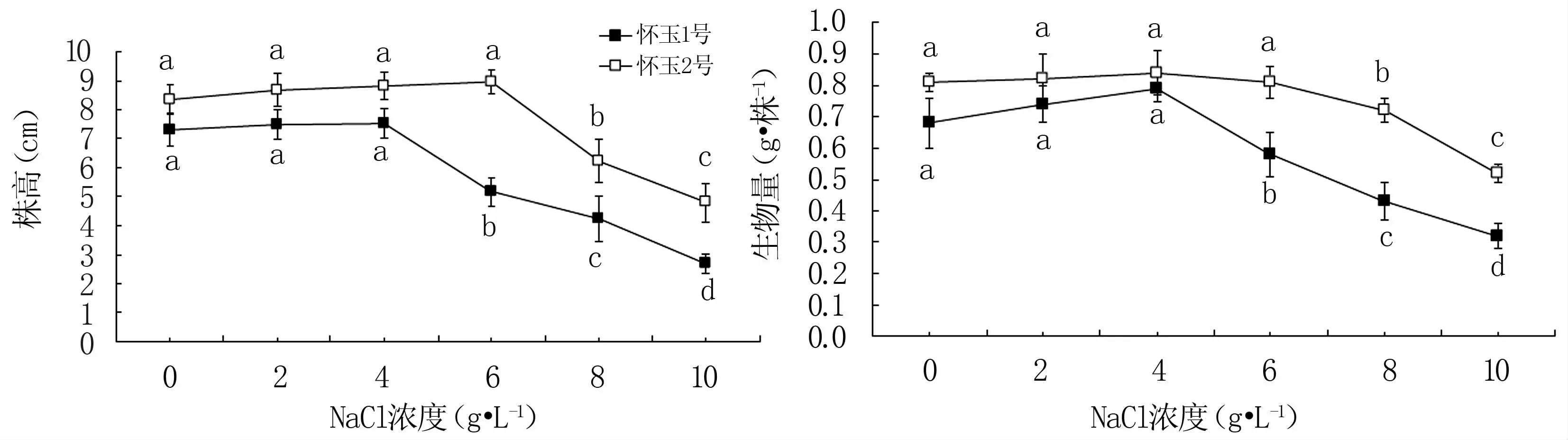
圖1 鹽脅迫對懷玉山三葉青2個栽培種試管苗株高和生物量的影響
2.2 鹽脅迫對懷玉山三葉青2個栽培種試管苗有機滲透調節物質含量和相對電導率的影響
從圖2可知,隨著NaCl脅迫濃度的升高,2個栽培種試管苗的可溶性蛋白、游離脯氨酸、可溶性糖含量均先升高后降低,‘懷玉2號’在6 g·L-1NaCl處理時達到峰值,‘懷玉1號’除可溶性糖含量在2 g·L-1NaCl處理時最高外均在4 g·L-1NaCl處理時達到峰值;而相對電導率持續升高。低鹽脅迫(2~4 g·L-1NaCl)和中鹽脅迫(6~8 g·L-1NaCl)均可顯著提高‘懷玉1號’和‘懷玉2號’試管苗可溶性蛋白和游離脯氨酸的含量;中鹽脅迫(6~8 g·L-1NaCl)也可顯著提高‘懷玉2號’的可溶性糖含量,但對‘懷玉1號’可溶性糖含量的提高作用不顯著;高鹽脅迫(10 g·L-1NaCl)下,‘懷玉1號’和‘懷玉2號’的可溶性蛋白含量、‘懷玉1號’的可溶性糖含量與對照差異不顯著,而兩者的游離脯氨酸和‘懷玉2號’的可溶性糖含量均顯著高于對照。鹽脅迫無論何種濃度均會造成懷玉山三葉青2個栽培種試管苗的相對電導率顯著提高。
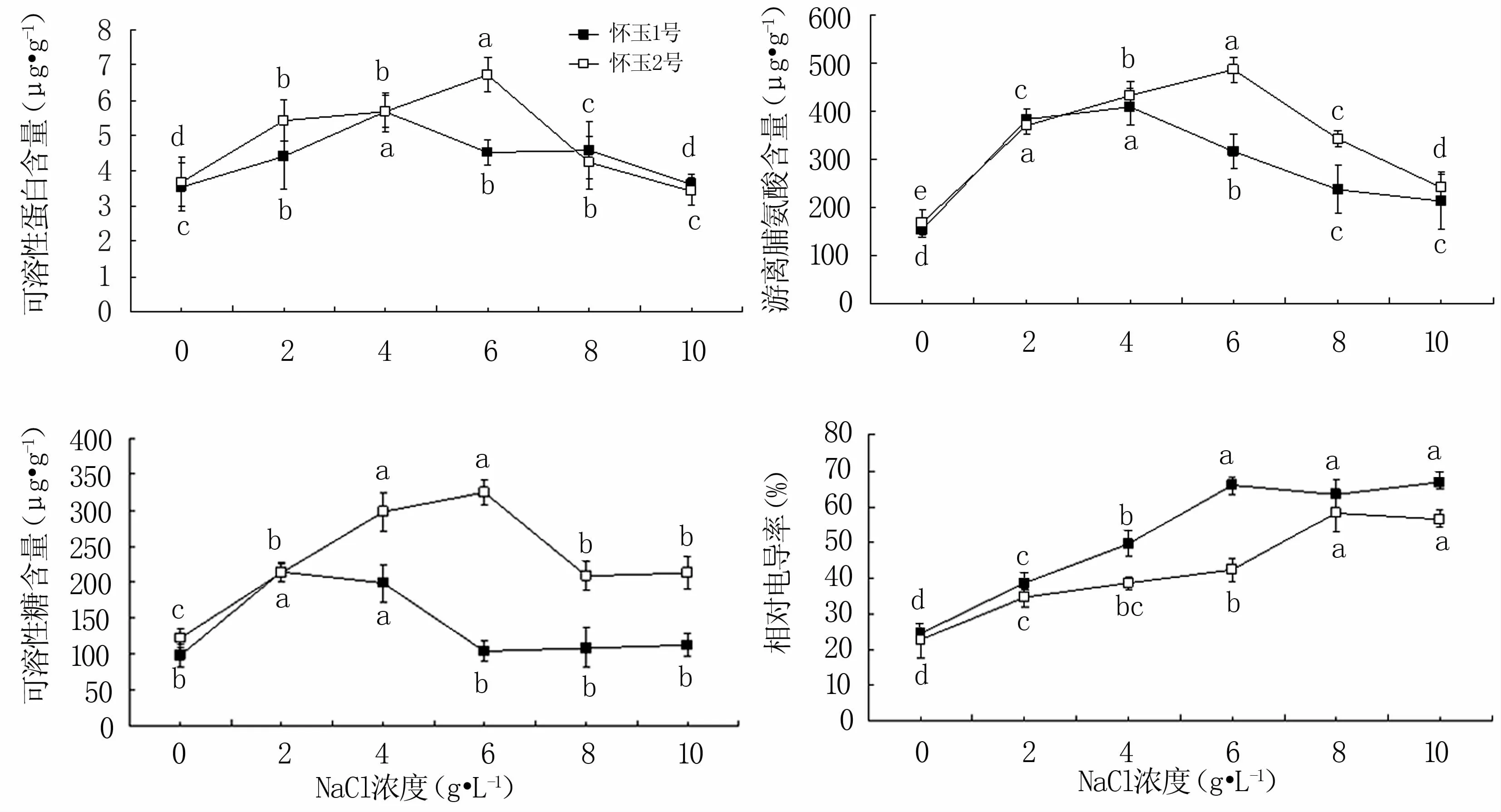
圖2 鹽脅迫對懷玉山三葉青2個栽培種試管苗有機滲透調節物質含量和相對電導率的影響
2.3 鹽脅迫對懷玉山三葉青2個栽培種試管苗抗氧化酶活性和丙二醛含量的影響
從圖3可知,隨NaCl脅迫濃度的升高,懷玉山三葉青2個栽培種的SOD、POD、CAT活性均先升高后降低,總體來說,‘懷玉1號’和‘懷玉2號’的這三種酶活性分別在4 g·L-1和6 g·L-1NaCl脅迫時達到峰值。除高鹽脅迫(10 g·L-1NaCl)下‘懷玉1號’的POD、‘懷玉2號’的CAT活性提高不顯著外,NaCl脅迫處理均可顯著提高‘懷玉1號’和‘懷玉2號’試管苗抗氧化酶活性。鹽脅迫無論何種濃度均會造成懷玉山三葉青2個栽培種試管苗丙二醛含量的顯著提高。
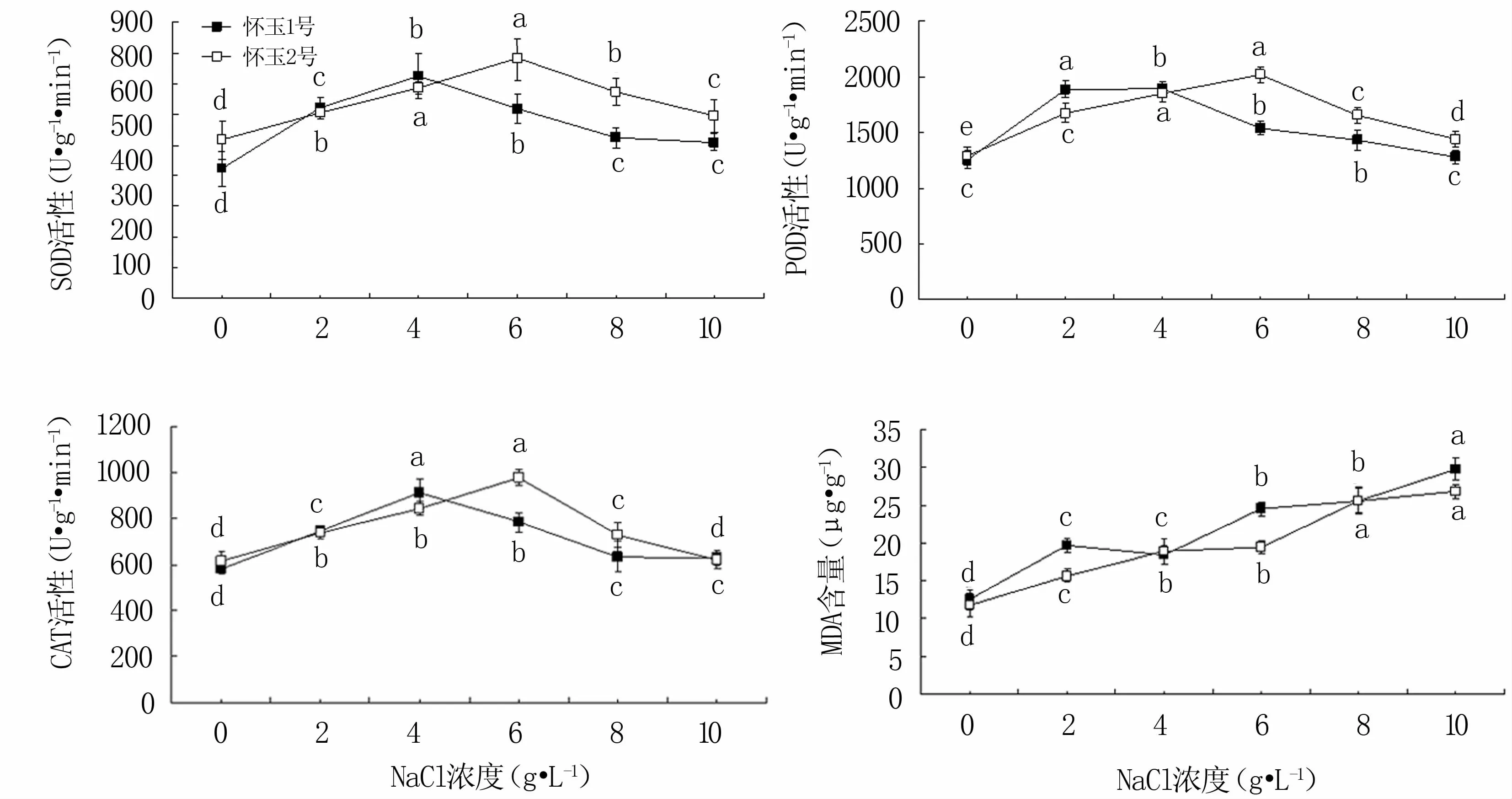
圖3 鹽脅迫對懷玉山三葉青2個栽培種試管苗抗氧化酶活性和丙二醛含量的影響
2.4 鹽脅迫對懷玉山三葉青2個栽培種試管苗葉綠素含量的影響
從圖4可知,2~4 g·L-1NaCl對‘懷玉1號’、2~6 g·L-1NaCl對‘懷玉2號’試管苗葉綠素含量無顯著影響,但NaCl濃度繼續升高,2個栽培種試管苗的葉綠素a、葉綠素b及總葉綠素含量均顯著下降。
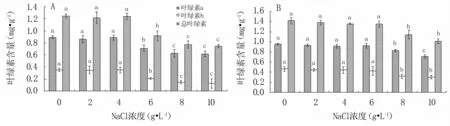
圖4 鹽脅迫對‘懷玉1號’(A)、‘懷玉2號’(B)試管苗葉綠素含量的影響
2.5 鹽脅迫下懷玉山三葉青2個栽培種試管苗生理生化指標的隸屬函數分析
通過鹽脅迫下懷玉山三葉青2個栽培種試管苗的SP、Pro、SS、RC、SOD、POD、CAT、MDA的隸屬函數分析,對懷玉山三葉青2個栽培種的耐鹽性進行評價,結果(表1)表明,‘懷玉1號’除RC和MDA的隸屬函數值高于‘懷玉2號’外,其余指標的隸屬函數值均低于‘懷玉2號’,平均隸屬函數值低于‘懷玉2號’。因此,‘懷玉2號’試管苗的耐鹽性強于‘懷玉1號’。
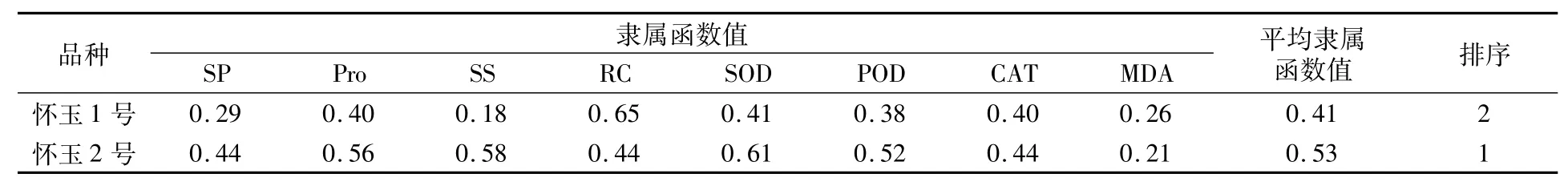
表1 鹽脅迫下懷玉山三葉青2個栽培種試管苗生理生化指標的隸屬函數分析結果
2.6 鹽脅迫下懷玉山三葉青2個栽培種試管苗生理生化指標的相關性分析和主成分分析
通過SPSS 19.0軟件對各指標隸屬函數值進行標準化處理,并對標準化值進行相關性分析,結果(表2)表明,SOD與Pro、POD與Pro、CAT與Pro、MDA與RC、POD與SOD、CAT與SOD、CAT與POD、CAT與SP之間極顯著或顯著相關,因此,SOD、Pro、POD、CAT、MDA和RC可以作為懷玉山三葉青2個栽培種試管苗耐鹽性鑒定的指標。進一步對其進行主成分分析,結果(表3)表明,第1主成分對應較大的指標有MDA、RC、SS、POD、SP;第2主成分對應較大的指標有CAT、Pro、SP、POD、SOD;第3主成分對應較大的指標有SS。然后以每個主成分對應的特征值占所提取主成分總的特征值之和的比例作為權重,計算懷玉山三葉青2個栽培種試管苗的綜合主成分值作為綜合得分,結果(表4)表明,‘懷玉2號’的耐鹽性強于‘懷玉1號’。這與隸屬函數法的評價結果一致。

表2 鹽脅迫下懷玉山三葉青2個栽培種試管苗生理生化指標的相關系數矩陣
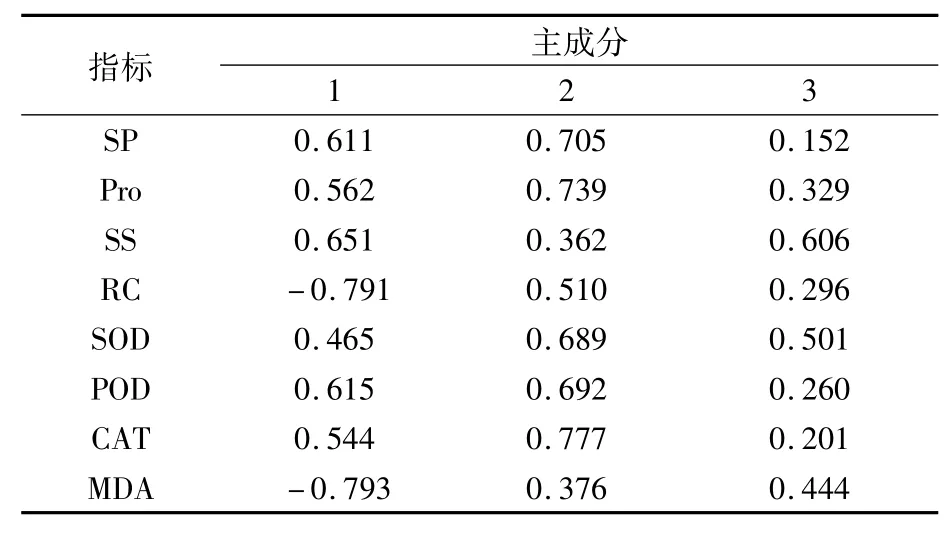
表3 鹽脅迫下懷玉山三葉青2個栽培種試管苗 生理生化指標的主成分得分系數矩陣
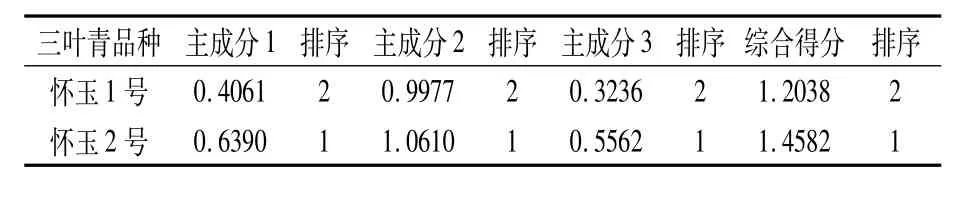
表4 鹽脅迫下懷玉山三葉青2個栽培種試管苗 生理生化指標的各主成分得分及綜合得分
2.7 鹽脅迫對懷玉山三葉青2個栽培種試管苗葉片次生代謝物含量的影響
從圖5可知,隨著鹽脅迫的不斷加重,‘懷玉1號’和‘懷玉2號’試管苗葉片的黃酮和多酚含量呈先升后降趨勢,并分別于4、6 g·L-1NaCl處理時最高,且總體來說,除高鹽脅迫(10 g·L-1NaCl)處理的黃酮和多酚含量與對照差異不顯著外,其他濃度處理均可增加黃酮和多酚的含量;而多糖含量則呈逐漸下降趨勢,當NaCl濃度超過2 g·L-1后下降顯著。表明,低鹽和中鹽脅迫有助于懷玉山三葉青2個栽培種試管苗葉片黃酮和多酚含量的提高,但NaCl脅迫導致葉片多糖含量下降。
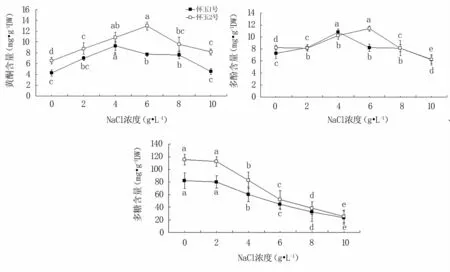
圖5 鹽脅迫對懷玉山三葉青2個栽培種試管苗葉片次生代謝物含量的影響
3 討論與結論
鹽脅迫下,植株組織和器官等形態建成受阻,生長指標和生物量發生變化,是體現植物耐鹽性最直觀的指標[16,17]。在本試驗中,低鹽(2~4 g·L-1)脅迫下,‘懷玉1號’和‘懷玉2號’試管苗長勢正常,其株高和生物量增加,這是其積極應對逆境的一種生理響應,與檉柳[18]鹽脅迫的結果較為一致。但在中鹽(6~8 g·L-1)和高鹽(10 g·L-1)脅迫下,‘懷玉1號’和‘懷玉2號’試管苗葉片相對電導率顯著上升,植株高度、生物量和葉綠素含量顯著下降。光合色素含量下降的原因可能是鹽脅迫對葉綠體結構造成了一定的破壞,提高了葉綠素酶的活性,促進了光合色素的分解[19]。
鹽脅迫下,植物體內會積累大量的活性氧自由基如OH-和O·-2等,造成膜脂過氧化反應,MDA大量積累,膜結構完整和功能穩定性受到破壞[20]。SOD、POD和CAT等抗氧化酶類,可清除過量活性氧,抑制MDA積累,保證植物正常生長代謝[21]。在本試驗中,隨著鹽脅迫濃度增加,‘懷玉1號’和‘懷玉2號’試管苗的MDA含量也顯著增加,相對電導率顯著上升,表明中高鹽脅迫下‘懷玉1號’和‘懷玉2號’試管苗體內會逐漸積累大量的活性氧自由基,膜脂過氧化,膜結構和功能受損,從而影響了‘懷玉1號’和‘懷玉2號’試管苗的生長,這與龍船花[22]在鹽脅迫下的結果一致。
滲透調節作用也是植物適應逆境脅迫的重要生理機制之一。研究表明,鹽脅迫下植物體內會積累大量有機滲透調節物質來維持較高的細胞質滲透壓,增強其滲透調節能力,維持植物的正常吸水和代謝活動[23]。SP作為植物體內重要的滲透物質之一,直接反映鹽脅迫對植物代謝所產生的影響[24]。Pro作為一種重要的有機滲透調節物質,可起到保護生物大分子、清除體內羥基的作用,還可作為植物抵抗鹽脅迫對自身所造成影響最直接的氮源、碳源、還原劑[25]。SS也是一種重要的滲透調節劑,在逆境脅迫下,它對細胞膜和原生質體有一定保護作用,還可在細胞內無機離子濃度高時起保護酶類和促進Pro合成積累的作用[26]。在本試驗中,隨著鹽脅迫濃度增加,‘懷玉1號’和‘懷玉2號’試管苗的Pro、SP和SS均呈先升后降趨勢,且顯著高于對照或與對照相比無顯著差異,說明‘懷玉1號’和‘懷玉2號’試管苗通過積累SP、Pro和SS使得細胞液濃度迅速升高,以便植物在鹽脅迫逆境中提高細胞吸水和保水的能力,維持細胞正常的生理功能,從而提高‘懷玉1號’和‘懷玉2號’試管苗的耐鹽性。
中藥材的品質取決于藥用植物活性成分的含量高低。藥用植物活性成分合成與累積的主要誘導因子為逆境脅迫,且對逆境脅迫的響應因植物種類而異。研究發現,干旱脅迫可顯著提高薯蕷屬植物的總黃酮含量[27],也可提高芝麻中總黃酮、總多酚的含量[28],還可有利于煙草酚類、生物堿等物質的積累[29]。本試驗也表明,隨著鹽脅迫的不斷加重,‘懷玉1號’和‘懷玉2號’試管苗葉片的黃酮和多酚含量呈先升后降趨勢,而多糖含量則呈逐漸下降趨勢,這說明鹽脅迫會增強三葉青的次生代謝,促進次生代謝產物累積,而多糖含量顯著下降可能是由于植物體通過分解體內多糖,提高可溶性糖含量,以此調節細胞滲透壓以適應鹽脅迫帶來的逆境壓力。

