低鹽接種發酵對黃豆醬的發酵過程的影響
肖龍泉,何苗,江鵬,毛競竟,肖迪,劉達玉,劉明學*
(1.西南科技大學 生命科學與工程學院,四川 綿陽 621010;2.成都大學農業農村部雜糧加工重點實驗室,成都 610106)
生產豆醬以蛋白質原料和淀粉質原料為主,因大豆在谷類作物和豆類作物中的蛋白質含量最高,故生產中通常選擇大豆作為蛋白質原料[1],大豆還含有磷脂、維生素、礦物質和大豆異黃酮等多種營養成分[2-3]。絕大部分市面上銷售的黃豆醬的食鹽含量在10%以上[4-5],高鹽豆醬不僅限制了產品的使用量,而且與現在所流行的低鹽飲食有所沖突。隨著生活條件的改善,高鹽飲食越來越不被提倡。高鹽攝入不僅會引起血管功能障礙[6],而且會誘發高血壓[7-8]。因此,低鹽飲食被越來越多的消費者所接受,豆醬產品低鹽化是產品升級換代的必然趨勢,使用低鹽接種工藝不僅使得產品更加綠色健康,風味更加飽滿,且豆醬在低鹽環境下發酵,微生物的生長更加旺盛,有利于改善豆醬的風味[9]。
1 材料與方法
1.1 實驗材料
黃豆、面粉:購于沃爾瑪超市;氫氧化鈉、福林酚、無水碳酸鈉、三氯乙酸、硝酸鋁、醋酸鉀、磷酸二氫鈉、磷酸氫二鈉、鹽酸、鄰苯二甲酸氫鉀:均為分析純;酚酞(指示劑)、酪氨酸(BR)、干酪素(BR):均購于成都市科隆化學品有限公司;米曲霉滬釀3.042:山東和眾康源生物科技有限公司。
1.2 主要儀器與設備
UV-5200型紫外可見分光光度計 上海元析儀器有限公司;KH3200V型超聲波清洗 昆山禾創超聲儀器有限公司;HH-8型電熱恒溫水浴鍋 北京科偉永興儀器有限公司;LD-5型離心機 江蘇省金壇市榮華儀器制造有限公司;SPX-150B智能型生化培養箱、101-4型恒溫鼓風干燥箱 上海瑯玕實驗設備有限公司;FA2004型電子天平 上海佑科儀器儀表有限公司;PHS-2F pH計 上海儀電科學儀器股份有限公司;Testo 205便攜式pH計 德圖儀表(深圳)有限公司;CS-220粉末色差儀 杭州彩譜科技有限公司;HZ85-2型磁力攪拌器 北京中興偉業儀器有限公司。
1.3 實驗方法
1.3.1 黃豆醬的制曲工藝
泡豆→蒸煮→拌粉接種→制曲→裝罐發酵。
1.3.1.1 泡豆
豆與水以1∶3(g/mL)的配比于25 ℃條件下浸泡12 h,大豆的完全吸水率可達到2.1倍。
1.3.1.2 蒸煮
隔水蒸煮黃豆約45 min,直至豆粒完整,有彈性,手搓可成粉且無夾生,顏色為黃褐色。
1.3.1.3 拌粉接種
將面粉與米曲霉按10000∶4的比例混合,然后和蒸熟冷卻到45 ℃左右的黃豆以4∶1的比例混合。
1.3.1.4 制曲
將拌好的大豆放入恒溫培養箱中,調節溫度為30 ℃,并在大豆上面蓋一層濕潤的紗布,從而使制曲過程中的霉菌獲得適宜的空氣和濕度。
1.3.1.5 裝罐發酵
將黃豆和鹽水(低鹽濃度為10%,高鹽濃度為15%)按質量比1∶1加入已用沸水煮10 min的玻璃罐中,置于30 ℃培養箱中進行發酵。
1.3.2 水分含量的測定
根據GB 5009.3-2016《食品中水分的測定》中的直接干燥法進行水分測定[10]。
1.3.3 蛋白酶活力的測定
根據SB/T 10317-1999《蛋白酶活力測定法》測定[11]。
1.3.4 氨基酸態氮含量的測定
根據GB 5009.235-2016中的電位滴定法進行測定[12]。
1.3.5 色差的測定
均勻取樣10.000 g樣品于研缽中,碾成均勻糊狀,然后轉移至潔凈的稱量紙上,色差儀在每次使用前保證儀器潔凈無污染并校正,用色差儀測量3次后取平均值。
1.3.6 pH值的測定
使用便攜式pH計直接插入樣品中測量,直接讀數,pH計使用前按照說明書進行校正。
1.3.7 總酸的測定
根據GB/T 12456-2008中的方法進行檢測[13]。
2 結果與分析
2.1 制曲過程中水分含量的變化
由圖1可知,在制曲過程中,兩組樣品的水分含量均隨著時間的增加而逐漸降低,其水分含量均從50%左右降低至30%左右,且自然制曲和接種制曲條件的樣品水分含量下降趨勢基本相同,水分降低的主要原因是制曲過程中水分蒸發所致。30 ℃條件下培養72 h時,自然制曲組水分含量下降至31.1%,接種米曲霉組的水分含量為30.7%,二者水分含量變化未出現明顯差異。

圖1 豆醬制曲過程中水分含量的變化Fig.1 The changes of moisture content in soybean paste during koji making
2.2 制曲過程中蛋白酶活力的變化
由圖3可知,在制曲過程中,二者相比,接種米曲霉的樣品的蛋白酶活力始終大于自然發酵的樣品,自然制曲組和接種米曲霉的樣品蛋白酶活力都隨著時間的增加先呈現出遞增趨勢,并且蛋白酶活力在60 h時達到最大值,此時自然制曲組蛋白酶活力為1215 U/g干基,接種米曲霉組的蛋白酶活力為1813 U/g干基,兩組相差598 U/g干基,接種米曲霉組蛋白酶活力是自然組蛋白酶活力的1.5倍。而在制曲60 h后蛋白酶活力出現下降趨勢,其原因可能是水分含量下降導致微生物生長繁殖受限;此外,米曲霉分解蛋白質產生的氨基酸、多肽等胞外蛋白物質在60 h后開始大量積累,對蛋白酶的抑制作用和淀粉水解產物葡萄糖等對霉菌產蛋白酶的阻礙作用都會導致蛋白酶活力先增加后減小[14]。

圖2 蛋白酶活力標準曲線Fig.2 The standard curve of protease activity

圖3 豆醬制曲過程中蛋白酶活力的變化Fig.3 The changes of protease activity of soybean paste during koji making
2.3 氨基酸態氮含量的變化
由圖4可知,3組樣品的氨基酸態氮含量都隨著時間而增加,最后趨于穩定,其中,自然發酵的豆醬的氨基酸態氮含量上升趨勢較緩,而接種米曲霉的豆醬的氨基酸態氮含量漲幅則較大,在發酵第13天時,3組樣品的氨基酸態氮含量差值達到最大,此時自然發酵組的氨基酸態氮含量為0.34 g/100 g,接種米曲霉的高鹽組氨基酸態氮含量為1.11 g/100 g,接種米曲霉的低鹽組氨基酸態氮含量為1.22 g/100 g,三者最大相差0.88 g/100 g,說明接種米曲霉的豆醬生長趨勢優于自然發酵的豆醬,且低鹽接種發酵優于高鹽接種發酵。

圖4 氨基酸態氮含量的變化Fig.4 The changes of amino acid nitrogen content during fermentation
2.4 總酸含量的變化
由圖5可知,無論是低鹽黃豆醬還是高鹽黃豆醬,總酸含量的變化趨勢都是先逐漸上升后變緩。對比3組樣品可以發現,在發酵第14天時,低鹽接種米曲霉組樣品的總酸含量最高,其次為高鹽接種米曲霉組,自然發酵組的總酸含量最低。由于在酶系作用下產生的氨基酸、脂肪酸、乳酸等有機酸使得總酸含量增加,發酵后期微生物代謝減緩,酸類物質生成量參與酯化反應和美拉德反應的消耗量基本持平。在發酵第4~5天之間,自然發酵的總酸含量高于接種發酵(高鹽)的總酸含量,這是由于在自然發酵的初期,罐內大量繁殖乳酸菌,尤其在溫度較高的后期,乳酸菌利用發酵性糖代謝產生乳酸等有機酸,因此總酸含量較高。總酸含量趨于平緩的原因是隨著發酵的不斷進行,由于豆醬體系環境的變化,瓶中微生物衰亡,從而導致微生物的代謝活動基本停止,而代謝活動中產生的酸類物質參與酯化反應等,所以總酸含量下降至穩定。

圖5 總酸含量的變化Fig.5 The changes of total acid content during fermentation
2.5 pH值的變化
由圖6可知,豆醬的pH總體呈先下降后保持平穩的趨勢,3組中自然發酵組的pH最低,其原因可能是接種米曲霉組米曲霉大量繁殖,與產酸細菌如乳酸菌之間形成競爭關系,3組相比,自然發酵組產乳酸菌生長最旺,導致其pH最低。隨著發酵時間的增加,厭氧菌乳酸菌逐漸繁殖起來,從而使pH繼續下降;最后由于豆醬體系環境的變化,使得微生物逐漸衰亡,從而導致微生物代謝活動基本停止;而代謝產生的酸類物質參與酯化反應等,所以最終pH趨于平緩。

圖6 pH值的變化Fig.6 The changes of pH values during fermentation
2.6 色差的變化
由表1可知,在裝罐發酵過程中,3組樣品的黃度值b*、亮度值L*整體上均呈現逐漸降低趨勢,說明豆醬會隨著時間的增加而變暗。三者相比,自然發酵過程中L*值最高,b*值最低,主要原因是接種制曲組米曲霉生長旺盛,使其顏色與自然發酵組出現明顯差異,最終導致接種發酵組的亮度值L*相對偏低,b*偏高。
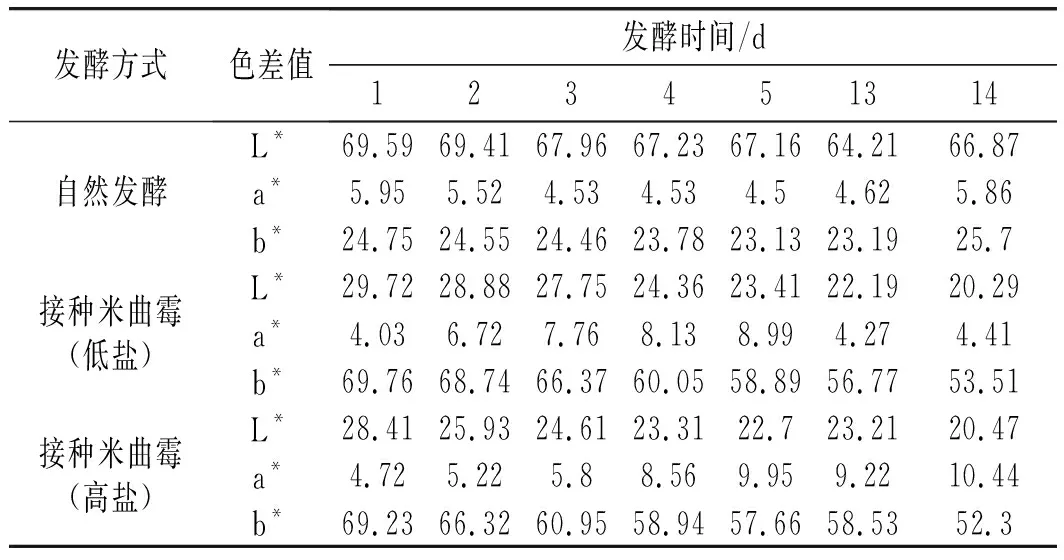
表1 不同發酵方式色差值的變化Table 1 The changes of color difference values by different fermentation methods
3 小結
豆醬的制曲過程中,所有樣品的水分含量都呈現下降趨勢,蛋白酶活力呈現先上升后下降的趨勢,無論是自然發酵組還是接種米曲霉組,其蛋白酶活力均在60 h達到最大值,自然發酵的蛋白酶活力為1215 U/g干基,而接種了米曲霉的樣品的蛋白酶活力為1813 U/g干基,是自然發酵的1.5倍,之后酶活開始下降。
隨著發酵的進行,自然發酵和接種發酵樣品的顏色逐漸加深,pH逐漸下降。氨基酸態氮含量均呈現上升趨勢,接種米曲霉的上升趨勢明顯高于自然發酵的豆醬;在發酵第14天時,自然發酵組的氨基酸態氮含量為0.34 g/100 g,接種米曲霉的高鹽組氨基酸態氮含量為1.11 g/100 g,接種米曲霉的低鹽組氨基酸態氮含量為1.22 g/100 g。

