電導率與濃度關系在處理乙酸乙酯皂化反應的 實驗數據中的應用
林潔麗,陳滸,林潔玲(佛山科學技術學院,環境與化學工程學院,廣東 佛山 528000)
0 引言
高校經常選擇典型的乙酸乙酯皂化反應為研究二級反應的實驗項目。通過測量不同時間下的電導率,推導出濃度隨時間的變化,從而給出反應速率常數。相關討論和改進的報道很多[1-2],在傳統的教材一般是認為電導率近似與濃度成正比,本論文定其為線性關系常規法,再利用它們更為準確的非線性關系來處理實驗數據,發現兩種方法處理的結果很不一致。
1 實驗原理
設乙酸乙酯和氫氧化鈉的原始濃度相等,均為c0mol·m?3,反應時間為t時,濃度變為c mol·m?3,反應完全時濃度為0。皂化反應如下:

實驗中通過測量電導率的變化來反映濃度的變化。本體系中,影響電導率的離子是Na+、OH-和CH3COO-,實際就是物質NaOH和CH3COONa的濃度決定電導率。下面討論濃度與電導率的具體關系。
1.1 線性關系
設0κ、tκ、∞κ分別為反應初始時刻、反應某時刻、反應完全時刻體系的電導率數值,強電解質在稀溶液中的電導率數值近似與濃度成正比[1],設NaOH和CH3COONa的電導率與濃度的關系比例系數分別為B1、B2,則各電導率數值與濃度關系為:


1.2 非線性關系
前面認為電導率與濃度成正比是大多數教材處理該實驗數據的常規做法,這等于假設摩爾電導率mΛ 不隨濃度變化,而柯爾勞施根據大量實驗發現在很稀的強電解質溶液中,其摩爾電導率與濃度的平方根呈線性關系[2]:

2 實驗結果


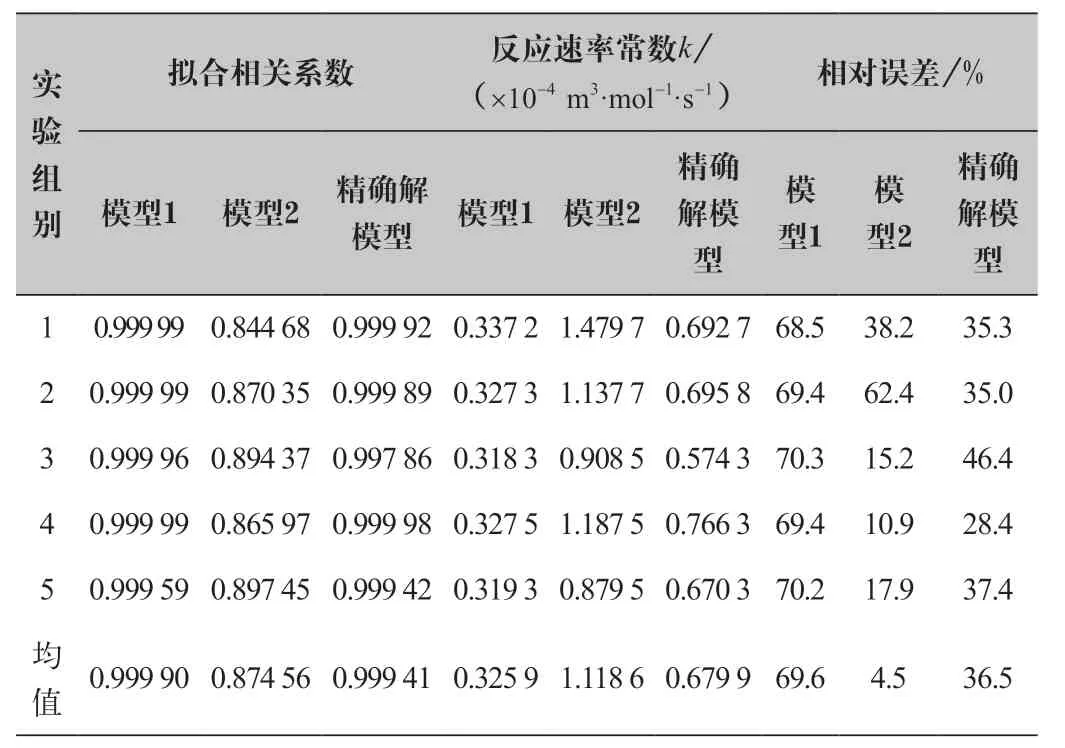
表1 三種模型處理同樣實驗數據得到的擬合相關系數與 反應速率常數及其相對誤差
3 結語
利用電導率與濃度的關系推導的處理模型關系公式中,需要注意的是這兩種關系處理數據的模型都有考慮CH3COONa對電導率的影響,并沒有忽略CH3COO-的影響,如果忽略其影響,那么處理得到的反應速率常數比近似解模型1的結果更低,誤差更大。結合理論和分析數據結果,本論文認為在處理乙酸乙酯和氫氧化鈉的皂化反應的實驗數據時,對電導率與濃度的關系需采用柯爾勞施公式才能保證處理結果更準確,即使在更低濃度的反應條件下也不能把電導率看成與濃度成正比。

