動脈導管未閉封堵術后重度溶血的外科治療一例
凌霄 萬俊 林雪峰 鄭少憶 朱鵬
【摘要】機械性溶血是介入治療置入封堵器的嚴重并發癥之一,其主要原因是人體血流與粗糙的封堵器表面發生摩擦導致紅細胞破裂,可表現為醬油色樣尿,伴血紅蛋白降低、黃疸等癥狀,可予降壓、補液、糖皮質激素等保守治療。保守治療無效時,需及時再次行封堵術或外科手術治療。該文報道1例動脈導管未閉封堵術后出現重度溶血的46歲女性患者,經保守治療無效,予創新性手術方式治療后,癥狀好轉出院。結合相關文獻對病例資料進行分析總結,闡述了先天性心臟病封堵術后的并發癥及處理方法。該文介紹的手術方式可縮短手術時間及降低操作復雜程度,希望能為廣大同行提供一絲靈感或經驗。
【關鍵詞】動脈導管未閉;封堵術;溶血;外科治療
Surgical treatment of severe hemolysis after transcatheter closure of patent ductus arteriosus: one case report Ling Xiao, Wan Jun, Lin Xuefeng, Zheng Shaoyi, Zhu Peng. Department of Cardiovascular Surgery, Nanfang Hospital of Southern Medical University, Guangzhou 510515,China
【Abstract】Mechanical hemolysis is one of the serious complications of occluder implantation in interventional therapy, which is mainly caused by the rupture of red blood cells as a result of the severe friction between the red blood cells and the rough surface of the occluder. Patients with mechanical hemolysis exhibit soy sauce-colored urine accompanied by symptoms, such as decreased hemoglobin and jaundice, etc. Mechanical hemolysis can be treated conservative interventions, such as controlled hypotension, fluid replacement and glucocorticoids, etc. When conservative treatment fails, re-occlusion or surgical treatment should be timely performed. In this article, we reported one 46-year-old female patient presenting with severe hemolysis after transcatheter closure of patent ductus arteriosus. Conservative treatment yielded low efficacy, and subsequently innovative surgery was delivered. The patient was recovered and discharged. Combined with relevant literature review, the complications and treatment of congenital heart disease after interventional therapy were illustrated. The procedure introduced in this article significantly shortens the operation time and lowers the surgical complexity, aiming to provide insights or experience for the diagnosis and management of this disease.
【Key words】Patent ductus arteriosus; Occlusion; Hemolysis; Surgical treatment
動脈導管未閉(PDA)是常見的先天性心臟病,目前經皮介入封堵技術治療PDA非常成熟,是先天性心臟病介入治療中成功率最高、療效最確切的方法。PDA封堵術后出現嚴重溶血的發生率低(總體發生率< 0.8%)[1]。溶血一旦確診,經保守藥物治療無效后,應及時再次行封堵術或外科手術治療。由于PDA封堵術后嚴重溶血較為罕見,因此其診斷和治療方案的選擇極具挑戰性[2]。本文介紹了1種取出PDA封堵器的獨創性外科手術方式,并總結了先天性心臟病介入治療后的相關并發癥及治療方式。
病例資料
一、主訴、病史及體格檢查
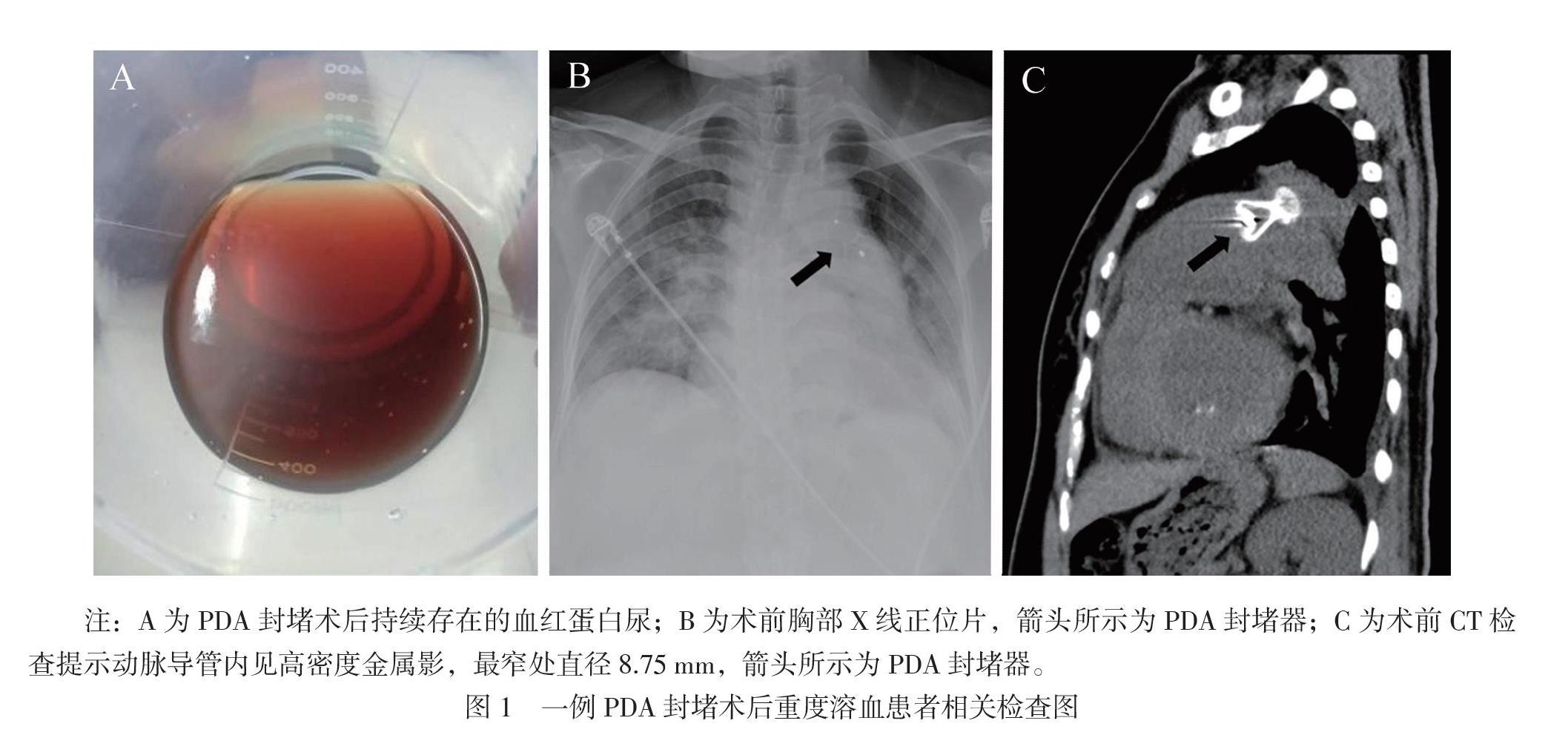
患者女,46歲。因出現黃疸、醬油色樣尿2周于2019年5月16日入院。入院前2周患者因PDA(窗型)于外院行經皮PDA封堵術,術后當晚即出現醬油色樣尿(圖1A),考慮診斷為封堵術后機械性溶血,予對癥治療(具體治療方案不詳)后,醬油色樣尿未見明顯好轉,遂轉至我院。患者既往史及家族史等均無特殊。
體格檢查:體溫 36.7℃,脈搏101次/分,呼吸 22次/分,血壓186/110 mm Hg (1 mm Hg = 0.133 kPa)。顏面部浮腫并黃染,心界向左下擴大,心律整齊,胸骨左緣第二肋間可聞及收縮期Ⅲ/ 6級吹風樣雜音,雙下肢凹陷性水腫,其余心、肺等查體未見明顯異常。
二、實驗室及輔助檢查
血常規:血紅蛋白55 g/L,紅細胞1.74×1012/L,白細胞17.91×109/L,中性粒細胞14.99×109/L,血小板計數48×109/L。肝功能:總膽紅素31.5 μmol/L,間接膽紅素23.8 μmol/L。尿常規:潛血(+++),尿紅細胞114.4個/μL,尿蛋白(+)。經胸超聲心動圖:PDA封堵術后,封堵傘周邊可見7 mm殘余回聲失落,二尖瓣中度關閉不全。胸部X線正位片、CT平掃:主動脈弓與肺動脈干之間見高密度金屬影,PDA封堵術后改變(圖1B、C)。
三、初步診斷及診療經過
入院診斷:①PDA(封堵術后殘余分流);②二尖瓣關閉不全;③貧血;④高血壓3級。患者入院后予硝苯地平控釋片(30 mg/d、口服)、重組人血小板生成素注射液(1.5 萬U、靜脈注射)、A型機采血小板(1個治療劑量、靜脈滴注)、地塞米松磷酸鈉注射液(5 mg、靜脈注射)。經治療后患者尿液逐漸轉為淡黃色,但尿常規仍提示潛血(+++),血紅蛋白持續性下降。考慮藥物保守治療效果不佳,遂安排封堵器取出術。詳細詢問病史得知,患者經皮PDA封堵術植入為“上海形狀記憶合金公司”24 mm PDA封堵傘1枚,故擬本次封堵器取出術采用12號封堵器鋼纜回收封堵器,患者對手術知情同意并簽署知情同意書。
手術采用全身麻醉和氣管插管,正中開胸,常規建立體外循環。術中見肺動脈增粗,肺動脈分叉近左肺動脈處可觸及震顫及封堵器,阻斷升主動脈,體溫降至32℃后,縱行切開肺動脈,減少體外循環流量,加大左心吸引,暴露封堵器肺動脈面。嘗試采用12號封堵器鋼纜回收封堵器時無法準確銜接封堵傘,遂加用3-0 prolene線于封堵傘中央橫跨封堵器中軸1針,協助回收封堵傘。停體外循環后左手迅速回拉封堵傘,右手向前推送輸送鞘,順利將封堵傘全部回撤入12號輸送鞘內。再將16號尿管經動脈導管送至降主動脈,用20 ml生理鹽水充盈尿管球囊后,回撤封堵動脈導管,恢復主動脈供血流量。采用與動脈導管肺動脈面開口面積大小相仿的心包補片,用5-0 prolene線間斷縫閉動脈導管肺動脈面。同期行二尖瓣成形術,植入30號medtronic future Ⅱ成形環1枚。體外循環停機順利,予魚精蛋白中和肝素后,測量肺動脈壓46/23 mm Hg(橈動脈壓 110/65 mm Hg)。
術后患者血紅蛋白和間接膽紅素逐漸恢復正常。出院前復查UCG:動脈導管處未見殘余分流,二尖瓣未見反流,左心功能正常。隨訪至2021年8月5日,患者一般情況良好,心功能Ⅰ級,無貧血、黃疸和血紅蛋白尿等情況,復查UCG:動脈導管未見殘余分流,左心功能正常。
討論
動脈導管是胎兒時期連接降主動脈和肺動脈的正常血流通道,75%的嬰兒在出生后3個月內閉合,如出生1年后仍持續不閉合,即為PDA[3]。早產兒、低體質量兒常發生不同程度的動脈導管閉合延遲,甚至PDA。PDA是常見先天性心血管畸形之一,其發病率約占先天性心臟病的10% ~ 21%,女性發病率約為男性的2倍[4]。目前經皮介入封堵術治療PDA已經相當成熟,具有療效好、創傷小、并發癥少和恢復快等特點,是先天性心臟病中介入治療成功率最高、療效最確切的方法,已經成為治療PDA的首選方案[5]。
目前先天性心臟病介入治療的常見并發癥有:①心包壓塞,心包壓塞主要由于介入治療操作者經驗欠缺所致,在推送導絲于左心房時盲目用力,穿破左心耳,導致心包填塞。出現心包壓塞時患者可表現為血壓低、心音遙遠,術中食管超聲對診斷心包壓塞具有重要價值[6]。破口較小時予快速補液維持血壓+魚精蛋白中和肝素,患者大多能自愈。破口較大時,可予心包穿刺減輕心包壓塞程度,必要時應果斷行開胸手術治療[7]。②心律失常,一過性的快速室性心律失常幾乎發生在所有先天性心臟病介入治療患者,這與介入導絲刺激心肌有關,一旦操作停止心律失常也會逐漸終止。而介入導管反復刺激或封堵器壓迫導致的房室結、房室束損傷,將引發傳導阻滯。提高介入治療的操作技巧、謹慎選用過大的封堵器、及時發現傳導阻滯并使用糖皮質激素等措施可降低傳導阻滯的發生率[8]。③封堵器移位或脫落,封堵器移位或脫落是由選擇過小尺寸的封堵器或操作技術欠佳所致。選擇合適尺寸的封堵器、推送封堵器過程避免旋轉輸送鋼纜、釋放封堵器后反復推拉以明確其位置及形狀正常均可降低封堵器移位或脫落的發生率[9]。一旦發生封堵器脫落、移位,可采用介入治療使用異物鉗取出或行外科手術取出。④殘余分流與溶血,PDA封堵術后的殘余分流大多在3個月內可自行閉合,而殘余分流量較大者往往無法自行閉合。封堵器置入后患者出現機械性溶血,目前認為與殘余分流有關,發生率0 ~ 3.5%,常發生于術后24 h內[10]。殘余分流量較大時,主動脈的高速血流沖刷粗糙的封堵器表面,致使紅細胞破裂導致機械性溶血。患者可出現醬油色樣或洗肉水樣的血紅蛋白尿,伴血紅蛋白降低、血小板減少和黃疸等癥狀,應及時予以止血、控制血壓、補液、糖皮質激素、碳酸氫鈉等治療。殘余分流量較大且行再次封堵術失敗者,應行外科手術治療。⑤瓣膜關閉不全,主動脈瓣或三尖瓣關閉不全可繼發于輸送鞘管建立動靜脈軌道或封堵器移位時,由于瓣膜或腱索損傷而引起相應瓣膜關閉不全。⑥其他,包括出血、血栓和假性動脈瘤等血管并發癥;封堵器過多突入左肺動脈或降主動脈導致的主動脈狹窄;封堵成功后心肌收縮力增強、循環血量增加導致的一過性高血壓;感染性心內膜炎等并發癥[11]。
本例患者診斷為PDA(窗型),外院超聲示動脈導管直徑為10 mm,采用24號封堵器,封堵術后當日即出現嚴重溶血。入我院后雖積極予藥物治療,但其血紅蛋白尿、貧血和黃疸等無明顯好轉。CT檢查結果示封堵器腰部擴張不全,且患者病變類型為窗型,所以封堵器未能完全阻斷動脈導管血流,導致殘余分流量較大、封堵器過多突入主動脈腔內。考慮此類封堵器外覆鎳鈦合金金屬網,高速的主動脈血流通過封堵器金屬網眼及邊緣時,紅細胞與鎳鈦合金網發生劇烈摩擦,可能是本例發生機械性溶血的原因。
對于PDA封堵術后出現嚴重溶血且保守治療無效者,應盡快行外科手術,此時單純保守治療只會延誤病情[12]。既往國內外報道對于此類手術,多采用長時間深低溫停循環+切除動脈導管的手術方式。此方式手術時間長,操作過程復雜,術中、術后并發癥多,尤其是對患者神經系統損害較大[13]。為此,在征得患者的同意并簽署知情同意書后,我科針對其特點嘗試使用創新性手術方式,因其封堵術后時間較短,封堵器表面內膜化不完全,故采用我科獨創的經肺動脈切口、使用大小合適的鋼纜回收封堵器,本例實踐證明該方法可行。雖然術中回收封堵器時,鋼纜與封堵器無法完全準確對合等問題仍需進一步探討解決,但此創新手術方式無需切除動脈導管,無需深低溫,且停循環時間僅2 min,可將對機體的損傷程度降至最低,可為廣大同行提供經驗。后續將會進行更大樣本量的研究以深入探討該術式的療效。
參 考 文 獻
[1] Backes C H, Rivera B K, Bridge J A, Armstrong A K, Boe B A, Berman D P, Fick T, Holzer R J, Hijazi Z M, Abadir S, Justino H, Bergersen L, Smith C V, Kirpalani H. Percutaneous patent ductus arteriosus (pda) closure during infancy: a meta-analysis. Pediatrics,2017,139(2):e20162927.
[2] Godart F, Houeijeh A, Domanski O, Guillaume M P, Brard M, Lucron H. Is the new Occlutech duct occluder an appropriate device for transcatheter closure of patent ductus arteriosus? Int J Cardiol,2018,261:54-57.
[3] State of the art-Patent ductus arteriosus. Congenit Heart Dis,2018,13(5):645.
[4] Bischoff A R, Jasani B, Sathanandam S K, Backes C, Weisz D E, McNamara P J. Percutaneous closure of patent ductus arteriosus in infants 1.5 kg or less: a meta-analysis. J Pediatr,2021,230:84-92.
[5] Stout K K, Daniels C J, Aboulhosn J A, Bozkurt B, Broberg C S, Colman J M, Crumb S R, Dearani J A, Fuller S, Gurvitz M, Khairy P, Landzberg M J, Saidi A, Valente A M, Van Hare G F. 2018 AHA/ACC Guideline for the management of adults with congenital heart disease: a report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. Circulation,2019,139(14):e698-e800.
[6] 張文泉,王詠梅,李貴雙. 先天性心臟病介入治療的常見并發癥分析. 新醫學,2011,42(1):1-5.
[7] Imazio M, De Ferrari G M. Cardiac tamponade: an educational review. Eur Heart J Acute Cardiovasc Care. 2020 Jul 6:2048872620939341. doi: 10.1177/2048872620939341.
[8] Cen H, Peng B, Li J, Chen S, Sun P. Efficacy and safety of the Amplatzer Duct Occluder Ⅱ for ventricular septal defect closure:
a meta-analysis. Kardiol Pol,2021,79(4):401-409.
[9] Jang G Y, Son C S, Lee J W, Lee J Y, Kim S J. Complications after transcatheter closure of patent ductus arteriosus. J Korean Med Sci,2007,22(3):484-490.
[10] Sultan M, Ullah M, Sadiq N, Akhtar K, Akbar H. Transcatheter device closure of patent ductus arteriosus. J Coll Physicians Surg Pak,2014,24(10):710-713.
[11] Fortescue E B, Lock J E, Galvin T, McElhinney D B. To close or not to close: the very small patent ductus arteriosus. Congenit Heart Dis,2010,5(4):354-365.
[12] Pan X B, Ouyang W B, Wang S Z, Liu Y, Zhang D W, Zhang F W, Pang K J, Zhang Z, Hu S S. Transthoracic echocardiography-guided percutaneous patent ductus arteriosus occlusion: a new strategy for interventional treatment. Echocardiography,2016,33(7):1040-1045.
[13] Cao H, Chen Q, Zhang G C, Chen L W, Xu F, Zhang J X. Clinical study of stand-alone transthoracic echocardiography-guided percutaneous occlusion of patent ductus arteriosus. Anatol J Cardiol,2018,20(1):30-34.
(收稿日期:2021-05-05)
(本文編輯:洪悅民)

