經直腸三維超聲在直腸癌新輔助放化療后病理完全緩解評估中的價值
金 鑫 陳 東 陳海濤 張映賢 釧志睿 羅曉茂
結直腸癌是消化道常見惡性腫瘤之一,其病死率和發病率逐年上升,其中直腸癌約占結直腸癌的57.2%[1]。對于局部晚期直腸癌而言,國際臨床實踐指南推薦預先使用新輔助放化療(NCRT)后全直腸系膜切除術伴或不伴術后輔助化療作為其標準治療方案[2]。約10%~38%的直腸癌患者NCRT后能達到病理完全緩解(pCR)[3]。研究[4]認為,對于NCRT后影像學判斷為pCR者,可以選擇繼續等待觀察法,以提高患者的生存質量。因此,評估直腸癌患者NCRT后是否達到pCR,對臨床制定系統治療方案和選擇手術方案均有重要作用。本研究旨在探討經直腸三維超聲(3D-ERUS)在NCRT后局部晚期直腸癌pCR評估中的應用價值。
資料與方法
一、研究對象
選取2019年1月至2020年1月我院收治的晚期直腸癌患者98例,均符合以下標準:①術前經腸鏡活檢確診為直腸癌;②術前均行直腸癌NCRT;③均于首次入院后1周內和NCRT后術前1周內行3DERUS檢查,且檢查數據完整;④無遠處轉移或合并其他原發惡性腫瘤。排除標準:①放化療前后腸腔出現嚴重狹窄的患者;②孕婦及哺乳期婦女。98例患者根據Ryan腫瘤退縮分級法[5]分為病理完全緩解組(pCR組,0級)和非病理完全緩解組(non-pCR組,1~3級),pCR組20例,其中男12例,女8例,年齡36~74歲,平均(56.7±10.1)歲;non-pCR組78例,其中男47例,女31例,年齡25~80歲,平均(54.6±11.9)歲。術后病理T分期結果:T0期20例,T1期5例,T2期26例,T3期24例,T4期23例。術后病理腫瘤退縮分級結果:0級20例,1級21例,2級34例,3級23例。本研究經我院醫學倫理委員會批準,所有患者均知情同意。
二、儀器與方法
1.儀器:使用BK Medical 2202彩色多普勒超聲診斷儀,8848型經直腸端式腔內探頭,頻率4~12 MHz;8838型經直腸3D線陣腔內探頭,頻率4~16 MHz;配備360°自動掃查馬達。
2.3 D-ERUS檢查:患者檢查前1~2 d進流質食物,檢查前1~2 h清潔灌腸。取左側臥位,充分暴露肛門,使用一次性注射器經肛門向直腸內灌注入50 ml醫用消毒耦合劑,將8848型經直腸端式腔內探頭表面涂少量耦合劑并套上乳膠套,緩慢推進肛門探查,確定腫瘤位置和范圍,隨后將探頭推入所能顯示部分最深處,全面探查腸周淋巴結,記錄其數目和大小。然后使用8838型經直腸3D線陣腔內探頭進入直腸內探查,將探頭頂端置于腫瘤處,測量腫瘤累及長徑、累及最厚徑、腫瘤距肛緣的距離,觀察腫瘤浸潤腸壁的層次結構、累及腸外組織和鄰近器官結構及可疑淋巴結的大小和數目,對血流信號進行Alder分級[6],所有數據均測量3次取平均值。然后穩定探頭2 min進行多方位、多角度掃查,從與人體長軸垂直的標準橫切面觀察腫瘤累及腸圈的范圍,并核對上述參數測值,所有操作均由兩名具有5年以上胃腸超聲檢查經驗的醫師使用盲法完成。
使用相同方法分別于首次入院1周內及NCRT后術前1周內行3D-ERUS檢查,兩次超聲檢測結果記為ERUS 1和ERUS 2,計算NCRT前后上述各參數的變化率,具體公式為:變化率=(ERUS 1-ERUS 2)/ERUS 1×100%。
三、統計學處理
應用SPSS 17.0統計軟件,計量資料以±s或M(P25,P75)表示,組間比較行t檢驗或配對樣本Wilcoxon秩和檢驗。相關性分析采用Spearman相關分析法。繪制受試者工作特征(ROC)曲線分析各參數評估NCRT后pCR的價值,計算曲線下面積(AUC)。P<0.05為差異有統計學意義。
結 果
一、化療前后3D-ERUS參數比較
NCRT后pCR組與non-PCR組腫瘤累及長徑、累及最厚徑、累及腸圈比較差異均有統計學意義(均P<0.05),腫瘤累及長徑變化率、累及最厚徑變化率、累及腸圈變化率和血流分級變化率比較差異均有統計學意義(均P<0.05),見圖1和表1,2。

圖1 pCR組NCRT前后3D-ERUS圖
表1 NCRT前后pCR組與non-pCR組3D-ERUS參數比較(±s)
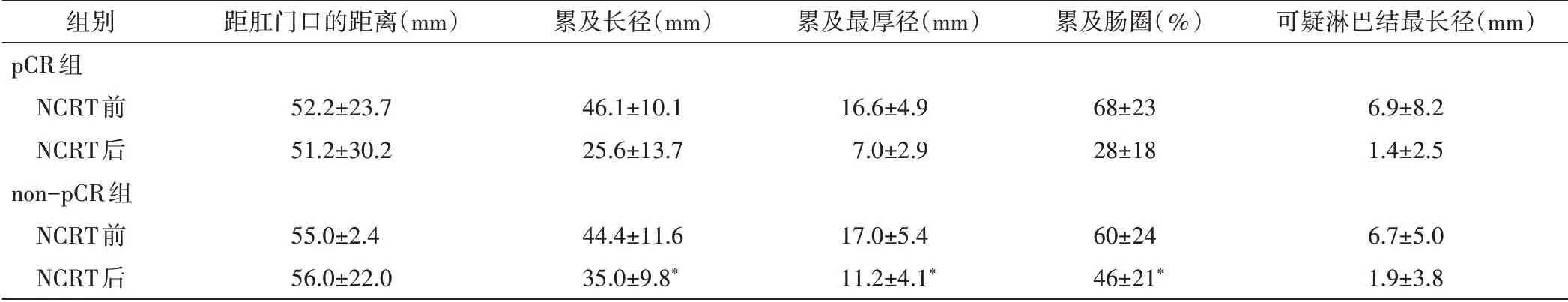
表1 NCRT前后pCR組與non-pCR組3D-ERUS參數比較(±s)
與pCR組NCRT后比較,*P<0.05
組別pCR組NCRT前NCRT后non-pCR組NCRT前NCRT后距肛門口的距離(mm)52.2±23.7 51.2±30.2 55.0±2.4 56.0±22.0累及長徑(mm)46.1±10.1 25.6±13.7 44.4±11.6 35.0±9.8*累及最厚徑(mm)16.6±4.9 7.0±2.9 17.0±5.4 11.2±4.1*累及腸圈(%)68±23 28±18 60±24 46±21*可疑淋巴結最長徑(mm)6.9±8.2 1.4±2.5 6.7±5.0 1.9±3.8

表2 NCRT后pCR組與non-pCR組3D-ERUS參數變化率比較[M(P25,P75)]%
二、相關性分析
相關性分析顯示,NCRT后腫瘤累及長徑、累及最厚徑、累及腸圈與腫瘤退縮分級均呈正相關(r=0.336、0.403、0.339,均P<0.05),累及長徑變化率、累及最厚徑變化率、累及腸圈變化率、血流分級變化率與腫瘤退縮分級均呈負相關(r=-0.407、-0.435、-0.408、-0.235,均P<0.05)。
三、ROC曲線分析
ROC曲線分析顯示,累及長徑變化率的截斷值為29%,其敏感性、特異性、準確率分別為70.0%、76.9%、75.5%,AUC為0.791;累及最厚徑變化率的截斷值為44%,其敏感性、特異性、準確率分別為80.0%、76.9%、77.6%,AUC為0.824;累及腸圈變化率的截斷值為33%,其敏感性、特異性、準確率分別為70.0%、79.5%、77.6%,AUC為0.782;血流分級變化率的截斷值為0,其敏感性、特異性、準確率分別為70.0%、57.7%、60.2%,AUC為0.653。見圖2和表3。

表3 3D-ERUS參數變化率評估局部晚期直腸癌NCRT后pCR的價值
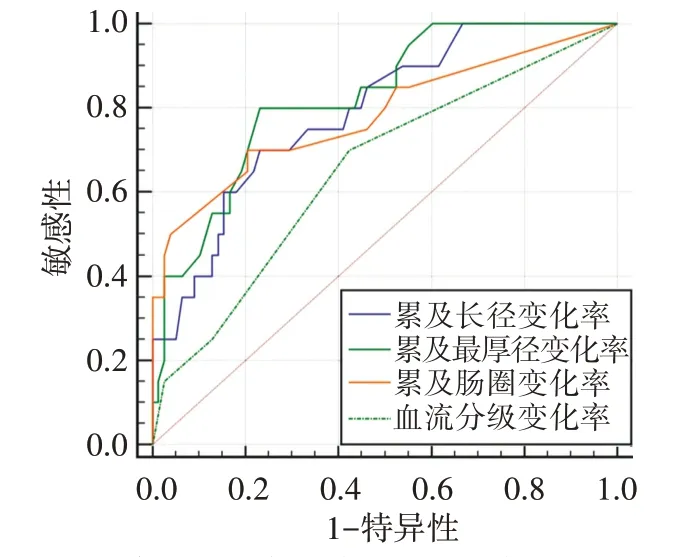
圖2 3D-ERUS參數變化率評估局部晚期直腸瘤NCRT后pCR的ROC曲線圖
討 論
目前,局部晚期直腸癌的最主要治療手段是NCRT后行經全直腸系膜切除術。Skóra等[7]分析了短程放療聯合手術及術后輔助化療患者的生存率,中位隨訪時間為57個月,10例達到pCR患者的5年總生存率為66.4%,無瘤生存率為67.2%,局部無復發生存率為91.7%,無遠處轉移生存率為71.5%,表明NCRT可以有效延長局部晚期直腸癌患者的生存時間。因此,如何準確判斷NCRT療效是臨床研究的熱點和難點。
與二維超聲比較,3D-ERUS具有簡便、快速、安全、實時動態、重復性好的優點,不僅可以清晰顯示直腸壁的結構層次,還可以多角度、多切面地清晰顯示與直腸鄰近組織臟器之間的關系,通過三維重建獲得三維立體模塊,從而提高診斷準確率[8]。3D-ERUS能測量腫瘤累及腸圈,可更準確地鑒別黏膜下小病變與pCR。本研究結果顯示,NCRT后3D-ERUS測量的腫瘤累及長徑和累及最厚徑均較NCRT前明顯縮小,表明NCRT對局部晚期直腸癌有效,腫瘤在NCRT后明顯退縮,3D-ERUS能準確評估腫瘤的形態變化。
本研究結果顯示,NCRT后腫瘤累及長徑、累及最厚徑、累及長徑變化率、累及最厚徑變化率與腫瘤退縮分級均相關(均P<0.05);ROC曲線分析顯示,累及長徑變化率>29%、累及最厚徑變化率>44%、累及腸圈變化率>33%、血流分級變化率>0均能有效預測直腸癌NCRT后pCR,與陳麗梅等[9]研究結論存在一定差異。分析原因為:本研究增加了更多的超聲因素,除累及長徑變化率和累及最厚徑變化率外,NCRT后累及腸圈和可疑淋巴結最長徑均較NCRT前明顯縮小,而累及腸圈變化率和血流分級變化率也與腫瘤退縮分級存在相關性。此外,本研究98例患者均行標準NCRT方案,使腫瘤細胞變性和壞死,原始的腫瘤細胞被炎性細胞和纖維組織的增生所取代,從而改變了腫瘤的生物力學特性。3D-ERUS可有效觀察NCRT后直腸癌的細微變化,在預測NCRT后是否達到pCR具有一定作用。
本研究局限性:①本研究為單中心回顧性研究,樣本量較小,今后需進一步行更大樣本量的多中心及前瞻性研究;②超聲圖像的質量取決于操作者的經驗,影像學判斷及測量可能存在一定的主觀性;③僅觀察了腫瘤NCRT前后的形態學改變,未評估其血流灌注變化,今后可聯合超聲彈性成像、超聲造影等技術進一步分析。
綜上所述,3D-ERUS在局部晚期直腸癌NCRT后pCR評估中具有重要價值,今后有望聯合更多新技術為局部晚期直腸癌的個體化診療提供更可靠的評估依據。

