靜脈留置針致靜脈血栓形成對白兔耳緣靜脈中血管內皮損傷標志物表達水平的影響
覃海敏 覃 燕 高 文 鄧 婷 李麗嬋 廖海濤 韋義萍
(1 廣西柳州市人民醫院呼吸與危重癥醫學科,柳州市,545000,電子郵箱:1120642732@qq.com;2 右江民族醫學院護理學院,廣西百色市 533000;3 廣西醫科大學護理學院,南寧市 530021;4 廣西貴港市人民醫院骨科,貴港市 537100)
靜脈輸液已經成為我國目前最主要、最直接有效的治療手段之一;有研究顯示,有 90%~95%的住院患者需接受靜脈輸液治療[1]。隨著學科的發展,靜脈輸液治療的護理已由一項單一技術操作發展為涉及多學科的專業領域[2],靜脈輸液治療的工具也由單純的頭皮鋼針逐漸發展為靜脈留置針、經外周靜脈置管、經皮穿刺中心靜脈導管、輸液港等多種工具[3]。隨著鋼針“零容忍”理念的提出,靜脈留置針的使用越來越普遍,已成為臨床靜脈輸液的主要工具[2,4-5]。但是在使用留置針的過程中,因靜脈留置針輸液誘發的不良反應時有發生,其中以靜脈炎、靜脈血栓較為常見。有文獻報告,靜脈留置針的導管相關性靜脈血栓發生率為5.5%~77.5%,而血管內皮損傷是導管相關性靜脈血栓的始動因素[6]。本研究旨在探討靜脈留置針所致靜脈血栓形成對白兔血管中血管內皮損傷標志物血管內皮生長因子(vascular endothelial growth factor,VEGF)、血管假性血友病因子(von Willebrand facter,vWF)、組織型纖溶酶原激活物(tissue-type plasminogen activator,t-PA)表達的影響,為明確損傷因子在靜脈留置針致靜脈血栓形成的作用機制提供一定的實驗依據。
1 材料與方法
1.1 實驗動物 70只新西蘭大白兔均購自廣西醫科大學實驗動物中心[SCXK(桂)2009-0002],兔齡150 d,雌雄不限,體重2.5~3.0 kg。實驗前適應性飼養1周,飼養室溫度24℃,相對濕度40%~70%,室內保持安靜、清潔、干燥、通風。每只白兔飼養于配有食槽和乳頭式飲水器的單獨籠架,給予全價顆粒飼料,飲用水符合城市自來水衛生標準。定時定量飼喂,2次/d。
1.2 動物分組及處理 將70只新西蘭大白兔按隨機數字表法分為空白組(n=10)和置管組(n=60)。空白組正常飼養,不做任何處理。置管組于實驗前1 d進行耳緣靜脈備皮,實驗時嚴格皮膚消毒后,用一次性24 G靜脈留置針穿刺,連接肝素帽,3M透明敷貼(美國BD公司)固定,醫用透明膠帶包裹,最后戴上兔頭套以防垂吊、抓脫。留置好靜脈留置針后,將置管組白兔按隨機數字表法分為生理鹽水組和甘露醇組,每組30只。生理鹽水組滴注0.9%生理鹽水注射液,甘露醇組滴注20%甘露醇注射液,劑量均為2.5 mL/kg,輸注結束后以3 mL 0.9%生理鹽水正壓封管。以上靜脈滴注速度均為0.5 mL/(kg·min),2次/d,每次間隔6 h以上。靜脈留置針留置后1 d、3 d、5 d分別于置管組白兔的另一側耳緣靜脈注射2%利多卡因(20 mg/kg)以處死白兔(各時點每組10只),以穿刺血管為中線,分別以穿刺點、針管中段處、針尖及遠端(遠離穿刺點及針尖位置)沿靜脈方向各取長1 cm、寬0.5 cm的耳緣靜脈血管。空白組于飼養6 d后同法處理,取相同長度及部位的耳緣靜脈血管。取得標本用4%甲醛固定液固定,24 h后制作病理切片,并進行編號。
1.3 血栓形成鑒定 取各部位耳緣靜脈血管標本進行蘇木精-伊紅染色,在鏡下觀察到血管腔有淡粉色的無結構血小板小梁,其中充滿紅細胞、白細胞,則說明有血栓形成。置管后1 d,置管組均觀察到靜脈血栓形成,且以針管中段處血栓形成最明顯,故后續實驗均取該部位標本進行相關檢測。
1.4 vWF、VEGF、t-PA表達水平的檢測 取制作好的針管中段處血管病理切片,采用免疫組織化學染色法(鏈霉菌抗生物素蛋白-過氧化物酶連結法)檢測vWF、VEGF、t-PA表達情況,試劑盒(批號:ulab1316、ulA1335、ulA5655)均購于北京中杉金橋生物技術公司,嚴格按照操作標準進行檢測。使用Olympus CX23型顯微鏡在400倍視野下進行圖像采集,并用Image-Pro Plus 6.0軟件計算針管中段處的標本陽性面積比(陽性面積比=陽性反應面積/總測量面積),以反映各因子的表達水平。每張切片隨機選取2個觀察視野,取平均值作為該標本的陽性面積比。
1.5 統計學分析 采用SPSS 21.0軟件進行統計分析。非正態分布的計量資料用[M(P25,P75)]表示,比較采用秩和檢驗。以P<0.05為差異有統計學意義。
2 結 果
2.1 各組VEFG表達水平的比較 VEFG主要在胞漿表達,陽性細胞為胞漿著棕黃色,見圖1。各時間點,3組VEGF表達水平差異均無統計學意義(均P>0.05)。見表1。

圖1 各組VEGF免疫組化陽性表達情況(×400)
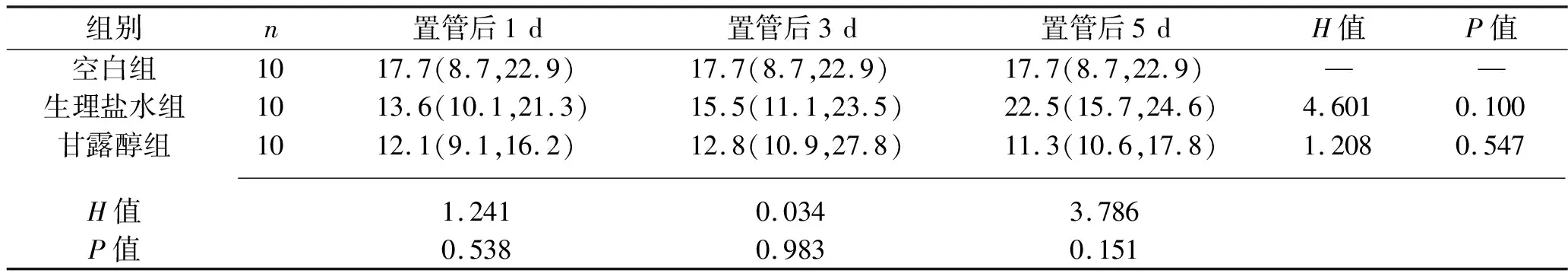
表1 不同置管時間各組VEGF表達水平的比較[M(P25,P75),%]
2.2 各組vWF表達水平的比較 vWF主要在胞漿表達,陽性細胞為胞漿著棕黃色,見圖2。置管后1 d、3 d各組vWF表達水平差異均無統計學意義(P>0.05);置管后5 d,生理鹽水組、甘露醇組vWF表達水平均低于空白組,且低于置管后1 d的水平(均P<0.05)。見表2。
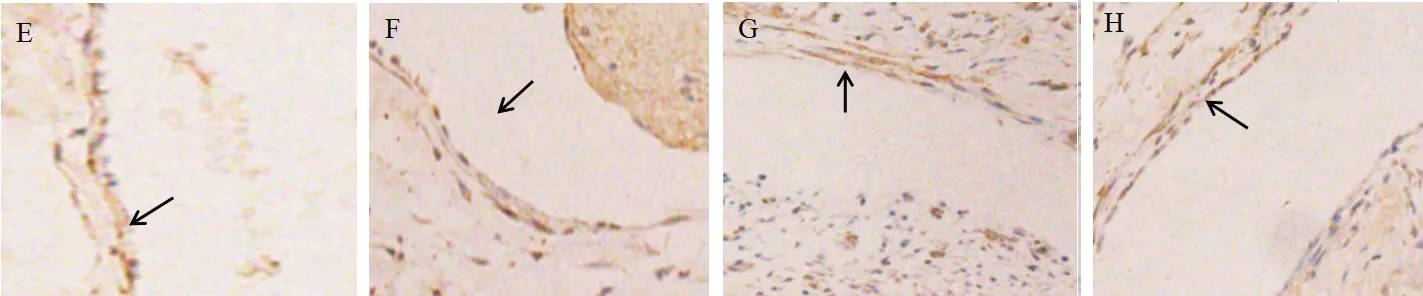
圖2 各組vWF免疫組化陽性表達情況(×400)
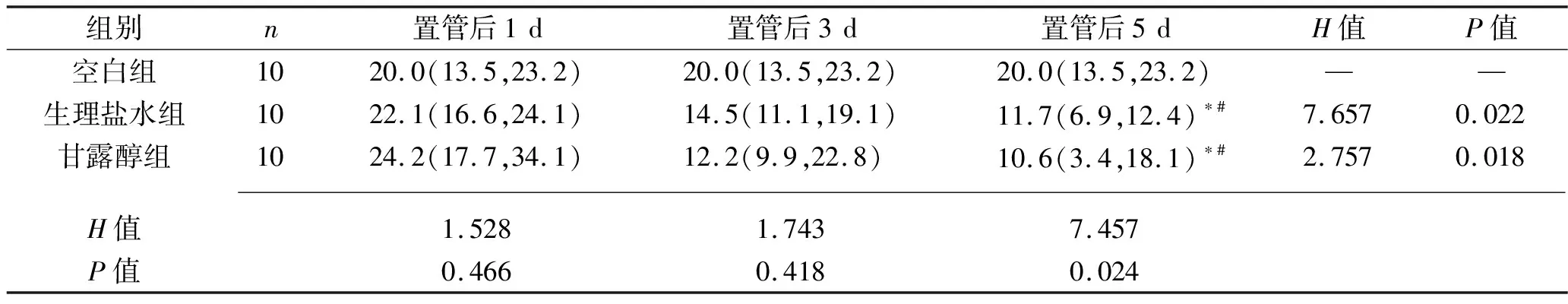
表2 不同置管時間各組vWF表達水平的比較[M(P25,P75),%]
2.3 各組t-PA表達水平的比較 t-PA主要在胞漿表達,陽性細胞為胞漿著棕黃色,見圖3。置管后1 d、5 d,各組t-PA表達水平差異均無統計學意義,置管組各亞組在置管后不同時間段t-PA表達水平亦無統計學意義(均P>0.05)。但置管后3 d,生理鹽水組t-PA表達水平高于空白組(P<0.05)。見表3。

圖3 各組t-PA免疫組化陽性表達情況(×400)
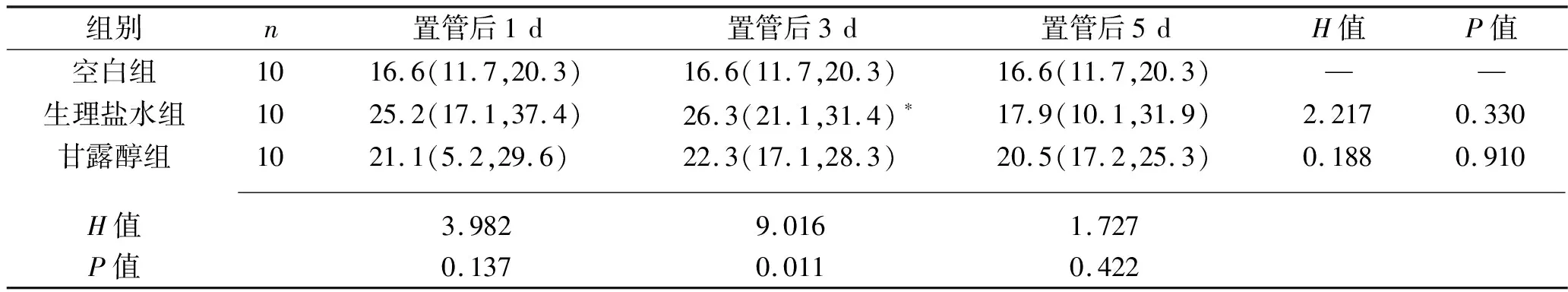
表3 不同置管時間各組t-PA表達水平的比較[M(P25,P75),%]
3 討 論
血管內皮損傷是導管相關性靜脈血栓形成的始動因素[6],其機制可能是穿刺對靜脈的機械性刺激引起內皮細胞損傷,當內皮細胞損傷后,暴露內皮下的膠原激活血小板和凝血因子Ⅻ,啟動了內源性凝血過程,與此同時,損傷的內皮細胞釋放組織因子,激活凝血因子Ⅶ,啟動外源性凝血過程[7-8]。在血栓形成的過程中,首先是血小板黏附于內膜損傷后裸露的膠原表面,被膠原激活后發生腫脹變形,隨后釋放出血小板顆粒,血小板顆粒釋放出5′-二磷酸腺苷、血栓素及血小板第Ⅳ因子等物質,使血小板不斷在局部黏附,形成血小板堆;且隨著內源及外源性凝血途徑的啟動,凝血酶原轉變為凝血酶,凝血酶將纖維蛋白原轉變為纖維蛋白,后者與受損內膜處基質中的纖維連接蛋白結合,使黏附的血小板堆固定于受損的血管內膜表面,最終形成血栓。在導管相關性靜脈血栓形成的過程中,往往會出現血管內皮損傷,從而促發凝血纖溶系統,內皮細胞合成并釋放損傷相關因子。本研究探討使用靜脈留置針致靜脈血栓形成后血管中血管內皮損傷標志物VEGF、vWF、t-PA表達水平的變化,為了解靜脈留置針致靜脈血栓形成的作用機制提供實驗依據。
3.1 靜脈留置針致靜脈血栓形成對血管中VEGF表達的影響 VEGF是內皮細胞中的一種特異性有絲分裂原,可表達于成纖維細胞、角朊細胞、血管內皮細胞、巨噬細胞等,能高效且特異地促進內皮細胞分裂和增殖,抑制多種因素導致的內皮細胞凋亡,并可增加內皮細胞對超氧化物的耐受性,以使得血管內皮細胞迅速修復并發揮其擴張血管的功能,從而促進血管側支循環形成,抑制血小板聚集[9]。有學者發現,在血栓形成段的靜脈血管壁內皮細胞中VEGF呈高表達[10-12]。本研究結果顯示,導管組各亞組VEGF的表達水平與空白組比較差異無統計學意義(P>0.05),可能與實驗動物樣本量較少有關;置管組各亞組VEGF表達水平差異亦無統計學意義(P>0.05),原因可能是靜脈置管對血管產生的機械性損傷是導致血栓形成的主要原因,滴注不同的液體對VEGF影響不大,因此置管后各亞組VEGF的表達水平沒有差異。
3.2 靜脈留置針致靜脈血栓形成對血管中vWF表達的影響 vWF由血管內皮細胞及巨核細胞合成和分泌,是一種存在于血漿、內皮細胞表面和血小板a顆粒的糖蛋白,參與凝血和血小板黏附過程[13]。vWF釋放的方式可分為持續釋放和調控釋放,前者在合成后即釋放入血,后者則在受到不同因素(如低氧、損傷、炎癥因子、凝血酶、組胺、內皮素等)的刺激才會釋放[14]。有研究表明,血管內皮損傷時血漿vWF水平升高[15]。顏偉健等[16]研究發現,血液透析患者接受靜脈置管后血漿vWF的表達增加,并隨著導管留置時間的延長增加越明顯。本研究結果顯示,置管后1 d,置管組各組vWF的表達水平高于空白組,但差異無統計學意義(P>0.05)。原因可能是靜脈置管后血管內皮損傷,刺激vWF的表達,但在血栓形成過程中也消耗vWF,因此其水平升高并不明顯。而隨著靜脈置管對血管產生的機械性損傷的增加,vWF消耗增加,因此置管后3 d,置管組各亞組vWF水平較空白組略有降低。置管后5 d,生理鹽水組、甘露醇組vWF表達水平均低于空白組以及置管后1 d的水平(P<0.05),提示在置管后期vWF表達水平下降明顯。以上結果表明靜脈置管致血栓形成過程中,內皮細胞受到損傷,vWF的表達增加,其可能通過介導血小板黏附參與血栓的形成;但隨著機械性損傷的增加及血管內皮組織自我修復,vWF水平逐漸降低。
3.3 靜脈留置針致靜脈血栓形成對血管中t-PA表達的影響 t-PA是人體內纖溶系統的生理性激動劑,在血管內能夠催化纖溶酶原轉化成纖溶酶,具有促進纖維蛋白溶解的作用[17]。t-PA和纖溶酶活化抑制因子1(plasminogen activator inhibitor 1,PAI-1)結合可形成 1∶1的復合物,從而抑制t-PA活性,進一步減少纖維蛋白的溶解,當血管內皮細胞受損后,PAI-1活性增高而使t-PA纖溶活性降低,從而有助于血栓或血栓前狀態的形成[18]。有學者指出,t-PA是血管內調控纖溶系統的關鍵因子,在血管損傷和血栓形成后釋放入血,對纖維蛋白高度親和,當纖維蛋白形成后,其表面的酶活性增強,促使纖溶酶生成[19]。本研究結果顯示,置管后1 d,3組t-PA表達水平差異均無統計學意義(P>0.05)。原因可能是:靜脈置管后引起血管內皮細胞損傷,使凝血系統與抗凝血系統動態失衡,凝血系統活化,同時可刺激PAI-1表達水平升高,啟動血液凝固機制,最終導致血栓的形成;當血栓形成后,纖溶系統也被激活,刺激t-PA表達水平升高,抑制血栓的形成;由于t-PA與PAI-1相互抗衡,使得留置靜脈置管后t-PA表達水平升高不明顯。置管后3 d,生理鹽水組t-PA表達水平高于空白組(P<0.05),但甘露醇組與空白組之間差異無統計學意義(P>0.05)。這可能是因為隨著血栓的形成,纖溶系統進一步被激活,生理鹽水組和甘露醇組的t-PA的表達水平逐漸升高,但甘露醇是刺激性藥物,輸注后血管內皮損傷更嚴重,刺激機體的自我修復反應,t-PA水平應激性下降,因此甘露醇組t-PA的表達水平升高沒有生理鹽水組明顯。置管后5 d,3組t-PA表達水平差異均無統計學意義,且組內不同時間點比較差異亦無統計學意義(均P>0.05)。可能是因為置管后期,血栓形成穩定后,血管內皮細胞自我修復能力也逐漸顯現,為維持凝血與抗凝血系統的平衡狀態,置管組t-PA的表達水平逐漸下降。以上提示留置靜脈留置針后血管內皮損傷,t-PA的表達水平發生一定的變化,但該變化不受置管時間的影響,其是否受到輸注藥物的影響還有待進一步研究。
綜上所述,留置靜脈留置針致靜脈血栓形成后,白兔耳緣靜脈中vWF表達水平有一定的變化,但VEGF、t-PA表達水平變化不明顯。

