生物膜層DO濃度對MABR中異養硝化-好氧反硝化的影響
康寶文, 肖芃穎, 周 靖, 袁 港, 郭 雷
重慶理工大學化學化工學院, 重慶 400054
化工、畜禽養殖廢水和垃圾滲濾液等高濃度氨氮(NH4+-N)廢水具有排放量大、生物毒性強和處理難度高的特質[1],已成為含氮廢水處理領域的研究重點. 高氨氮廢水處理方法主要有物化法和生物法,其中生物法因其更經濟和環保的優勢得以廣泛應用[2]. 依據部分硝化反應(NH4++1.5O2→NO2-+H2O+2H+)和完全硝化反應(NH4++2O2→NO3-+H2O+2H+)的理論計算可知:1 mol NH4+需要1.5 mol O2氧化生成NO2-,2 mol O2氧化生成NO3-,1 g NH4+-N理論上需要約4.6 g O2才能完全氧化[3]. 因而,無論是發生部分硝化還是完全硝化反應,處理高氨氮廢水都將會消耗較多O2. 傳統好氧生物脫氮技術普遍采用鼓風曝氣方式供氧,存在氧傳質效率低、能耗高的缺陷[4],具備高效供氧和低能耗優勢的膜曝氣生物膜反應器(membrane-aerated biofilm reactor, MABR)得以發展. 采用MABR進行生物脫氮已成為處理高氨氮廢水的一項新穎潛力技術[5].
目前,關于MABR生物脫氮的相關研究主要聚焦于反應器運行機制、工藝優化及技術應用等方面[6-8]. 學者們對MABR生物脫氮理論的深入研究發現,生物膜層溶解氧(DO)濃度是影響MABR脫氮性能的重要因素之一[9-10]. 有研究[11]表明,在MABR生物膜層中,生長較快的異養型微生物極易與生長緩慢的自養型微生物同時沉積在生物膜層的某微觀區域競爭O2,使具有好氧硝化功能的自養型氨氧化菌(aerobic oxide bacteria, AOB),與具有厭氧反硝化功能的常規異養菌(heterotrophic bacteria, HB)和(或)自養型厭氧氨氧化菌(anammox bacteria)之間無明確的分界線,這導致在脫氮過程中好氧硝化與厭氧反硝化難以協調平衡. 調節MABR生物膜層DO濃度可促使一種特殊活性分層產生,利于MABR的硝化與反硝化過程[12]. 然而,傳統硝化細菌(AOB和NOB)對高濃度NH4+-N耐受性差[13],限制了MABR在高氨氮廢水處理中的應用[14-15].
異養硝化-好氧反硝化(heterotrophic nitrification-aerobic denitrification, HN-AD)微生物,作為一類能耐受高濃度NH4+-N和有機碳的新型脫氮菌,可高效去除各形態的氮污染物,無有害中間產物亞硝態氮(NO2--N)和硝態氮(NO3--N)的積累,單菌種實現同步硝化反硝化脫氮[16]. 由HN-AD菌主導的異養硝化好氧反硝化過程,已被證實廣泛存在于生物流化床、生物轉盤和SBR等多種廢水生物處理反應器中[17-19],具有HN-AD功能的生物脫氮技術成為高氨氮廢水處理的技術新秀. HN-AD菌屬在不同DO濃度下的脫氮性能存在較大差異[20],例如:假單胞菌屬PseudomonasstutzeriKTB在DO濃度從1.28 mg/L升至1.57 mg/L的過程中,NO3--N去除率從45.1%升至99.2%[21];不動桿菌屬AcinetobacterhaemolyticusZYL在DO濃度大于4.8 mg/L時具有最佳的反硝化效果[22];枯草芽孢桿菌屬BacillussubtilisA1在DO濃度為3.1~7.9 mg/L范圍內達到高效好氧硝化和反硝化性能[23]. 在MABR中,O2透過中空纖維膜擴散至生物膜層,改變膜腔內的氧通量進而引起生物膜層中DO濃度的變化[24]. 生物膜層DO濃度不僅與HN-AD 菌生長代謝過程中細胞增殖分化程度有關,還影響其脫氮功能基因的表達[25]. 因此,探究生物膜層DO濃度對MABR中HN-AD菌多樣性及其脫氮功能的影響,將有助于明晰MABR的HN-AD特性.
該研究將筆者所在課題組前期篩選的脫氮混合菌接種于貫通式的MABR中,并進行菌液掛膜,調節進氣量實現MABR生物膜層的不同DO濃度水平,考察生物膜層DO濃度對MABR脫氮性能和HN-AD菌多樣性的影響,并預測MABR中關鍵脫氮功能基因豐度的變化規律,揭示MABR中HN-AD過程的微生物作用機制,以期為MABR處理高氨氮廢水的應用提供理論依據.
1 材料與方法
1.1 MABR裝置及運行條件
貫通式MABR裝置示意如圖1所示. 由圖1可見,MABR由有機玻璃裝置和膜組件構成,頂部加蓋密封,留取樣小孔. MABR有效體積為1.2 L,膜組件材料為聚偏氟乙烯(PVDF),膜絲內、外徑分別為1.7和2.0 mm,膜孔徑為0.1 μm,有效比表面積為1.25 cm2/cm3. MABR水力停留時間(HRT)為48 h,水循環流速為40 mL/min,膜組件經充氧試驗測得泡點壓力為12.5 kPa. MABR啟動和運行過程中保持曝氣壓力低于泡點壓力可達到高效的供氧效率[26]. 因此,MABR啟動階段的曝氣壓力設定為10 kPa. 調節進氣量可改變膜-水界面跨膜傳質過程中的氧通量,引起生物膜層的DO濃度變化. 故在反應器穩定運行后,分別調節進氣量為0.1、0.6和1.0 L/min(試驗中測得對應曝氣壓力分別為3、8和12 kPa,均低于泡點壓力),進而實現MABR生物膜層的不同DO濃度.

注: 1—合成廢水;2—進水水泵;3—取樣及微電極測試小孔;4—出水;5—氣泵;6—氣體流量計;7—壓力表;8—水循環泵;9—膜組件;10—排氣閥.
1.2 接種菌液與試驗用水
已有研究[27]表明,貫通式MABR可通過菌液掛膜富集HN-AD菌以實現高效同步硝化反硝化. 因此,接種60 mL HN-AD脫氮混合菌液于反應器進行菌液掛膜(混合菌篩選自豬場沼液、垃圾滲濾液、化工廢水等高氨氮廢水中,COD、NH4+-N、TN去除率均在90%以上). 試驗進水為高氨氮模擬廢水,以(NH4)2SO4和CH3COONa為唯一氮源和碳源,進水NH4+-N濃度為465~534 mg/L〔(NH4)2SO42.0~2.3 g/L〕,進水COD濃度為 4 700~5 290 mg/L(CH3COONa 5.8~6.6 g/L),其他微量元素(50 mL/L)包括MgSO4·7H2O 2.0 g/L、MnSO4·H2O 0.1 g/L、CaCl21.5 g/L、FeSO4·7H2O 0.1 g/L、K2HPO45.0 g/L. 反應器進料pH保持在7.5~8.0之間,反應器料液溫度通過水浴加熱控制在(25±2)℃.
1.3 水質組分和生物膜表觀特征分析
NH4+-N、TN、COD以及氮轉化中間產物NO2--N、NO3--N的濃度均參照《水和廢水監測分析方法》(第四版)[28]進行測定. 菌液濃度(OD600 nm)采用紫外分光光度計(752型,上海舜宇恒平科學儀器有限公司)測定,pH采用pH儀(MettlerToledo FE20)測定.
采用掃描電鏡(SEM, TESCAN MIRA3)技術表征反應器掛膜階段的生物膜表觀形態特征. 將采集的生物膜樣品用2.5%戊二醛固定2~4 h后,經磷酸緩沖液(pH=7.0)清洗3次,再分別用30%、50%、70%、85%和95%濃度的乙醇洗脫1次,100%乙醇洗脫2次(每次脫水時間均為15~20 min),將脫水后的樣品裝入濾紙盒,放入冷凍干燥儀中冷凍干燥12 h,將制備完成的樣品送至武漢鑠思百檢測技術有限公司進行SEM分析.
1.4 生物膜層DO濃度測定分析方法
生物膜層DO濃度可通過溶氧微電極進行原位測定[29]. 該研究采用Unisense?微電極分析系統對不同進氣量條件下生物膜層DO濃度進行實時測定. Unisense?微電極分析系統由Clark型溶氧微電極(Unisense OX25,Denmark)和主機(UnisenseA/S,Denmark)兩部分組成. 測試前,對溶氧微電極進行零點及飽和DO值校準[30]. 測試期間,微電極垂直于生物膜表面,每隔50 μm測得一個DO濃度,每個深度的DO濃度平行測定3次,最終將測得的DO濃度繪制成生物膜層DO剖面曲線.
1.5 DNA提取、高通量測序及脫氮功能基因預測
采用無菌剃刀刮取不同進氣量條件下膜絲表面的生物膜樣品(每個樣品約0.5 g),短期保存于-80 ℃冰箱中. 通過MobioPowerSoil?DNA Isolation Kit試劑盒提取樣品的基因組DNA,經預處理后送至高通量測序平臺PE300(上海美吉生物醫藥科技有限公司)進行測序分析. 對16S rRNA基因V3/V4區進行擴增,通用引物序列為338F(5′-ACTCCTACGGGAGG CAGCA-3′)和806R(5′-GGACTACHVGGGTWTCTA AT-3′)[31]. 采用Trimmomatic和Flash軟件對測序序列進行拼接,通過Usearch軟件對具有97%相似性的序列進行OTU聚類,經Usearch_global獲得OTU序列豐度統計表用于后續微生物群落多樣性分析;采用基于KEGG數據庫的PICRUSt1軟件對樣品中微生物脫氮功能基因進行預測分析[32].
2 結果與討論
2.1 MABR啟動運行性能
MABR在16 d內實現菌液掛膜和馴化,反應器啟動運行性能見圖2. 由圖2(a)可知,反應器啟動的第0~6天內,液相中OD600 nm先增后降;第7~16天,OD600 nm保持在0.4左右. SEM表征結果(見圖3)顯示,反應器啟動6 d后,膜絲表面開始附著少量桿菌和球菌,繼續運行至16 d,膜絲表面已明顯可見大量桿菌. OD600 nm變化與SEM表征結果說明接種菌液的微生物已附著膜絲表面形成生物膜. 由圖2(b)可知,MABR啟動的第6天,NH4+-N、COD和TN進水濃度分別為465.23、5 190.84 和465.23 mg/L,出水濃度分別為176.68、1 604.82 和193.20 mg/L,去除率分別為62.02%、69.08%和58.47%,說明接種菌液中微生物活性得到激活. 反應器運行至第16天,NH4+-N、COD和 TN的進水濃度分別為492.36、5 109.31 和492.36 mg/L,出水濃度分別為161.35、1 298.18 和177.45 mg/L,去除率相比第6天分別增至67.23%、74.59%和63.96%,說明在適應期內膜絲表面生長富集的微生物具有穩定的脫氮功能. 此外,反應器啟動運行過程中,出水NO2--N和NO3--N濃度低,分別為0.52和3.06 mg/L〔見圖2(a)〕,說明反應器在菌液掛膜馴化過程中無明顯中間產物積累,MABR成功啟動并具備同步硝化反硝化性能.

圖2 MABR啟動運行性能

圖3 MABR啟動運行階段生物膜的表觀結構特征
2.2 生物膜層DO濃度分布及其對MABR脫氮性能的影響
MABR中生物膜層DO濃度分布如圖4所示. 當進氣量從0.1增至1.0 L/min時,生物膜內層DO濃度由0.94 mg/L逐步提高至3.67 mg/L,但DO始終未能穿透整個生物膜層,致使生物膜外層DO濃度始終為0 mg/L. 上述結果說明,在MABR中改變進氣量主要引起生物膜內層DO濃度的升高. 當進氣量為0.1、0.6和1.0 L/min時,DO穿透生物膜層(DO濃度≥0.1 mg/L)的深度分別為200、240和400 μm,生物膜層厚度隨進氣量增大而增加;進氣量為0.1 L/min 時,生物膜內未能形成好氧層區域(DO濃度≥2.0 mg/L),生物膜從內至外僅缺氧—厭氧兩個分層,當進氣量提升至0.6和1.0 L/min時,生物膜內形成好氧層且其厚度分別為30和100 μm,此時生物膜從內至外形成好氧—缺氧—厭氧3個分層. 上述結果說明,提高進氣量促進了生物膜內好氧層厚度增加,且豐富了MABR生物膜分層結構.

注: 靠近膜-生物膜界面表示生物膜內層,靠近生物膜-液相界面表示生物膜外層.
不同進氣量條件下,MABR中NH4+-N、COD和TN去除效果如圖5所示. 當生物膜內層分別為低DO濃度(進氣量為0.1 L/min)、中DO濃度(進氣量為0.6 L/min)和高DO濃度(進氣量為1.0 L/min)時,平均進水NH4+-N和TN濃度均為487.70 mg/L,出水NH4+-N和TN濃度分別為274.91、195.47、135.35 mg/L和284.15、222.05、163.69 mg/L,NH4+-N和TN去除率分別為43.64%、60.06%、71.79%和41.72%、54.62%、65.90%,高DO濃度下反應器NH4+-N和TN去除率相比低DO濃度分別增加28.15%和24.18%. 調節進氣量過程中,反應器出水NO2--N和NO3--N濃度始終保持較低水平(出水NO2--N和NO3--N濃度分別為1.86和1.29 mg/L),未見明顯NO2-和NO3-積累;同時,反應器的COD去除率在上述3種DO濃度下均穩定在72%~88%范圍內. 上述結果說明,提高生物膜內層DO濃度僅對MABR的脫氮性能具有正向影響. 提高進氣量增加生物膜內層DO濃度拓寬了生物膜內好氧層區域,有利于增強好氧微生物降解潛力[33],對強化MABR脫氮性能起著重要作用.

圖5 不同進氣量下MABR的去污性能
2.3 生物膜層DO濃度對MABR中脫氮微生物特性的影響
2.3.1微生物α多樣性指數分析
α多樣性指數分析是指通過統計學計算方法對局域均勻生境下的群落進行物種均勻度、豐富度兩個層面的多樣性特性分析. Shannon-Wiener指數和Simpson指數常用于表示微生物的多樣性特征,Shannon-Wiener指數越低表明群落多樣性越單一,而對應的Simpson指數越大,說明群落中優勢菌屬生態功能相對更顯著;Ace指數和Chao指數是衡量樣品中微生物物種豐富度的標準,Ace指數和Chao指數越高,群落豐富度越高[34]. 生物膜內層不同DO濃度下采集的生物膜樣品(F0.1、F0.6、F1.0)微生物α多樣性結果如表1所示. 通過MiSeq Illumina測序分析獲得267~338個OTUs,Coverage(覆蓋度)>99%表明測序深度包含了測序樣品的全部細菌. 由Shannon-Wiener指數和Simpson指數結果可知,F0.1樣品中微生物物種多樣性最豐富,F1.0樣品中微生物物種相對單一,說明提高生物膜內層DO濃度雖然降低了MABR中微生物多樣性,但可能促進優勢菌屬的生態功能作用;同時,與F0.1、F0.6樣品相比,F1.0樣品中Chao指數和Ace指數最小,說明高進氣量條件采集的樣品(F1.0)中微生物群落豐富度最低. 這主要是因為高進氣量使生物膜內層形成高DO濃度環境,更有利于好氧微生物的選擇性競爭,進而降低了MABR中微生物群落豐富度.

表1 MABR中微生物α多樣性指數
2.3.2MABR中脫氮微生物群落結構分析
選取樣品中相對豐度大于3%的脫氮菌屬進行菌群結構分析,結果如圖6所示. 隨著生物膜內層DO濃度增加,傳統硝化和反硝化脫氮菌屬,包括水微菌屬(Aquamicrobium)、紅桿菌屬(unclassified_f_Rhodobacteraceae)、特呂珀菌屬(Truepera)、生絲單胞菌屬(Hyphomonas)和弓形桿菌屬(Arcobacter),總相對豐度由30.03%降至10.49%;而適宜好氧條件生長的HN-AD菌屬,包括假黃褐藻屬(Pseudofulvimonas)、脫氮副球菌屬(Paracoccus)、鞘氨醇桿菌屬(Sphingobacterium)和不動桿菌屬(Acinetobacter)[35],總相對豐度由10.40%升至11.86%. 上述結果說明,提高生物膜內層DO濃度降低了MABR中傳統脫氮菌屬豐度,但促進了HN-AD菌屬豐度的增加,進而對MABR中脫氮微生物群落結構存在一定影響.

圖6 MABR中微生物群落組成
為進一步了解生物膜層不同DO濃度下HN-AD菌群落組成變化,篩選樣品中相對豐度大于1%的HN-AD菌屬進行多樣性分析,結果如圖7所示. 除Pseudofulvimonas、Paracoccus、Sphingobacterium和Acinetobacter外,反應器也成功富集了產堿桿菌屬(Alcaligenes)、氣單胞菌屬(Aeromonas)、從毛單胞菌屬(Comamonas)、假單胞菌屬(Pseudomonas)、細桿菌屬(Microbacterium)和紅球菌屬(Rhodococcus)等HN-AD 菌屬[36],共計13種,其總相對豐度在生物膜內層低、中和高3種DO濃度下分別為12.97%、19.05%和22.01%,其中,Alcaligenes、Acinetobacter和Pseudomonas能夠耐受高DO濃度、高NH4+-N濃度,且具有高效同步硝化反硝化能力[37],這3種HN-AD菌屬在生物膜內層為高DO濃度時的相對豐度較低DO濃度分別提高了0.19%、3.93%和2.09%. 上述結果說明,提高生物膜內層DO濃度能夠促進MABR中HN-AD菌屬的富集,強化MABR處理高NH4+-N廢水的脫氮性能.
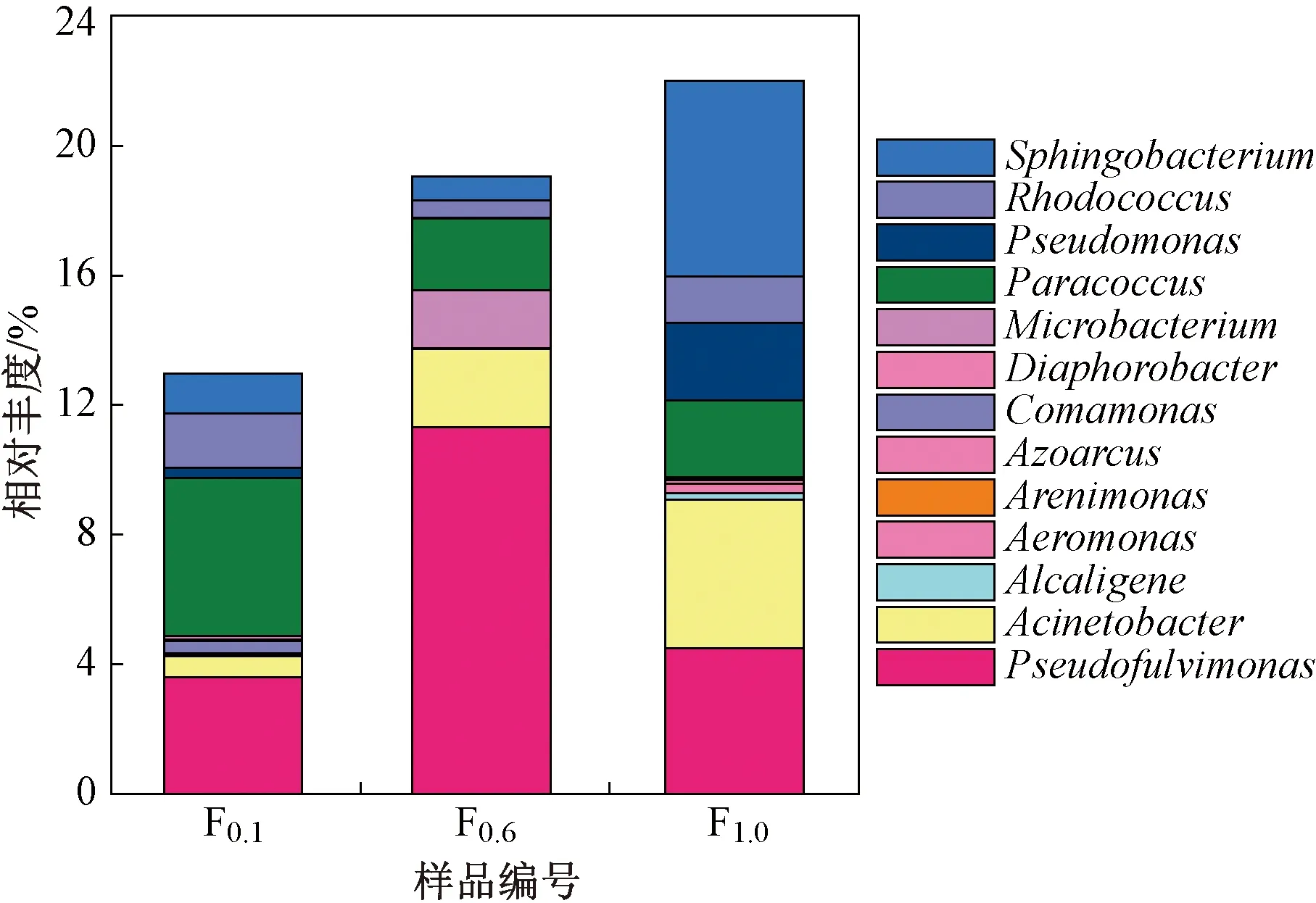
圖7 MABR中HN-AD菌屬的相對豐度
2.4 脫氮功能基因預測分析
采用基于16s rRNA基因分析的PICRUSt1軟件,考察生物膜層DO濃度對MABR中脫氮功能基因豐度的影響(見圖8),獲得與硝化過程相關的羥胺氧化酶基因(hao),該基因為NH2OH氧化生成NO2-過程的功能基因[38]. 不同進氣量條件下,MABR中hao基因相對豐度無顯著變化,說明改變進氣量調節生物膜層DO濃度對MABR中NH2OH氧化過程的影響較小. 此外,還獲得與反硝化過程相關的9個功能基因,包括硝酸還原酶基因(narG、narH、narI、napA、napB)、亞硝酸還原酶基因(nirK)、一氧化氮還原酶基因(norB、norC)和一氧化二氮還原酶基因(nosZ). 生物膜內層為高DO濃度(進氣量為1.0 L/min)時,反硝化功能基因總相對豐度是低DO濃度(進氣量為0.1 L/min)時的9.4倍,說明提高生物膜內層DO濃度有助于增強MABR的反硝化活性. 其中,napA和napB是好氧反硝化過程的關鍵功能基因[39],二者在進氣量分別為0.1、0.6和1.0 L/min(生物膜內層分別為低、中和高DO濃度)時,其總相對豐度分別為0.000 13‰、0.019‰和0.060‰,高DO濃度時好氧反硝化功能基因(napA和napB)的相對豐度是低DO濃度的462倍. 上述結果說明,提高生物膜內層DO濃度更有利于加快好氧反硝化進程,促進MABR中HN-AD過程的實現.
3 結論
a) 提高進氣量增加了MABR生物膜內層DO濃度,拓寬了生物膜內部好氧區域;低、中和高DO濃度水平時,NH4+-N去除率分別為43.64%、60.06%和71.79%,TN去除率分別為41.72%、54.62%和65.90%. 提高生物膜內層DO濃度增強了MABR的脫氮性能.
b) 隨著生物膜內層DO濃度的增加,MABR中傳統硝化和反硝化菌屬的相對豐度降低,但MABR共富集13種HN-AD菌屬,其總相對豐度在低、中和高DO濃度下分別為12.97%、19.05%和22.01%,提高生物膜內層DO濃度有利于MABR中HN-AD菌屬富集.
c) 生物膜內層在高DO濃度(進氣量為1.0 L/min)時反硝化功能基因的總相對豐度是低DO濃度(進氣量為0.1 L/min)的9.4倍,其中,高DO濃度時好氧反硝化功能基因(napA、napB)相對豐度是低DO濃度的462倍. 提高生物膜內層DO濃度能夠加快好氧反硝化進程,促進MABR中HN-AD過程的實現.

