基于中美日新藥上市現狀對比的抗腫瘤新藥發展策略研究
崔積鈺 韓優莉
首都醫科大學公共衛生學院 北京 100069
1 研究背景
隨著人口老齡化和疾病譜變化,全球范圍內尤其是發展中國家的癌癥負擔呈現加重的趨勢。[1]世界衛生組織(WHO)《2020年世界癌癥報告》指出,我國新增癌癥病例占全球的23%以上,死亡人數約占全球的30%。[2]惡性腫瘤已經成為威脅我國居民健康水平的重要因素。2006年,WHO首次明確將腫瘤疾病歸入慢性病的范疇,指出患者通過接受及時有效的治療其病情可以得到有效控制。當前,藥物治療是惡性腫瘤患者生活質量提升和疾病治愈的重要手段。
我國抗腫瘤藥市場發展迅猛、規模龐大,進口藥仍占據較大比重。我國為提升患者抗腫瘤藥的可及性采取了多項舉措。自2015年首批國家藥品價格談判試點以來,我國通過五輪價格談判將抗腫瘤藥等一系列臨床價值高、價格相對高昂的獨家藥品納入醫保,同時降低抗癌藥的進口關稅、增值稅等,有效降低了患者的疾病經濟負擔。2019年國家衛生健康委等10部門聯合制定的《健康中國行動—癌癥防治實施方案(2019—2022年)》(以下簡稱“《癌癥防治方案》”)鼓勵境內抗腫瘤藥的研發和加速審批,促進境外抗腫瘤新藥的同步上市,實現抗腫瘤藥可及性的提升。未來,我國抗腫瘤新藥的發展即將進入“加速期”,促進抗腫瘤新藥研發的激勵政策以及加速新藥上市的審評審批制度有待進一步完善。
2 資料與方法
2.1 “新藥”概念的界定
我國與美國、日本在“新藥”概念的界定上有一定的差異,因此需先明確本研究中涉及的“新藥”概念。2019年,我國化學藥品注冊分類采用2016年版《化學藥品注冊分類改革工作方案》(以下簡稱“《改革方案》”),我國對“新藥”的定義包含了化學藥1類(境內外均未上市的創新藥)及5.1類(境外上市的原研藥品)、生物制品1類(未在國內外上市的生物制品)及2類(單克隆抗體)、中藥和疫苗;美國食品藥品監督管理局(U.S. Food and Drug Administration, FDA)將“新型藥物(Novel Drug)”定義為“藥品中含有的新分子實體(New Molecular Entities, NMEs)的藥物和新治療性生物產品”,不包含疫苗、致敏產品、血液和血液制品、血漿衍生物、細胞和基因治療產品[3];日本醫療器械審評審批機構(Pharmaceuticals and Medical Devices Agency, PMDA)在《上市藥品清單》(List of Approved Products)中對上市新藥評審類別也進行了詳細的類別劃分,將“新藥”定義為具有新有效成分或化學結構,以及因劑型、規格、給藥途徑的變化導致藥理作用發生改變的藥物,主要包括具有新的活性成分、具有新的適應證、具有新的劑型、具有新的給藥途徑等[4]。綜合各國對“新藥”的評判標準,本研究納入的“新藥”指:在本國境內未上市的、藥品中含有的新分子實體的藥物和新治療性生物產品,包括2019年我國適用的《藥品注冊管理辦法》規定的化學藥1類及5.1類、生物制品1類及2類、中藥三大類別的藥品,不包括疫苗、致敏產品、血液和血液制品、血漿衍生物、細胞和基因治療產品。
2.2 數據來源
基于中國、美國和日本2019年藥品上市數據,針對符合“新藥”標準的藥品數量、原研廠家以及抗腫瘤新藥的適應證、原研廠家、上市時效性等情況進行對比分析;數據源于美國食品藥品監督管理局、日本醫療器械審評審批機構及我國的藥品監督管理局官網。與腫瘤醫院科室、藥劑科、制藥企業等利益相關方負責人開展深入訪談,了解我國抗腫瘤新藥在研發和上市審批環節存在的問題,總結我國創新藥發展的現狀和挑戰,結合國內外優秀經驗提出政策建議,以推動我國抗腫瘤藥的創新和發展。
3 結果
3.1 美國、日本與我國新藥上市情況對比
美國在藥品研發領域擁有完整創新鏈與產業鏈,藥品研發創新能力一直處于世界領先水平,美國FDA在支持鼓勵新藥的研發和上市方面也長期走在世界前列。日本則通過對國外先進藥品的仿制實現自身研發技術的提升,當前也已步入藥品研發強國的行列。[5]本研究從我國藥監局、美國FDA和日本PMDA和官網獲取2019年各國上市藥品數據及藥品分類標準,對比分析各國上市新藥數量和研發企業的分布,以了解我國在創新藥品上市和研發方面與國際先進水平的差異。
3.1.1 上市新藥數量分析
2019年,我國審批上市新藥58個,其中抗腫瘤藥14個,占比24.14%;美國FDA審批上市新藥48個,其中抗腫瘤藥12個(包含1種診斷用放射性顯影劑),占比25.00%;日本PMDA批準上市新藥37個,其中抗腫瘤藥10個,占比27.03%(表1)。
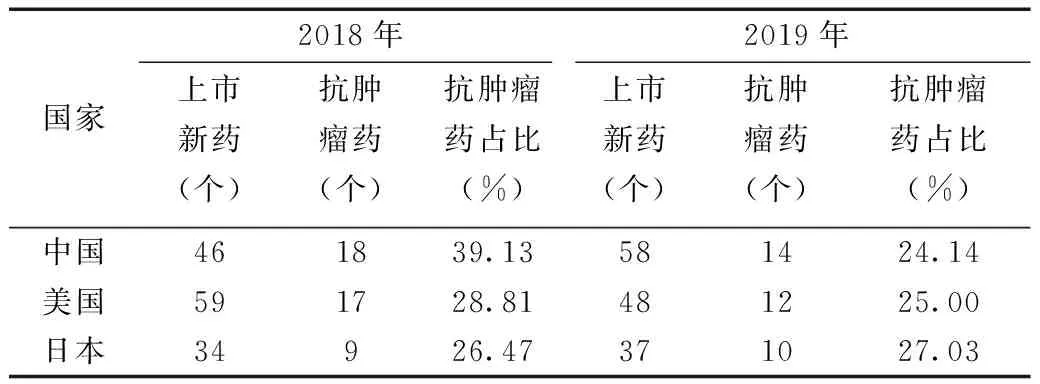
表1 2018、2019年中美日三國新藥上市情況
從上市審批新藥的數量來看,2019年我國首次超過美國,我國在藥品上市審批領域與國際領先水平的差距正逐漸縮小。在上市審批的藥品中,我國抗腫瘤藥的比例與日本和美國的水平接近,在《癌癥防治方案》“加快境內外抗癌新藥注冊審批,促進境外新藥在境內同步上市,暢通臨床急需抗癌藥臨時進口渠道”的要求下,上市的58個新藥中包含抗腫瘤新藥14個,繼2018年17個國家談判抗腫瘤藥進入醫保提升患者的用藥可及性之后,國家進一步加大對抗腫瘤藥的研發和對臨床急需新藥的引進,從用藥源頭上提升患者的用藥可及。
3.1.2 上市新藥原研企業分布
從新藥原研企業的分布來看,我國上市的58個藥品涵蓋10個國家原研企業生產的產品,其中美國企業生產的藥品最多,共18個,占比30.61%;其次為中國企業生產的藥品,共12個,占比20.69%(圖1)。美國上市的48個藥品涵蓋14個國家的企業和組織生產研發的藥品,美國企業生產的藥品最多,共20個,占比41.67%;其次為瑞士企業生產的藥品,共9個,占比18.75%(圖2)。從上市新藥的企業分布來看,我國2019年上市的藥品中,美國研發的創新藥物仍占據較高的比例,而在國家新藥政策的激勵下,國產新藥未來也將成為我國上市新藥的重要來源;從上市新藥的國際影響力來看,美國企業研發的藥品仍在各國上市新藥中占據較大的比重,而我國研發的藥品在各國的占比相對較低,盡管我國的藥品研發能力正逐步提升,但上市藥品的國際影響力有待進一步增強。
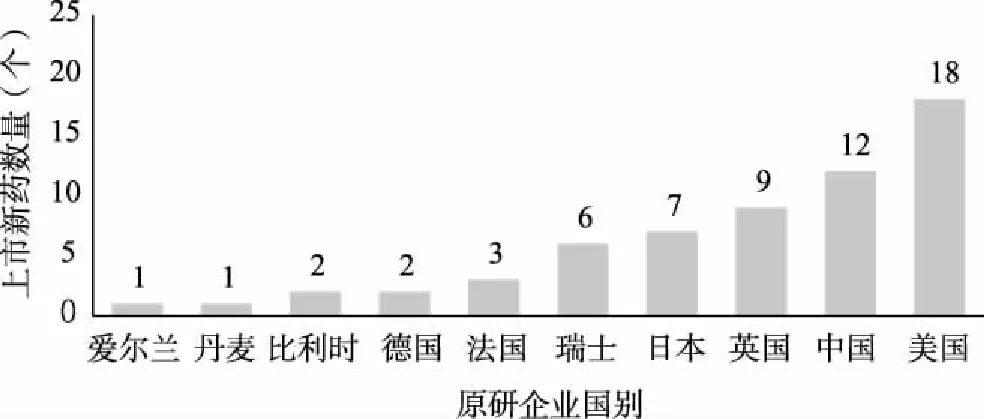
圖1 2019年中國上市新藥生產國分布
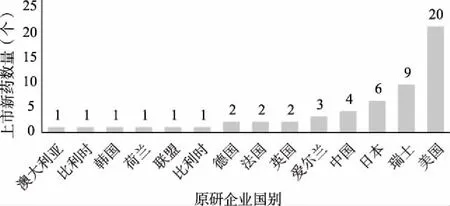
圖2 2019年美國上市新藥生產國分布
3.2 美國、日本與我國抗腫瘤新藥上市情況對比
3.2.1 上市抗腫瘤新藥適應證分析
聚焦各國上市的抗腫瘤新藥,2019年美國、日本和我國共上市抗腫瘤新藥33個,其中有三款藥品涉及兩種癌癥適應證,共涉及17個癌種,對應藥品數量排名前三的癌種分別是淋巴瘤(16.22%)、非小細胞肺癌(10.81%)、黑色素瘤和白血病(圖3)。
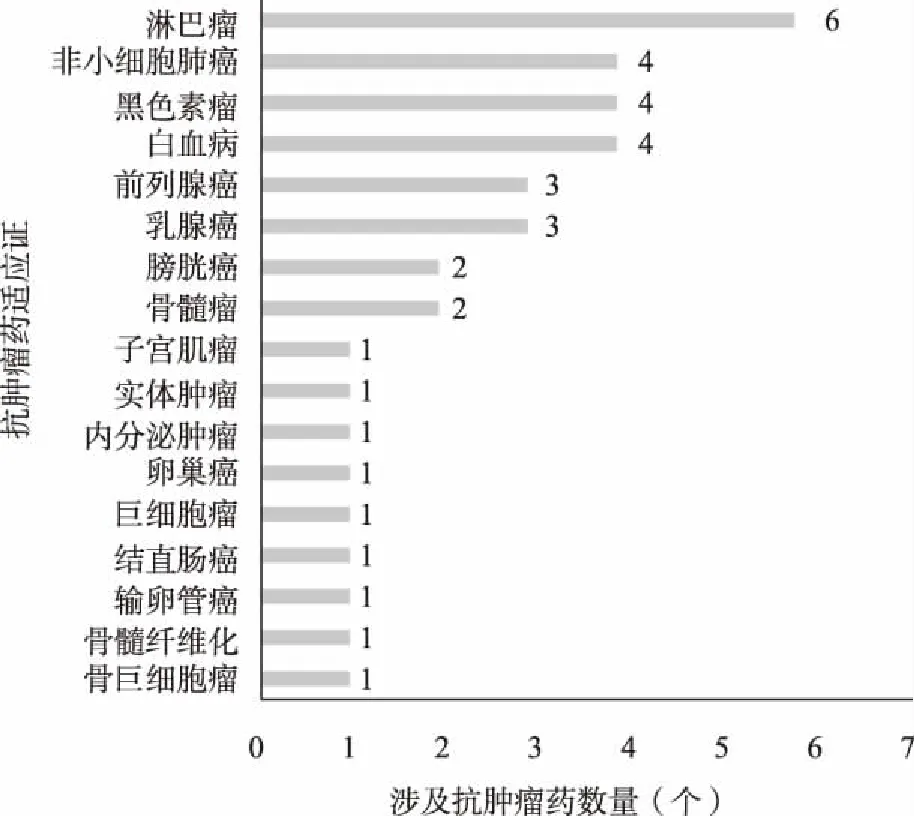
圖3 2019年三國上市抗腫瘤新藥癌種分布
我國上市的14個抗腫瘤藥中肺癌、前列腺癌、淋巴瘤和黑色素瘤的占比最高,各涉及兩個藥品;美國上市的12個抗腫瘤藥中乳腺癌、膀胱癌、淋巴瘤的藥品占比最高,各涉及兩個藥品;日本上市的10個抗腫瘤藥中肺癌的藥品占比最高,共涉及三個藥品。對比我國與美國、日本2019年上市抗腫瘤新藥及適應證,我國與日本有達可替尼(Dacomitinib,商品名:Vizimpro)和阿帕他胺(Apalutamide,商品名:Erleada)兩款藥品均在2019年獲批了相同的適應證;而美國和日本雖然都批準了羅氏制藥(Roche)研發的廣譜抗癌藥恩曲替尼(Entrectinib,商品名:Rozlytrek),但在美國獲批的適應證是非小細胞肺癌,在日本獲批的適應證是慢性淋巴細胞白血病和小淋巴細胞淋巴瘤(表2)。表明各國在選擇藥品及適應證上市審批時,尤其是臨床需求較高的重點品種的審批過程中,考慮的因素會有所區別。除了兼顧臨床治療需求、藥品的衛生經濟學價值以及醫保基金的使用可持續性[6],各國也將疾病譜及藥品在本國臨床研究數據等因素作為決策的重要依據,優先審批符合其藥品評價體系的藥品及適應證上市。
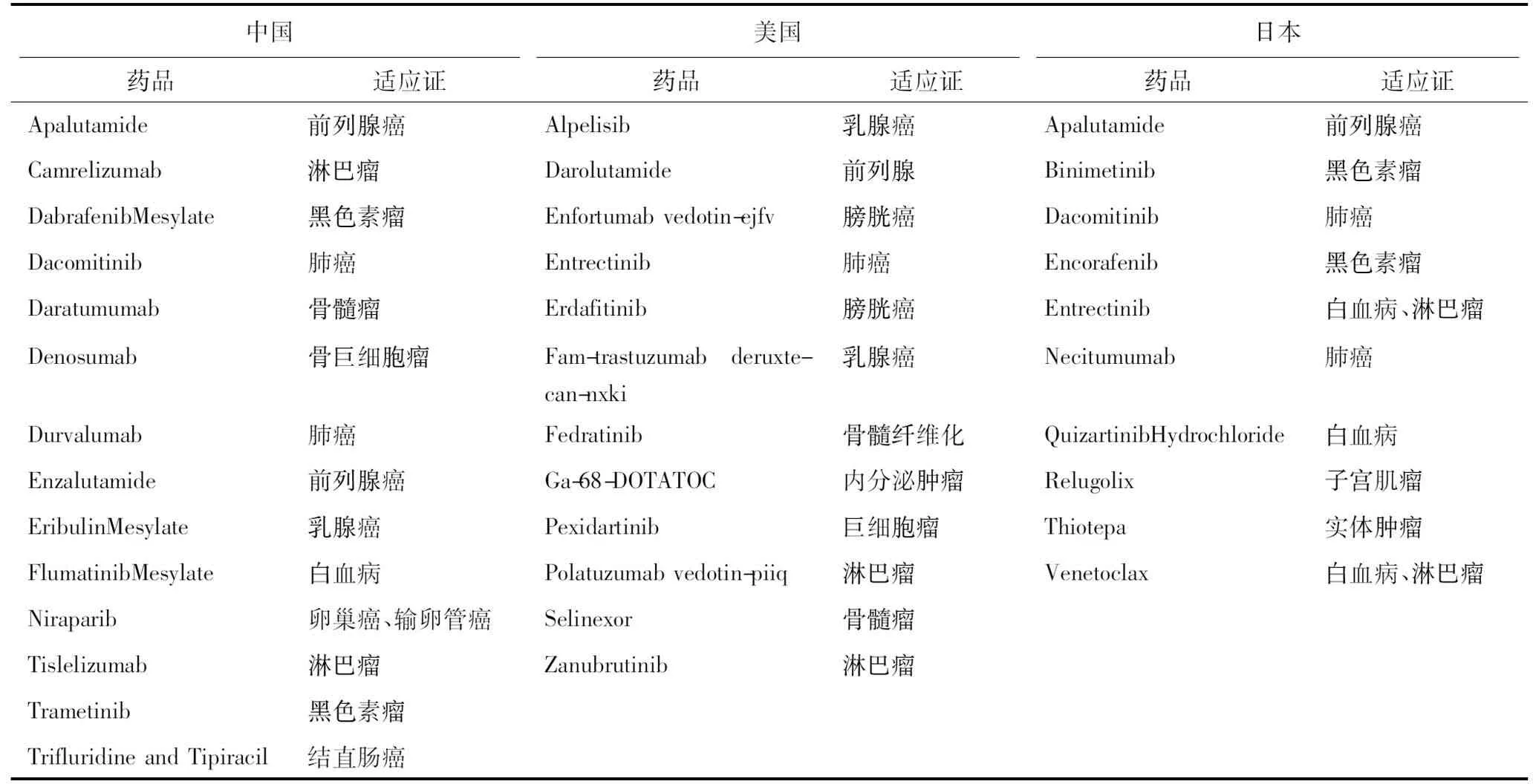
表2 2019年中美日三國抗腫瘤新藥上市情況
3.2.2 上市抗腫瘤新藥原研廠家分布
從上市抗腫瘤藥的原研企業分布來看,2019年我國上市的14個抗腫瘤藥涉及5個國家的原研企業,其中美國企業數量最多,共5個藥品(占比35.71%);2019年美國上市的12個抗腫瘤藥涉及7個國家的原研企業,其中美國的企業數量最多,共4個藥品(占比36.36%);2019年日本上市的10個抗腫瘤藥涉及日本、美國、瑞士3個國家的原研企業,其中日本企業數量最多,共5個藥品(占比50%)(圖4)。整體而言,三個國家2019年上市抗腫瘤新藥中,美國企業參與研發的藥品腫瘤最多,共13個,占比40.63%;日本企業參與生產的藥品位居第二,共9個,占比28.13%。可見,2019年上市的抗腫瘤藥中,美國企業仍是抗腫瘤新藥研發的重要力量,日本在抗腫瘤藥的研發方面也發揮了重要作用,而我國在抗腫瘤新藥研發方面仍處于起步階段,國產新藥上市數量與國際先進水平仍存在一定的差距,上市藥品的國際影響力也有待提升。
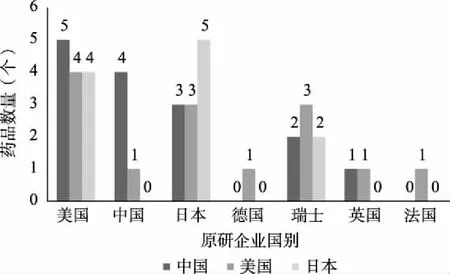
圖4 2019年三國抗腫瘤新藥生產企業分布
3.2.3 上市抗腫瘤新藥時效性對比
從獲批抗腫瘤新藥的時效性來看,我國2019年上市的14個抗腫瘤新藥中,氟馬替尼(Flumatinib,商品名:豪森昕福)、卡瑞利珠單抗(Camrelizumab,商品名:艾立妥)、替雷利珠單抗(Tislelizumab,商品名:百澤安)3個國產創新藥為全球首批;美國上市的12個抗腫瘤新藥中,有澤布替尼等9個藥品為全球首批;日本上市的10個抗腫瘤新藥中,奎扎替尼(Quizartinib,商品名:Vanflyta)、瑞盧戈利(Relugolix,商品名:Relumina)、恩曲替尼3個藥品為全球首批[7](表3)。
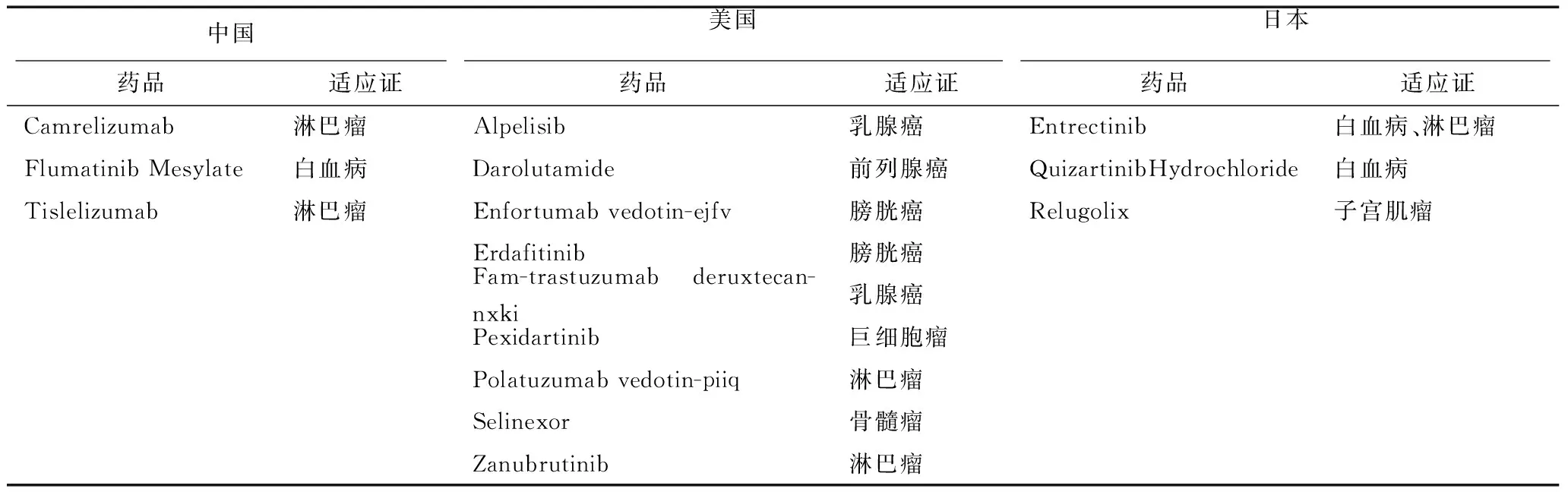
表3 2019年中美日三國全球首批抗腫瘤新藥情況
對比2019年我國上市新藥在美國和日本的上市情況,在我國上市的14個抗腫瘤藥中,2019年之前有11個藥品就已經在美國上市,其中甲磺酸艾立布林注射液和地舒單抗注射液2個藥品早在2010年就已經在美國獲批上市。日本則有8個藥品在2019年之前上市,而甲苯磺酸尼拉帕利膠囊的上市時間晚于我國(表4)。可見,盡管近年來我國多項政策均在加快境內外抗癌新藥注冊審批,但由于整體起步較晚,我國近年來批準上市的新藥多為國際已經上市的進口原研藥,在創新藥審批上市的時效性方面與美國、日本仍有一定的差距。
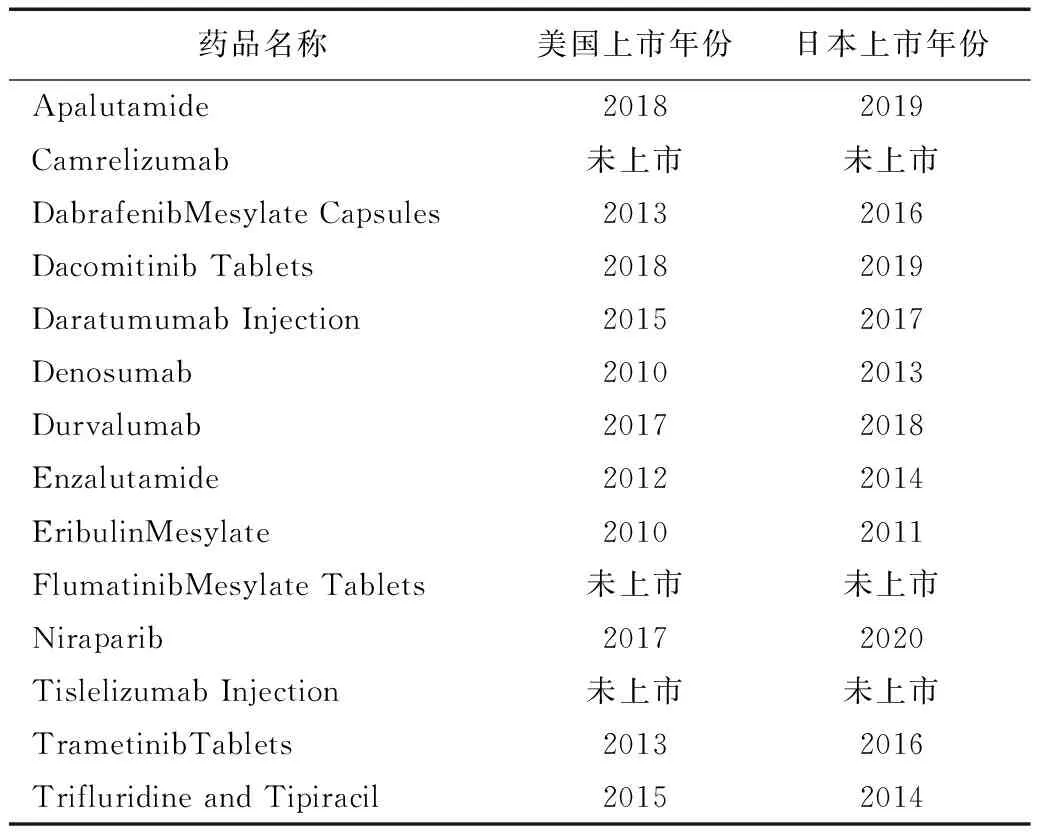
表4 2019年中國上市抗腫瘤新藥別國上市情況
4 討論
4.1 國家多項政策助力我國新藥自主研發能力的提升
黨的十八大以來,黨中央高度重視科技創新并將創新作為引領發展的第一動力。[8]在黨中央、國務院確立的創新驅動發展戰略引領下,我國藥品自主創新能力大幅提升。[9]自2016年《改革方案》發布實施以來,我國的藥品注冊制度不斷改革調整,向著國外先進水平不斷靠攏。一方面,藥品注冊制度明確“創新藥”和“仿制藥”在藥品注冊流程上的區別,對不同類別的新藥設置了多項加速審批政策,同時也對新藥的臨床價值和安全性等方面提出了更高的要求,引導藥品產業轉型,鼓勵具備自主研發能力的企業開展藥品創新研發;另一方面,藥品注冊制度也為企業藥品研發方向的確定和藥品劑型的選擇提供了一定的指導,并配合《關于深化審評審批制度改革鼓勵藥品醫療器械創新的意見》等多項創新扶持政策,提出“藥品專利鏈接制度”、“藥品專利期限補償制度”、“藥品試驗數據保護制度”等一系列創新藥專利保護措施,維護創新研發企業的合法權益,保護企業的研發積極性。[10]在此背景下,2019年我國創新藥物的研發取得了舉世矚目的成就,諸多全球首創成果的面世彰顯我國藥品創新研發能力的飛速提升。由中國百濟神州自主研發的創新抗癌藥澤布替尼(Zanubrutinib,商品名:Brukinsa)于2019年11月15日被FDA批準上市,成為我國歷史上第一個完全由本土自主研發并獲得FDA批準的國內創新藥[11],該藥也是首獲美國突破性療法認定的國內創新藥。
自國家藥品價格談判開展以來,抗腫瘤藥一直是各界關注的重點領域(表5),尤其是2018年組織開展的抗癌藥醫保準入專項談判,將臨床急需的17個抗腫瘤獨家藥品納入醫保,顯著降低了患者用藥的經濟負擔,極大地滿足了患者的臨床需求。在與藥企負責人的訪談中我們了解到,隨著五輪國家藥品價格談判結果的落地實施以及《關于抗癌藥品增值稅政策的通知》、《癌癥防治方案》等相關政策的發布,企業逐漸認識到研發抗腫瘤新藥廣闊的市場前景,并希望能夠通過國家藥品價格談判降價進入醫保,惠及更多癌癥患者。未來,在諸多政策的大力扶持下,將有更多中國企業和外資企業投身抗腫瘤新藥的研發。
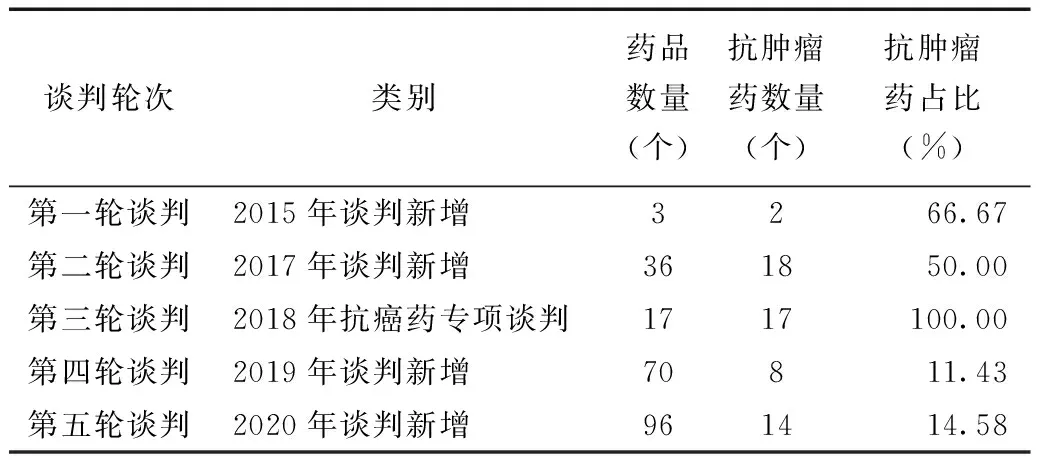
表5 2016—2020年五次國家藥品價格談判抗腫瘤藥情況
4.2 我國藥品產業格局發展不均衡,藥品創新的政策扶持和引導有待加強
從近年來我國的新藥審批情況可以發現,當前我國醫藥產業發展不均衡現象明顯,化學藥的創新研發仍是我國醫藥產業的重要力量,生物藥的創新研發勢頭近年來也較為迅猛,但中藥的研發能力有待進一步加強;進口原研藥在我國上市藥品中仍占有較大比重,我國的創新藥品在美國和日本的影響力相對有限。
我國新藥研發基礎相對薄弱,基礎研究向應用的轉化也較為匱乏;加之我國藥企規模較小,無論是企業市值還是新藥研發投入,與美國等藥品研發強國企業相比存在明顯差距。因此當前藥物政策不僅要完善對研發成功新藥的扶持和保護,更應注重對藥品研發源頭的激勵和引導。在藥品研發過程中,企業多根據政府出臺的相關政策法規了解我國對藥品研發方向的引導,而我國企業在藥品研發與政府的前期溝通方面相對被動,許多企業對國家的創新扶持政策不夠了解,導致研發動力不足,研發方向偏差,藥品上市滯后,缺乏市場競爭力,進而影響企業的研發成本回收,阻礙企業新一輪的研發創新。國家藥品價格談判、臨床急需境外新藥等政策讓企業認識到藥品創新所帶來的巨大市場潛力,而此類政策在執行過程中多以專家遴選的方式由政府向企業發出邀請,缺乏企業與政府的雙向互動。
4.3 我國創新藥上市數量接近國際先進水平,但上市藥品的時效性有待提升
從2019年各國上市新藥的數量來看,我國已超過美國和日本,表明我國在新藥的上市審批速度已經逐步向美國等國際先進水平靠攏。但分析我國上市抗腫瘤新藥在美國和日本的上市情況,可以發現除氟馬替尼、卡瑞利珠單抗、替雷利珠單抗三款國產抗腫瘤創新藥,另外11個抗腫瘤藥均已在國外上市,且在我國的上市時間平均落后美國4.6年、落后日本2.9年;從2019年抗腫瘤新藥上市的時效性來看,美國獲得全球首批的抗腫瘤新藥數量和比例均為最高,極大縮短了患者接受新技術、新療法、新藥品的時間。
在諸多新藥政策的大力支持下,我國2019年上市新藥的數量已超過美國和日本,但由于之前與發達國家新藥進口及上市審批效率存在一定差距,導致國外新藥需要經過幾年的時間才能在我國上市。在與臨床專家的訪談中,專家表示接受及時有效的治療是惡性腫瘤患者改善生存質量、延長生存期限的重要手段,及時使用療效更好、安全性更高的抗腫瘤藥對于提升患者健康水平具有重要意義。當前惡性腫瘤領域的研究發展迅猛,其治療方案也在不斷優化,醫生在臨床治療過程中受到藥品未在國內上市的限制,因此加速抗腫瘤新藥的上市審批、提升上市抗腫瘤新藥的時效性是我們亟待解決的問題。
4.4 藥品的臨床價值成為新藥上市的重要影響因素
從2016年《改革方案》對“創新藥”概念的提出,到《臨床急需名單》的頻繁更新,再到2020年對《化學藥品注冊分類及申報資料要求》的調整可以看出,我國對藥品臨床價值的高度重視。基于前期在藥品方面評審與國際先進水平方面存在差距,為滿足患者的臨床需求,通過制定《臨床急需名單》加速境外已上市新藥在國內上市,逐步實現從“滯后進口”到“同步上市”的過渡。通過2019年美國、日本與我國上市藥品情況可以發現,各國在考慮是否上市某藥品及上市何種適應證受到諸多因素的影響,不僅需要考慮各國疾病譜和臨床需求,也受到各國藥物政策的影響。同時,企業也會根據當地政策結合臨床試驗開展情況及市場發展前景等綜合因素有針對性地制定各國的藥品上市策略,其具體影響因素需進一步探討。
5 建議
5.1 建立完善的創新藥物政策體系,全流程鼓勵抗腫瘤新藥的創新研發
為保證抗腫瘤新藥的持續可及,政府不僅要重視新藥的上市審批和醫保準入,更應從源頭上提升我國的藥品創新研發能力,促進藥品產業的全面發展。結合國際政策的先進經驗,進一步強化對抗腫瘤藥創新研發全流程的政策扶持,主要包括以下幾個方面:
5.1.1 倡導研發稅收減免政策
國際上,政府多采用稅收減免或稅收優惠的方式以分擔制藥企業的研發風險,激勵企業加大創新投入,研發投入增加越多則享受的優惠力度越大。我國針對科技型企業出臺一系列稅收減免政策,但針對抗腫瘤藥品的稅收減免政策主要集中在藥品流通環節,尚未明確對抗腫瘤藥研發階段的稅收優惠政策[12];企業負責人也提出,當前我國對制藥企業的稅收處于相對較高的水平,且中國企業和外資企業的稅收政策也有所差異。在抗腫瘤領域飛速發展的背景下,我國應加速出臺相關法律對符合條件的抗腫瘤新藥研發企業實施稅收抵扣或減免,減輕制藥企業的財務壓力,發掘企業的研發能力。
5.1.2 優化政府與企業的雙向互動
政府與制藥企業建立雙向互動機制能夠實現政府、企業和社會的多方“共贏”,是發揮政府引導作用的途徑之一。從2018—2019年公布的兩批《臨床急需名單》落實情況來看,74個藥品中僅有26個藥品批準上市或完成評審,且仍有11個藥品無上市計劃,6個藥品未與企業取得聯系。我國在2020年版《藥品注冊管理辦法》中針對“突破性治療藥物”提出了企業與藥品評審中心的“雙向溝通”機制,抗腫瘤新藥基本符合此類藥物的界定。今后,政府需進一步明確抗腫瘤新藥在研發、生產、上市審批及流通等環節的政策和要求,與具備研發能力的企業開展早期溝通,了解企業的研發意向和困難,有針對性地開展政策、技術上的指導,提高企業的研發意愿和藥品的研發效率。而企業也應在此過程中主動與政府部門溝通,規避研發過程中的可控風險,反饋企業的困難和訴求,以促進政府更好地完善政策,形成良性循環。
5.1.3 平衡專利保護與鼓勵仿制的關系
專利保護不僅能保護企業的創新成果不受侵害,更是保護企業研發積極性的重要手段。在專利保護期內,企業可以快速占領市場,回收研發成本,實現研發的可持續發展,國際上多采用藥品數據保護、延長專利保護期、限制仿制藥上市等方法。我國在《中華人民共和國專利法》第四次修正中新增新藥專利期補償的規定,明確藥品專利糾紛早期解決機制,重視和保障研發企業的合法權益。而藥品仿制則將打破原研企業的壟斷地位,通過競爭將藥品價格降至相對較低的水平,患者的用藥負擔得以減輕。對臨床急需的抗腫瘤新藥而言,一味地延長專利保護期并不一定是鼓勵企業創新的最佳手段,盡管國家藥品價格談判可以將這些獨家藥品降價納入醫保,但同類藥物的研發企業由于研發進度滯后,專利申請晚于原研企業,在專利保護政策的影響下產品的上市時間將大大延遲,對制藥企業發展造成沉重的打擊。因此,在當前我國制藥企業規模普遍不大的情況下,促使企業間的研發合作可以集中力量提升研發效率,同時也可以避免因競爭而造成研發成果滯后上市的損失;而研發效率的提升和成本的降低則可以為仿制藥品的盡早上市創造條件。
5.2 完善創新藥品審評審批制度,加速抗腫瘤新藥進入流通市場
5.2.1 科學探索,優化加速審批機制
優化藥品的上市審批流程,探索建立安全、高效的加速審批流程是世界各國共同面臨的問題。專家指出,當前我國對新藥的審評主要關注其“一致性”,不符合創新藥物的研發規律。[13]近年來,我國修訂和出臺多項政策縮短藥品的上市審批時間,在加速審批環節提出了四種加速審批程序,抗腫瘤新藥作為臨床價值較高的品種也屬于加速審批的范疇,但與歐美等國相比,我國在新藥申報臨床試驗階段的技術評審要求相對更高[13],這無形中又拉長了新藥的審批周期。因此,在未來審評制度的優化過程中,一方面需要借鑒人用藥品技術要求國際協調理事會(ICH)等相關國際指南修訂我國的審評技術指南,提升我國藥品審評的科學性和嚴謹性,為我國原研藥品的國際化發展奠定基礎;另一方面,加強對加速審批藥品上市后臨床數據的追蹤和監測,既保證患者用藥的時效性,更要注重藥品的安全性。
5.2.2 政府主導,穩步推進《癌癥防治方案》
《癌癥防治方案》的實施對提升我國癌癥防治能力、居民的健康素養及健康水平具有重要意義,其中“實現境外抗腫瘤新藥在我國的同步上市”受到社會各界的廣泛關注。2020年9月29日,治療非小細胞肺癌的新型靶向藥普拉替尼(Pralsetinib,商品名:普吉華)在海南博鰲超級醫院開出了美國之外的全球首張處方,是樂城先行區第一個實現國際同步上市、同步使用的創新抗癌藥,讓患者和外資企業看到了未來廣闊的前景。該方案的推進離不開政府的主導作用,要實現藥品的同步上市,更需要政府部門與外資企業的早期溝通,使企業了解到我國廣闊的市場,在試驗階段注重對我國數據的收集,為新藥同步上市奠定基礎。而新藥同步上市后要想真正的惠及患者,臨床的診療技術也要隨之更新,因此需要加強臨床醫生對新療法、新技術的培訓和學習,配合藥品落地政策實現藥品進院可及,打通患者用藥的“最后一公里”。
5.3 建立多維度的藥品價值評價體系,全面評估創新藥品的價值
以價值為基礎的衛生決策受到多方因素影響,因此僅從經濟學的角度對藥品的價值進行評價往往是片面的,尤其是創新藥。抗腫瘤新藥除了有較高的臨床價值,在創新價值、社會價值等方面也要高于普通藥品,因此構建多維度的藥品價值評價體系對創新藥實現全面評價顯得尤為重要。國際藥物經濟學與結果研究協會(ISPOR)于2014年成立工作組專門研究多準則決策分析(Multi-criteria Decision Analysis, MCDA)在衛生領域的應用,而我國學者也提出此方法對我國《藥品目錄》藥品遴選具有重要意義。[14]2018年,ISPOR提出多維度的藥物價值框架的概念,并提出社會關注、醫保部門關注、患者關注三個維度、十二個指標的評價體系,可較為全面的評價藥品的價值。[15]未來,我國可借鑒MCDA的思想開發適合于我國的創新藥價值評價體系,并應用于上市審批制度的改革,針對抗腫瘤新藥等創新藥品明確加速審批程序的篩選標準,為抗腫瘤新藥的加速上市提供依據。
盡管當前進口原研藥仍然是我國抗腫瘤新藥的重要來源,但我國也已具備一定的藥品研發能力,我國應大力扶持和引導中國企業集中研發新藥,提升國產新藥的研發效率和質量;與外資企業建立聯系,鼓勵進口新藥在國內開展試驗提交上市申請;同時完善我國藥品上市審批制度,探索適合于抗腫瘤新藥的加速審批程序,提升惡性腫瘤防治能力,切實提升患者的用藥可及性和時效性。
作者聲明本文無實際或潛在的利益沖突。

