不同PE材料遮光下血橙轉色期果皮花色苷合成及其相關基因的表達分析
楊海健, 張云貴, 周心智, 洪 林, 楊 蕾, 彭芳芳, 王 武
(重慶市農業科學院 果樹研究所,重慶 401329)
血橙(CitrussinensisL. Osbeck)原產于地中海地區,四川和重慶是我國的主要栽培產區,品種以塔羅科血橙為主。血橙是典型的花色苷著色柑橘品種[1],其紅色靚麗的外觀深受消費者喜愛,紅艷的色澤可謂是血橙最重要的經濟性狀[2]。引起血橙果皮著色的主要是花色苷和類胡蘿卜素,而花色苷起決定性作用[3]。花色苷是植物體內重要的次生代謝物質,屬于黃酮類化合物[4]。研究認為,花色苷有抵御紫外線損傷的作用[5],同時還具有重要的營養和藥理作用,如抗氧化[6]、抗炎[7]、抗癌[8]、預防心血管疾病[9]等。血橙外觀品質很大程度上代表著血橙的經濟價值,因此,外觀一直是血橙產區關注的重點,而目前生產上存在不同程度的血橙果面著色淺的問題。血橙果面花色苷合成除遺傳因素外,外界環境對其合成積累也具有重要調節作用。作者前期已經證實血橙果皮花色苷的合成受光照調控[3],該研究在此基礎上,以塔羅科血橙新系為試驗材料,進一步研究了血橙轉色過程中(花后189~264 d血橙果皮由綠轉黃再轉紅)在不同PE材料遮光處理下的果皮花色苷動態含量、花色苷合成的主要基因的動態表達量,深入探索血橙果面花色苷積累受光調控的機理,以期為改善生產中血橙果面著色不良問題提供解決思路。
1 材料與方法
1.1 試驗材料
試驗地位于重慶市萬州區武陵鎮塔羅科血橙園,該園為丘陵地果園,海拔256~300 m;土壤為紫色土,土壤pH 6.6~7.1,土層厚度40~55 cm,年平均氣溫17.7 ℃,年平均日照時數1 484.4 h。于2019年10月選擇園內受光條件較好的10株塔羅科血橙健康樹為試驗樹。采用5種厚度(12絲)相同、顏色不同的PE透光袋作為遮光材料,顏色分別為透明、紅色、綠色、藍色、紫色。
1.2 試驗處理
于2019年10月15日,對樹體外圍血橙果實進行套袋遮光處理,袋子套好后剪掉袋子的4個角,利于透水透氣,以未套袋的外圍果實作為對照,由于紅色PE袋在日光下容易褪色,試驗在血橙的整個轉色期需要對紅色PE袋進行頻繁的換新。2019年4月25日為血橙謝花末期,采樣日期為2019年11月1日(花后189 d)至2020年1月15日(花后264 d),每隔15 d采樣1次,每處理3個重復,每重復5個果實,當天帶回實驗室立即削取果皮外皮層于液氮中速凍,-80 ℃保存備用。
1.3 樣品測定
1.3.1 遮光袋透光率測定
采用紫外可見近紅外分光光度計(UV-7502C)分別測定各遮光袋在250~700 nm的透光率,每隔25 nm測定一次。
1.3.2 總花色苷含量測定
采用pH示差法[10-11]對不同采樣時期的各處理血橙果皮中總花色苷含量進行測定。
1.3.3 果皮色澤測定
采用KONICA MINOLTA便攜式色差計對花后264 d各處理果實果面進行色澤測定,每處理測定5個果實,每個果實沿赤道均勻采集4個點進行測定。
1.3.4 RNA提取、cDNA制備與實時熒光定量PCR
RNA提取與cDNA制備采用大量法并略作修改。液氮研磨0.5 g樣品成粉末,快速轉入已加入5 mL RNAiso Plus(TaKaRa)抽提液的15 mL離心管中,上下顛倒混勻后靜置15 min,加入1.5 mL氯仿,劇烈振蕩15~30 s后靜置10 min,在4 ℃下,10 000×g離心15 min,取上清至另一離心管中,再加入1.5 mL氯仿重復操作。上清液轉至新離心管后加入等體積異丙醇,室溫靜置2~3 min,4 ℃,10 000×g離心20 min,棄上清后加入1.5 mL預冷的75%乙醇,在-20 ℃冰箱中靜置30 min,再加入1.5 mL預冷的75%乙醇重復操作。10 000×g離心8 min,棄乙醇,按沉淀大小加DEPC水溶解。1%瓊脂糖凝膠電泳檢測,分光光度計檢測,分裝。以提取的RNA為模板,利用PrimeScriptTMRT reagent Kit with gDNA Eraser (Perfect Real Time) 反轉錄試劑盒合成cDNA。
實時熒光定量PCR。內參基因選用EF-1α(登錄號XM_015533332),內參EF-1α、CHS、DFR、UFGT基因引物序列參考Crifò等[12],Ruby、MYBF1、PAL、GST、ANS、CHI、C4H、4CL、F3H基因引物序列參考Carmona等[13]。引物序列見表1。

表1 實時熒光定量 PCR 引物序列
利用TB Green?Premix Ex TaqTMⅡ(Tli RNaseH Plus)試劑盒進行qRT-PCR 反應,反應體系20 μL,其中TB Green Premix ExTaq(Tli RNaseH Plus) Ⅱ(2×)10 μL,PCR上下游引物10 μmol·L-1各0.4 μL,cDNA模板(<100 ng)8.2 μL。反應程序為:95 ℃ 1 min;95 ℃ 10 s,58 ℃ 30 s,40 個循環。每個模板做3次重復。采用 2-ΔΔCt法計算基因相對表達量。反應儀器為BIO-RAD CFX96TM Real-Time Systerm。
1.4 統計分析
試驗數據采用Excel 軟件進行整理分析與繪圖,利用SAS 8.0的SAS ANOVA多重分析比較法進行差異顯著性分析。
2 結果與分析
2.1 不同PE袋的透光率分析
采用分光光度計對5種顏色PE遮光袋進行透光率測定(圖1)。結果顯示,無論是可見光還是紫外光部分,透明袋的透光率均為最高,且隨著波長變短,透明袋的透光率呈現逐漸下降的趨勢。在250~700 nm的整個光譜中,綠袋和紫袋表現出近似的透光曲線,透光率沿波長由長到短呈現緩波浪向下的趨勢。在300~700 nm的光譜中,紅袋與藍袋的透光率曲線趨勢相反,紅袋透光曲線的波峰和波谷正好與藍袋的波谷和波峰相遇,藍袋對紅光(620~700 nm)、黃光(580~620 nm)、UVA光(320~400 nm)的透過率明顯較其他PE袋差,而紅袋對綠光(490~580 nm)、藍光(450~490 nm)、紫光(400~450 nm)的透過率明顯較其他PE袋差,而在小于300 nm的光譜中紅、藍兩種PE袋表現相同的下降趨勢。在280~315 nm的(UVB、UVC)紫外光譜中,透明袋呈現最高的透光性(約為71.7%~63.6%),綠袋和紫袋次之(約為55.2%~48.3%),紅袋和藍袋的透光性則最差(約為48.4%~29.1%)。
2.2 不同PE袋遮光下血橙果皮總花色苷含量的變化
如圖2所示,在花后189 d血橙果皮正處在由綠轉黃時期;花后204 d對照血橙果皮完全轉黃;花后219 d對照血橙果皮開始出現肉眼可見的花色苷著色,透明袋中部分果實的果皮也開始顯現少量花色苷著色,其他PE袋處理著色不明顯;花后234 d,所有處理果皮均出現花色苷著色,只是紅袋和藍袋處理果皮花色苷著色較少;花后249~264 d,各處理果實果皮花色苷著色迅速增加,并根據果皮著色深淺可將其分為4組:對照血橙果實果皮著色最深,面積最大;透明袋處理次之;綠袋和紫袋處理再次之;紅袋和藍袋處理著色最淺。
如圖3所示,花后189~204 d各處理血橙果皮中均未檢測到花色苷含量。花后219 d,在除紅袋遮光以外的其余各處理血橙果皮中檢測出花色苷,其中,對照和透明袋處理果皮花色苷含量較高。之后,各處理果皮的花色苷含量增加,以對照果皮花色苷含量增加最快,透明袋處理次之,綠袋和紫袋處理再次之,紅袋和藍袋處理花色苷含量增加相對較慢。各處理果皮總花色苷測定結果與肉眼觀察的血橙著色基本一致。
色差計測定結果(表2)顯示,各處理間代表紅色的a值以對照最高,透明袋處理次之,紅袋處理最低,其中對照與綠袋、藍袋、紅袋處理的a值具有顯著性差異,而與透明袋和紫袋之間無顯著性差異,透明袋a值與紅袋、藍袋具有差異顯著性,a值由大到小分別為:對照>透明袋>紫袋>綠袋>藍袋>紅袋。而代表黃色的b值則呈相反趨勢:紅袋>藍袋>紫袋>透明袋>綠袋>對照。亮度值(L)表現為對照最低,套袋處理較高,且表現出PE袋的遮光率越高,遮光后果面越亮的趨勢。
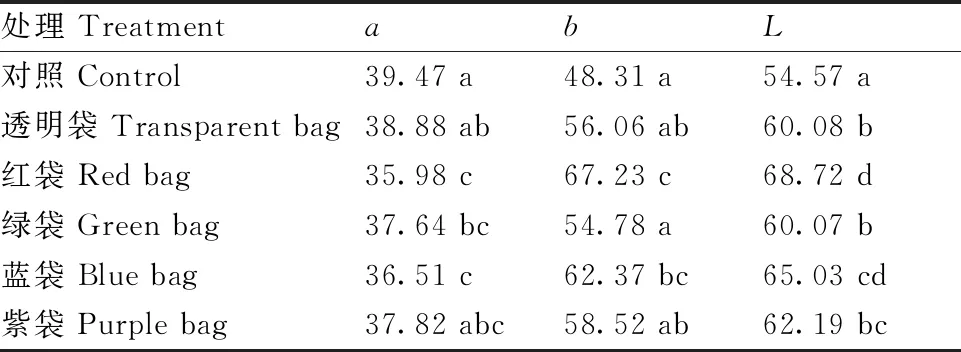
表2 不同處理血橙果實表皮的色澤情況
2.3 不同PE袋遮光下血橙果皮花色苷合成相關基因表達量的變化
血橙果肉中花色苷的代謝途徑研究得較為清晰。苯丙氨酸在苯丙氨酸裂解酶(PAL)、肉桂酸羥化酶(C4H)、香豆酞 CoA連接酶(4CL)、在查爾酮合成酶(CHS)、查爾酮異構酶(CHI)、黃烷酮-3-羥化酶(F3H)、二氫黃酮醇-4-還原酶(DFR)、花青素合成酶(ANS)、類黃酮糖苷轉移酶(UFGT)、谷胱甘肽轉移酶(GST) 等為血橙花色苷生物合成途徑中的主要結構基因[13]。R2R3-MYB是花色苷生物合成的關鍵正調節劑,而Ruby和MYBF1是R2R3MYB的轉錄因子[13-14],二者對血橙花色苷的產生至關重要。
由圖4可知,遮光對血橙果皮花色苷合成相關基因的影響較大。8個結構基因GST、ANS、CHS、DFR、F3H、UFGT、PAL、4CL和2個調節基因Ruby、MYBF1在遮光處理后的表達量明顯降低。其中基因GST、ANS、CHS、DFR、PAL、UFGT、Ruby在不同處理下的表達趨勢與對照一致,在果實逐漸成熟過程中均呈上升表達,只是表達量較自然光下有明顯降低。而基因F3H、MYBF1、4CL在遮光處理下的動態表達曲線與對照不同,遮光導致了這3個基因在果實轉色期間的表達增幅變小。自然條件下,這些基因在花后189~204 d維持在較低的表達水平,204~234 d表達量開始緩慢增長,234 d表達量進入較快速增長,249 d表達量急速提升,迅速與遮光后的基因表達量拉開差距。而CHI、C4H兩個基因無論在自然光照下還是在遮光處理下,均未出現明顯上升表達。
遮光條件下,血橙果皮花色苷合成相關基因表達與PE材料的透光性相關。結構基因GST、ANS、CHS、DFR、F3H、UFGT、PAL、4CL和調節基因Ruby、MYBF1在果實成熟過程中的動態表達量可按遮光PE材料分為3組:透明袋表達量最高,紫袋、綠袋次之,紅袋、藍袋表達量最低,基本與各遮光PE材料對UVB、UVC的透過率相對應,即透明袋透過率最高,其次為紫袋、綠袋,紅袋、藍袋透過率最低。
3 討論
血橙果實在成熟過程中的遮光處理,阻礙了果皮花色苷的合成,這種阻礙首先表現在時間上,遮光延遲了血橙果皮花色苷的合成時間,這點在所有不同顏色PE遮光袋上均有表現,其中以紅色袋表現最為明顯(圖3)。其次表現在面積上(圖2),自然條件下,血橙果皮大部分面積裸露在光下,花色苷合成沿一個面或多個面同時合成,形成較大的花色苷著色面積,特別是在花后264 d,很多果實呈現整果面著色,而遮光處理的果面只是一部分或半邊著色,有些果面出現斑塊狀或斑點狀著色,著色不均。這可能與復雜的果面光際環境有關,因為PE袋套果后袋子離果面的距離有遠近差異,且袋子容易出現褶皺,光線在穿過PE袋時產生各種折射角度等都會引起果面受光的不同,在這些因素的附加作用下產生了復雜的果面光際環境。最后表現在著色深淺上,色差分析結果顯示了對照血橙的果皮紅色程度較遮光處理的深,這點肉眼即可辨別(表2)。遮光后血橙果面的亮度普遍較對照高,這與套袋在甜瓜[15]、芒果[16]、柑橘[17]、油梨[18]等水果上的表現一致。血橙果面亮度與PE袋的透光率成反比,透光率越低果面亮度越高,這可能與血橙果面花色苷著色相關,因為有研究認為果實花色苷的含量與色差指標中的亮度呈反比[19]。因此,血橙果面的受光環境也是影響果面亮度的重要因素。
不同PE材料對不同波長光的透過率存在差異。在560~700 nm的波段內,按透光率可將PE袋分為3組:透明袋最高,紅袋、紫袋、綠袋中等,藍袋最低;400~550 nm的波段內,也分為3組:透明袋最高,藍袋、紫袋、綠袋中等,紅袋最低;325~400 nm的UVA波段內:透明袋最高,綠袋、紫袋、紅袋中等,藍袋最低;250~320 nm的UVB、UVC波段內:透明袋最高,紫袋、綠袋中等,藍袋、紅袋最低。而在果實轉色期間,按血橙果皮總花色苷測定結果對PE袋進行排序分組:透明袋最高,綠袋、紫袋中等,藍袋、紅袋最低,這與PE袋在UVB、UVC波段內透光率一致。說明血橙果皮總花色苷合成與光射線中的UVB、UVC可能存在關系。
血橙轉色期間,觀察對照血橙的果皮花色苷合成相關基因的表達量發現,結構基因GST、ANS、CHS、DFR、F3H、UFGT、PAL、4CL和調節基因Ruby、MYBF1在轉色期間相對表達量呈現快速增加,因此,判斷這10個基因屬于血橙成熟過程中果皮花色苷合成關鍵調控基因,這與喻最新等[20]研究血橙果肉中花色苷合成關鍵基因結果類似,不同的是其未將PAL基因定為關鍵基因,而本研究結果顯示,在血橙果實轉色期間果皮PAL基因無論是在自然條件下還是在各遮光條件下均呈明顯上升表達。遮光造成了血橙果皮花色苷合成基因的相對表達量不及對照,尤其在花后249~264 d,顯得尤為明顯,差別幾倍至幾十倍。因此,判定這10個基因在血橙果皮花色苷合成過程中受到了光的調控。
值得注意的是,按遮光對血橙果皮花色苷合成關鍵基因表達的影響程度,對PE袋進行排序分組,同樣將其分為3組:透明袋最高,綠袋、紫袋中等,藍袋、紅袋最低,又一次與PE袋在UVB、UVC波段內透光率完美契合。再次印證了血橙果皮花色苷合成與光射線中的UVB、UVC關系密切。這點在其他植物果實上得到了驗證,低劑量的UVB處理,能增加桃的花色苷含量[21],UVC處理草莓能夠促進總酚類和總花色苷的增加[22]。
血橙果皮花色苷合成關鍵基因均在花后234 d后開始大量表達,花后249 d后表達量驟升,因此,推測血橙果皮花色苷合成的關鍵時期在花后249 d以后,此時果皮花色苷開始大量合成,顏色快速增加。生產中部分果農提早采收導致血橙果面著色淺、不均勻即為此原因,因此,血橙應在花后249 d以后采摘較為適宜。由于透明袋的透光性較好,用透明PE材料遮光的血橙果皮總花色苷含量均高于其他幾個遮光處理。生產中重慶地區為預防血橙冬季落果,通常采用冬季樹體覆膜技術進行保果,因此,在冬季血橙覆PE膜保果時為了降低對血橙果面正常著色的影響最好選用無顏色的透明膜。

