環狀RNA特征與功能及在水產中的研究進展
李 斌 ,閆潤堃,劉曉林,孟智超,李 悅,孟沛藝,黃 勇
(河南科技大學動物科技學院,河南 洛陽 471023)
環狀RNA(Circluar RNAs,circRNAs)是一類不具有5′和3′末端頭尾的閉合環狀非編碼RNA分子,廣泛存在于真核細胞中[1-2]。早在1976年,在馬鈴薯(Solanumtuberosum)塊莖類病毒中首次發現一些RNA病毒能抗磷酸二酯酶的降解,并鑒定出這些RNA分子是由一個以上外顯子以共價閉環結構形式存在[3]。隨后研究人員通過電子顯微鏡能觀察到真核細胞中此RNA為環形結[4]。鑒于circRNAs結構的特殊性和當時科技條件對RNA分子世界認識的限制,circRNAs曾一度被認為是因RNA剪切拼接錯誤而形成且幾乎無生物功能的副產物,因而未引起當時研究者的廣泛重視[5]。直到1991年,Nigro等首次證實在人類細胞中鑒定出了circRNAs,其重要的生理功能才逐漸被人們所認識[6]。近年來,隨著生物信息分析技術的快速發展和RNA高通量測序技術的進步,越來越多的circRNAs在真核生物中被發現,使其成為繼發現微小RNA(MicroRNA,miRNA),Piwi蛋白相作用RNA(Piwi-interactiing RNA,piRNA)和長鏈非編碼(Long non-coding RNA,lncRNA)之后RNA領域又一研究的熱點[7-8]。本文綜述了circRNAs的生物學特征、形成機制、主要功能及其在水產中的最新研究進展,為深入研究circRNAs調控機制提供一定的理論基礎。
1 circRNAs的生物學特征
目前研究發現,circRNAs 在生物體中所具有的重要功能與它的生物學特征有關。主要特征有:1)細胞定位:大部分circRNAs來源于編碼基因的外顯子并位于細胞質中,少數的circRNAs來源于內含子和外顯子-內含子并位于細胞核中[9];2)在生物體中廣泛存在:circRNAs從病毒、真菌到高等脊椎動物以及植物等多種生物組織中都存在(圖1)[10];3)高穩定性:由于circRNA是通過5′與3′端首尾相連共價閉合的環狀分子,所以能抵抗RNA外切酶(Ribonuclease R,RNase R)的降解,比對應線性mRNA穩定得多[11];4)較高保守性:大部分circRNAs的一些序列在進化上是保守的,不僅在哺乳動物中具有保守性,甚至在進化關系較遠的果蠅也存在保守性[12];5)半衰期較長:研究表明,circRNAs比對應的線性mRNA 轉錄本更具穩定性,circRNAs的半衰期超過48 h,而mRNA的半衰期約10 h[13-14];6)特異性表達:circRNA在不同細胞類型和不同組織中的發育階段有特異性表達,尤其是在病理和非病理組織中存在明顯的表達差異[15],例如由DOCK1基因產生的circRNA在乳腺癌細胞系MCF-7中高水平表達,而在肺癌細胞系A549中呈現低水平表達[16];7)差異性表達:有研究表明約1/8 的基因同時含有線性mRNAs和circRNAs,而且在有些組織中,細胞內circRNAs的含量比對應的線性mRNA更加豐富,其表達水平比線性mRNA 高出10倍之多[17-19]。

2 circRNAs的形成
經典的生物真核mRNA生成機制是mRNA前體(Precursor mRNA,pre-mRNA)剪切掉內含子并連接外顯子,通過連接酶的作用從而形成具有5′帽子和3′尾巴的線性RNA轉錄本;而circRNAs的形成方式不同于線性RNA的剪切,它主要是由pre-mRNA以反向剪接方式產生,形成共價閉合環狀RNA分子,其產生過程通常涉及到本身宿主基因的轉錄和剪切,并與線性剪切機制相互競爭。根據circRNAs在基因組中的來源及其構成序列的堿基來源,可分為7 種類型:1)僅來源于外顯子的環狀RNAs(Exon circular RNAs,EcRNAs);2)來源于外顯子-內含子的環狀RNAs(Exon-intron circular RNAs,EIciRNAs);3)僅來源于內含子的環狀RNA(Intron circular RNAs,ciRNAs);4)來源于融合基因的環狀RNA(Fusion-circRNAs,f-circRNAs):基因間重排,產生異常融合而形成環狀RNAs;5)來源于反義鏈轉錄的環狀RNAs(Antisense circular RNAs):6)來源于基因間序列的環狀RNAs(Intergenic circular RNA);7)TricRNAs成環(tRNA intronic circRNAs):由pre-tRNAs 剪切后形成的tricRNAs[21-23]。
目前公認的生物體內circRNAs形成主要是通過反向剪切來完成,有4種產生機制[24-26]。1)套索驅動成環機制(Lariat-driven circularization):主要通過外顯子跳躍,由附近上游外顯子的3′端形成剪接供體(Splice donor)和靠近附近下游外顯子的5′端形成剪接受體(Splice acceptor)以共價鍵結合的方式,然后再在剪接酶的作用下清除內含子,形成ecircRNAs(圖2A)。2)內含子配對成環機制(Intron pairing-driven circularization):不通過外顯子跳躍,而是由上下游外顯子兩側的2個內含子上的堿基反向互補配對,如ALU 重復序列,通過配對成環,然后除去內含子進而形成ecircRNAs;這種配對形成的環化機制也可以保留內含子形成EIciRNA,這種形成機制還需要進一步探索(圖2B)。3)RNA結合蛋白(RNA-binding protein,RBP)環化機制(RBP driven-circularization):該蛋白可以和兩側翼內含子序列結合,能在內含子之間建立橋梁而堿基產生配對,保證側翼內含子序列相互結合,從而促進circRNAs 或者EIciRNAs的生成(圖2C)。4)內含子套索環化機制(Circular intron RNA):經由剪接體形成的內含子套索產生,要求5′剪接位點富含7個堿基的GU 序列和3′分支位點富含11個堿基的C序列,以避免脫分支酶對其降解,從而保證ciRNAs生成(圖2D)。目前關于circRNA形成機制的方式尚有爭議,后續的研究工作需要進一步揭示其具體產生機制。

3 circRNAs的功能
circRNAs廣泛存在于真核生物中,具有circRNA序列保守性,表達呈現一定的組織特異性和發育階段性,這表明 circRNA是一種功能分子。隨著對circRNA研究的逐步深入,目前相對比較明確和成熟的觀點是circRNA具有吸附 miRNA、吸附蛋白、蛋白質翻譯和調控基因轉錄等功能。
3.1 作為miRNA的海綿體
circRNAs序列上具有miRNAs結合位點,能作為miRNA的“海綿吸附體”或競爭性的內源RNA(Competitive endogenous RNA,ceRNA)與miRNAs結合,增強其所調控靶基因的表達[27-28](圖3A)。早期的研究報道了一種存在于人和鼠腦組織中的circRNA,被稱之為小腦變性相關蛋白1反義轉錄物(Antisense tothe cerebellar degeneration-related protein 1 transcript,CDR1as)。該circRNA包含有74個能與miR-7結合的位點,能吸附miR-7,充當“超級海綿吸附體”。當過表達CDR1as時,能與miR-7結合,進而促進miR-7靶基因的表達;而當CDR1as的表達被抑制時,則會降低miR-7靶基因的表達水平[29]。此外,另一個有代表性的研究是circSRY(Circular sex-determining region Y),該環狀RNA分子來源于小鼠睪丸中Y 染色體中的性別決定區基因。研究發現,circSRY中含有16個miR-138保守結合位點,通過“海綿吸附”作用來抑制miR-138的活性,進而調控miR-138所作用的靶基因[30]。目前越來越多的證據表明circRNAs 在真核生物中作為miRNA 海綿體吸附機制是circRNAs發揮調控功能中的一個普遍現象[31-32]。
3.2 作為蛋白質的海綿體
一些circRNAs可以通過其環狀結構上的特定靶點與蛋白質結合,從而形成蛋白質/circRNAs復合體,發揮生理作用(圖3B)。例如circRNAs可與RBP相互結合,調控circRNAs 的形成[33]。盲肌蛋白(Muscleblind,Mbl)是一種RBP,可結合其宿主基因第2外顯子,當過表達Mbl時,則會促進Mbl基因生成環狀分子circMbl,并同時抑制Mbl基因通過常規的剪接方式生成對應線性mRNA轉錄本;而新生成的circMbl反過來又可以與過量的Mbl結合,進行平衡circMbl和Mbl的生成量,使各自表達趨于穩定[34]。circFoxo3可以與阻滯細胞循環的周期蛋白依賴性激酶抑制劑(Cyclin-denpendent kinase inhibitor1,p21)和細胞周期蛋白依賴激酶2(Cyclin-dependent kinase 2,CDK2)結合,形成circFoxo3-p21-CDK2三原復合物,從而影響CDK2的生物學功能,導致細胞不能正常進入細胞周期,而發生細胞的周期停滯或者細胞凋亡[35-36]。此外,其他研究證實,circPABPN1能與(Human antigen R,HuR)蛋白競爭性的結合,并抑制PABPN1基因的翻譯[37]。此外,circANRIL可與pre-rRNA和(Pescadillo homolgue 1,PES1)蛋白進行競爭性的結合,抑制核酸外切酶對pre-rRNA的進一步加工,阻止核糖體的成熟[38]。
3.3 編碼蛋白或者多肽
一般認為circRNAs因具有環狀結構、無5′和3′端特征,曾被認為無編碼蛋白或者多肽能力,通常定義為非編碼RNA。1986年,有學者在HDV(Hepatitis delta virus)中發現circRNA分子可以編碼病毒蛋白,而且與肝炎疾病的發生相關[39]。合成有內部核糖體進入位點序列(Internal ribosome entry site,IRES)的circRNAs可以招募核糖體來執行蛋白翻譯(圖3C),而不含IRES的circRNAs 則不能開啟翻譯機制[40]。Li J等研究發現circRNAs序列中含有的綠色熒光蛋白(Green fluorescent protein,GFP)的開放閱讀框(Open reading frame,ORF)能在大腸桿菌體內表達,并產生GFP[41]。另外一項研究也表明,在circRNAs中人工合成缺乏的IRES,可通過插入多個標記有 Flag 編碼序列的方式,能保證circRNAs以滾環擴增復制的形式進行翻譯[42]。Chen X等首次建立了匯總可編碼蛋白的circRNAs數據庫(circRNADb),并對潛在可能編碼circRNAs中的IRES和ORF進行了注釋,并隨后用質譜儀驗證了他們編碼蛋白的表達[43]。來自小鼠和人成肌細胞的環狀分子circZNF609 ORF在成環時會產生一個與線性mRNA轉錄本相同的起始密碼子和終止密碼子,并不依賴于mRNA結構的方式來編碼蛋白[44]。最近的研究表明,富含有N6-腺苷酸甲基化(m6A)的circRNAs序列,可以通過招募eIF4G2和 YTHDF3促進不依賴于5′和3′結構端翻譯的開啟機制而進行編碼蛋白[45]。研究發現,circFBXW7能翻譯21 kDa并含有185氨基酸的蛋白質FBXW7,該蛋白能與USP28競爭性的結合來調控原癌基因c-Myc 蛋白的穩定性,來進一步抑制惡性膠質瘤細胞的增殖與發生[46]。Zhang M等研究亦證實了circPINT能通過IRES機制編碼出含有87aa的全新多肽(PINT87aa)[47]。后續對這些能編碼蛋白的circRNAs需要開展功能驗證。
3.4 調控宿主基因的表達
研究表明,circRNAs與線性 mRNA在序列上具有高度的一致性,能通過互補序列與U1小核糖核蛋白(U1 small nuclear ribonucleoproteins,U1snRNP)和RNA聚合酶II(RNA polymerase II,Pol II)結合形成復合體順式調控宿主基因的表達(圖3D)。ciankrd52(Ciankyrin repeat domain 52)是來源于錨蛋白重復結構域52的circRNA,通過特異性的與U1snRNP和Pol II結合來調控宿主基因ankrd52表達,增強了ankrd52轉錄效率。當特異性敲出ciankrd52 后,能明顯降低ankrd52的轉錄效率,說明circRNA具有順式調控宿主基因表達功能[48]。此外,研究還發現來源于細胞中的circEIF3J,同樣能與U1snRNP相互作用,對宿主基因EIF3J的表達進行調控[35]。Li F等證實,來源于E3泛素蛋白連接酶的環狀RNA分子cirITCH與E3泛素蛋白連接酶的3′UTR上同樣都具有miRNAs的結合位點,對miR-7、miR-17和miR-214進行海綿吸附。進一步分析表明,cirITCH能與這些miRNAs相互作用,增強E3泛素蛋白連接酶的轉錄水平[49]。
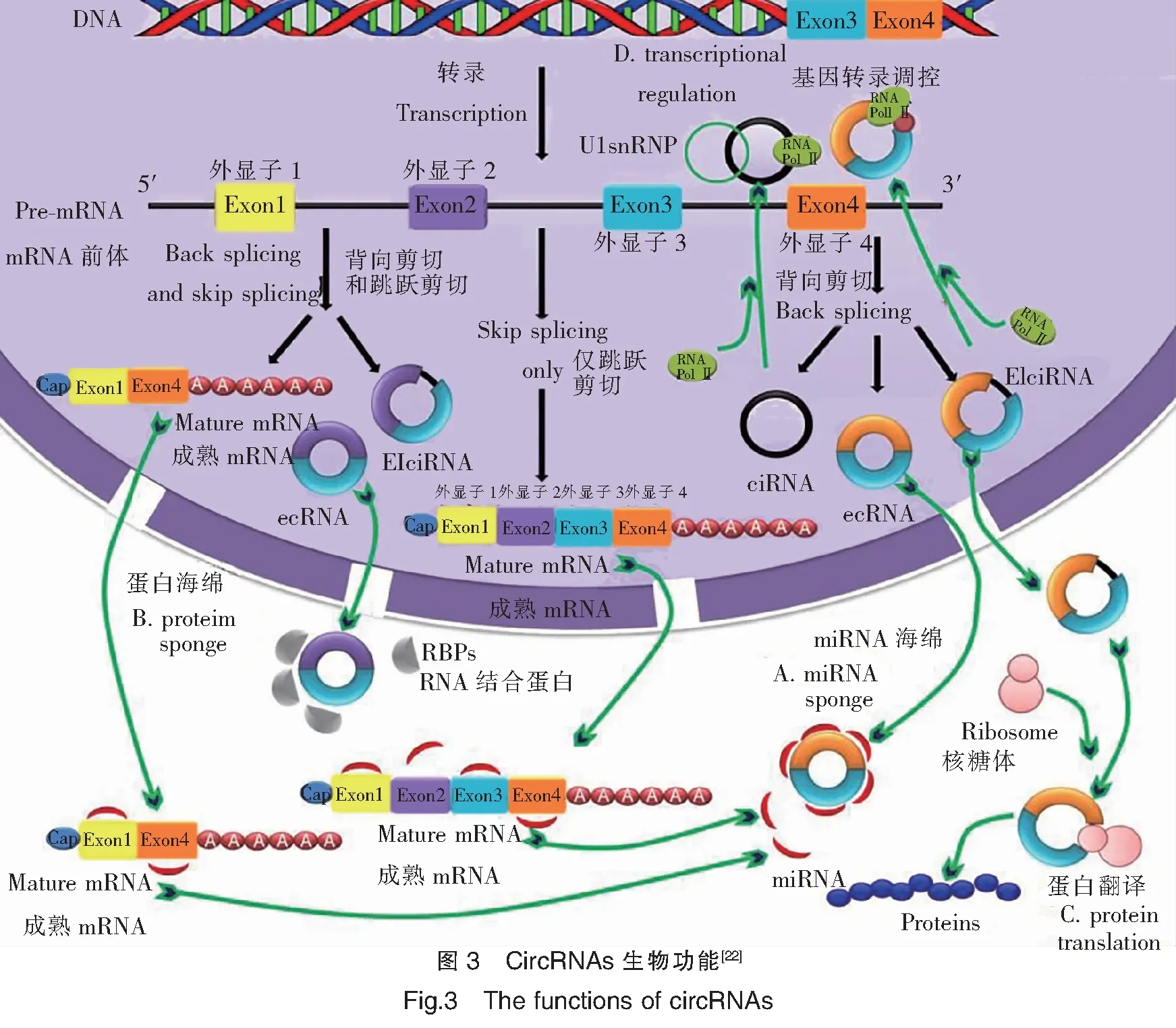
注:A.充當miRNA的分子海綿體; B.充當蛋白的分子海綿;C.蛋白翻譯; D.基因轉錄調控。
4 水產circRNAs研究進展
當前circRNAs 的研究大多數集中在與人類疾病相關方面的醫學領域,尤其是在癌癥研究報道非常多[26,50-51],而在水產領域相關研究較少。隨著對circRNAs深入研究,一些魚類circRNAs也逐漸被發現與鑒定。Nitsche A等利用轉錄組測序技術,首次報道了腔棘魚肌肉可能存在的circRNAs[52]。Shen Y等對斑馬魚(Daniorerio)進行了高通量組織測序,總共鑒定出了3 868個circRNAs,其中發現有1 122個circRNAs在人類、大鼠和腔棘魚中高度保守,表明這些保守的circRNAs在脊椎動物中可能執行相同的生理功能[53]。進一步的靶點分析顯示有29個circRNAs能作為斑馬魚miR-2193的海綿吸附體。隨后有學者也對斑馬魚的五個重要組織包括血液、腦、心臟、鰓和肌肉進行了circRNAs鑒定,又新發現3 428個circRNAs,部分circRNAs通過(Quantitative Real-time PCR,qRT-PCR)得到實驗驗證,發現這些circRNAs都來源于已知注釋的蛋白和lncRNAs[54]。Liu H等對斑馬魚胚胎不同發育時相進行了circRNAs鑒定,共發現了1 029 circRNAs,并在囊胚期、原腸胚、體節期和消化管形成期的不同發育階段都有不同表達水平[55],并對其中隨機選取的23個circRNAs證實了它們的表達水平。研究結果暗示著有一些circRNAs可能與調控斑馬魚胚胎發育的關鍵節點有關。最近,Sun L Y等通過轉錄組測序在斑馬魚中鑒定了3 431與神經視網膜相關的circRNAs[56]。當前,斑馬魚是已被科學界所熟知的重要模式生物,這些發現的circRNAs能為建立斑馬魚與人類疾病模型提供重要研究價值。
此外,在其他魚類中也有circRNAs的研究報道。Xu S等在大黃魚(Larimichthyscrocea)中發現了975個circRNAs,隨機選擇2個circRNAs得到了驗證[57]。靶點預測發現,在鑒定的975個circRNAs中,全部存在有5個以上的miRNAs結合位點;其中的22個circRNAs,發現具有10個以上的miR-430和let-7家族成員結合位點,這些靶點的功能分析還需要進一步實驗證實。最近,Hu X等在鯽魚(Carassiusauratus)腎臟組織中鑒定出了37個circRNAs,靶點預測表明,這些circRNAs作為海綿體能吸附520個miRNAs[58]。而且,通過circRNA-miRNA-mRNA間的互作網絡分析顯示,miRNAs至少能和1個circRNA和1個mRNA組成調控網絡共同發揮作用。circRNAs也與魚類病毒感染相關聯[59]。他們對來自感染GCRV(Grass carp reovirus)第1、3、5、7天草魚(Ctenopharyngodonidella)腎臟組織和未感染的正常組織進行了cricRNAs測序鑒定,總共鑒定了5 052個新的circRNAs,其中有41個cricRNAs在感染病毒前和感染后的草魚腎臟組織中呈現差異表達。進一步功能分析顯示,這些cricRNAs的宿主基因與金屬離子結合,蛋白質泛素化,酶活性和核苷酸結合等生理活動相關。靶點預測顯示,有72個miRNAs能與這些差異表達的circRNAs相結合。該研究結果為將來在草魚中深入研究circRNAs與宿主基因和病原體之間互作機理提供了參考。Fan B等首次從無乳鏈球菌感染的羅非魚(Oreochromisniloticus)腦組織中鑒定了11 263個circRNAs[60]。而且在這些鑒定的環狀分子中,99% circRNAs都存在有miRNAs的結合位點。進一步差異表達分析顯示,有369上調和468下調的circRNAs,對其來源的宿主基因進行KEGG通路分析,結果表明這些基因都與免疫響應有關。
當前在魚類中鑒定的circRNAs,主要集中在對miRNAs海綿作用和網絡調控通路分析,尚無circRNAs功能研究。如何實現其miRNA的海綿機制,未來需要更進一步的功能研究。
5 展望
相比其他的非編碼RNA,circRNAs作為RNA世界的一顆新星,其調控作用也日顯重要,已成為當前生物與醫學領域的研究熱點。近年來的研究發現,circRNAs與疾病的發生有著密切的相關性,尤其是與癌癥相關的疾病,因此,可以作為將來疾病監測、檢測與治療的一種新型生物標記或者應用靶標分子。目前,雖然已有極少部分的circRNAs功能得到闡釋,但仍然有大多數circRNAs功能未知,相關功能研究依然處于初始階段。隨著新一代的高通量測序和生物信息學分析技術快速發展以及circRNAs研究工具和數據庫的不斷完善,不僅會有大量的circRNAs被發現,而且circRNAs作為重要調控因子的面紗也將被逐步揭開。在水產研究方面,目前的研究還是停留在魚類以及病原體感染后組織circRNAs的發掘、驗證和組織表達譜分析,對于circRNA 的功能研究還僅集中在circRNAs宿主基因的功能注釋或miRNA靶點結合網絡預測分析,關鍵的circRNA功能研究還鮮有報道。因此未來還需進一步深入明確circRNAs在魚類基因中的調控作用,加深與魚類經濟性狀和抗病基因的circRNAs篩選、鑒定與功能研究。結果有助于闡明復雜調控網絡機制,更好地為將來水產經濟動物分子育種和品種改良提供理論研究基礎。

