多吡啶類雙核鎳配合物的合成、晶體結構及抗癌活性
喬佩佩 田玥瑋 賀 卿 張永坡 高春艷*, 趙晉忠 杜維俊
(1山西農業大學基礎部,晉中 030801)
(2山西農業大學農學院,晉中 030801)
自從順鉑被發現具有抗腫瘤活性以來,其衍生物如卡鉑、奧沙利鉑、樂鉑等被迅速研發并被廣泛用于治療癌癥,這使得金屬配合物在眾多靶向抗腫瘤藥物中脫穎而出,得到了人們的廣泛關注[1-2]。但隨著臨床應用的不斷深入,人們發現鉑類藥物在帶來抗癌作用的同時伴隨著對身體各種器官的毒副作用,且極易產生耐藥性,這在很大程度上限制了鉑類配合物的生物利用度和臨床應用[3-4]。鉑類抗癌藥的這些缺點促使人們嘗試用其他過渡金屬配合物替代它們[5-7],因此,研發低毒、高效且不易產生耐藥性的新型金屬配合物對于癌癥治療具有重要的理論意義。
過渡金屬鎳作為人、動物、微生物和植物生命過程中一種必需的微量元素,能促進紅細胞再生及造血功能,參與體內多種酶的組成,對人體內的各種生理反應具有重要的調節作用[8-10]。近些年來,有關鎳配合物在生物無機化學研究中的報道逐漸增加,其顯示出多種生物活性,例如抗驚厥、抗真菌、抗微生物、抗氧化以及抗腫瘤活性[11-16]。而多吡啶類配體作為現代配位化學中應用最為廣泛的螯合配體,由于其具有σ給電子能力以及π受電子能力,能夠與多種過渡金屬形成穩定的配合物,因此具有良好的應用前景[17-20]。
據此,我們以含氮多齒吡啶N,N-bis(pyridin-2-ylmethyl)-4-(4-((pyridin-2-ylmethyl)amino)benzyl)aniline(L)作為配體,合成了2個未見文獻報道的多吡啶雙核鎳配合物[Ni2(L)2Cl2](ClO4)2·3H2O(1)和[Ni2(L)2Cl2](PF6)2(2)。利用X射線單晶衍射、紅外光譜以及元素分析確定了該配合物的晶體結構并進行表征。對其作為潛在抗癌藥物的特性進行了研究:2個配合物的體外抗增殖活性通過對4種癌細胞系(HeLa、BGC-823、NCI-H460和HepG-2)的細胞毒性進行研究;此外通過Hoechst 33342染色、細胞內活性氧(ROS)水平檢測、線粒體膜電位測定等技術和方法探究了配合物抗腫瘤活性的作用機制。

Scheme 1 Structure of L
1 實驗部分
1.1 實驗試劑與儀器
RPMI1640培養基、DMEM培養基、胰蛋白酶、胎牛血清、溴化噻唑藍四氮唑(噻唑藍,MTT)、Hoechst 33342染色試劑、DCFH-DA探針、JC-1線粒體膜電位檢測試劑盒均購自索萊寶公司,二甲基亞砜(DMSO)購自阿拉丁公司。其余試劑均為市售分析純試劑。
所用儀器有Perkin-Elmer 240型元素分析儀(C、H、N)、Bruker Smart1000單晶衍射分析儀、酶標分析儀DNM-9602(北京普朗新技術有限公司)、倒置光學顯微鏡DMIL LED(徠卡顯微系統(上海)貿易有限公司)、超凈工作臺SW-CJ-1D(蘇州凈化設備有限公司)、二氧化碳細胞培養箱(Galaxy 170 S New Brunswick)。
1.2 配合物的合成
配體L的合成參見文獻[21]。
配合物1的合成:稱取0.2mmol的配體L溶于15mL無水乙醇中,完全溶解后滴加0.2mmol的三乙胺。然后緩緩滴加Ni(ClO4)2·6H2O(0.2mmol)的水溶液(5m L)至上述溶液中,混合液在室溫攪拌10 h后過濾,濾液在干凈燒杯中靜置。緩慢揮發一段時間后,適合X射線單晶衍射分析的藍綠色塊狀晶體從溶液中析出,過濾,將晶體用少量冷乙醚淋洗,干燥后稱重,產率:35%。元素分析按C62H62Cl4N10Ni2O11計算的理論值(% ):C,53.87;H,4.52;N,10.13。實驗值(% ):C,53.90;H,4.55;N,10.06。FT-IR(KBr,cm-1):3 442,3 269,1 610,1 574,1 513,1 488,1 447,1 219,1 098,1 021,811,625。
配合物2的合成:稱取0.2mmol的配體L溶于15mL無水甲醇中,攪拌并逐滴加入0.2mmol的三乙胺,緩慢加入NiCl2·6H2O(0.2 mmol)的甲醇溶液(10mL),混合液加熱攪拌回流0.5 h后,繼續加入0.2 mmol KPF6,繼續回流3 h,有大量綠色沉淀析出,過濾。將綠色沉淀用5mL乙腈、5mL甲醇、5mLN,N-二甲基甲酰胺和5mL水復溶,過濾,濾液在室溫下靜置10 d后,適合X射線單晶衍射的藍綠色塊狀晶體析出。將晶體過濾并用少量冷乙醚淋洗,干燥后稱重。產率:31%。元素分析按C62H58Cl2F12N10Ni2P2計算的理論值(% ):C,52.39;H,4.11;N,9.85。實驗值(% ):C,52.42;H,4.17;N,9.80。FT-IR(KBr,cm-1):3 270,1 611,1 575,1 514,1 488,1 448,1 218,1 098,932,844,625。
1.3 配合物的晶體結構測定
選取配合物1和2的單晶樣品(尺寸均為0.40 mm×0.25mm×0.20mm)置于Bruker Smart 1000 CCD單晶衍射儀上,在低溫(配合物1)或室溫(配合物2)下,采用經石墨單色化的MoKα輻射作為衍射光源(λ=0.071 073 nm),以φ-ω掃描方式收集衍射點,通過SAINT程序進行數據還原,強度數據經SADABS程序校正[22]。用SHELXS-97程序的直接法解析結構[23-24]。對全部非氫原子坐標及其各向異性熱參數用SHELXL-97程序進行全矩陣最小二乘法修正;氫原子均為理論加氫并進行跨式模型(riding model)精修。配合物1和2的晶體學數據見表1,部分鍵長鍵角數據見表2。
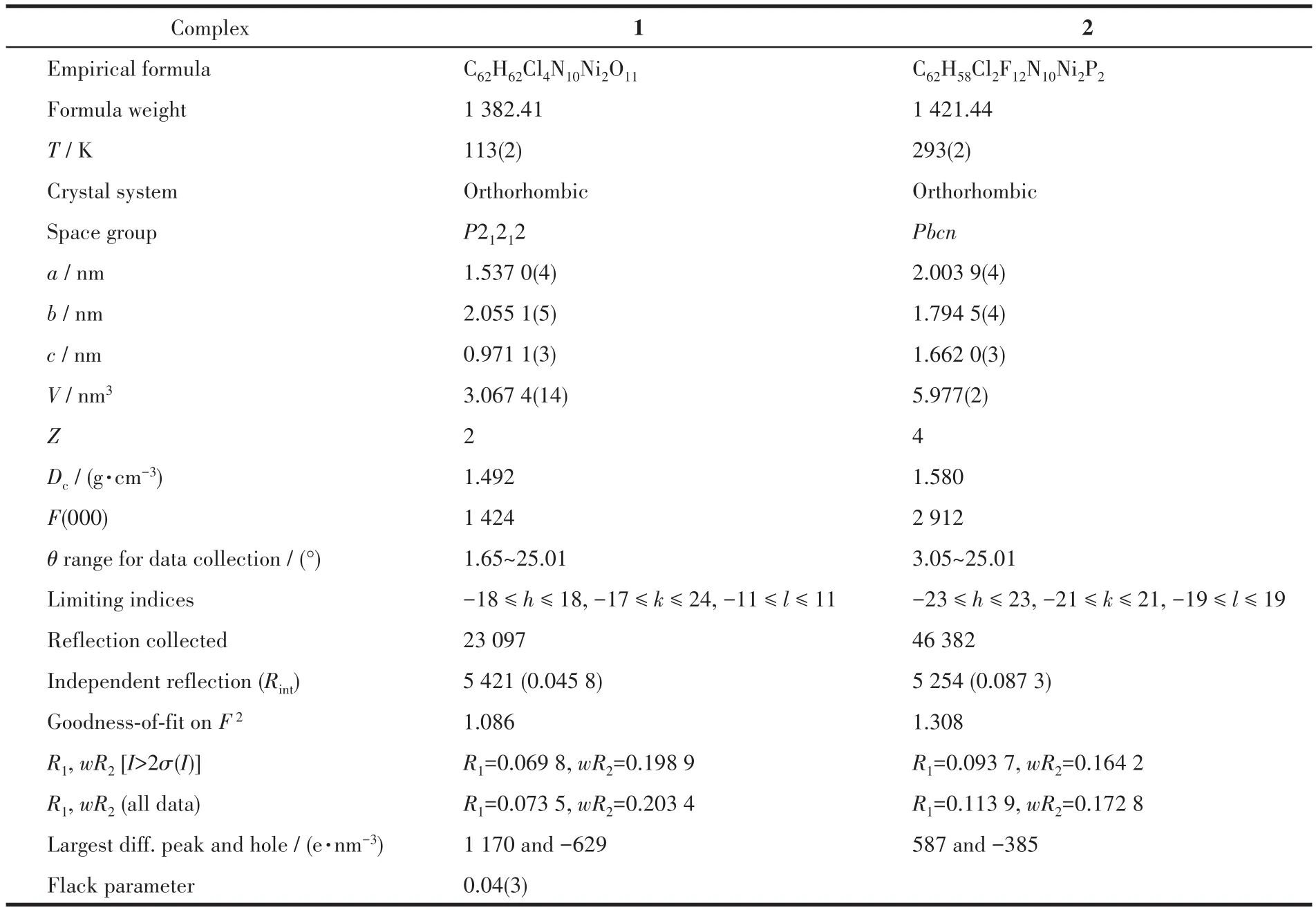
表1 配合物1和2的晶體學數據Table 1 Crystallographic data of Complexes1 and 2

表2 配合物1和2的部分鍵長和鍵角Table 2 Selected bond lengths(nm)and angles(°)of complexes1 and 2

續表2
CCDC:2058250,1;2058251,2。
1.4 配合物的抗癌活性檢測
1.4.1 細胞系及培養條件
人宮頸癌細胞系(HeLa)、人胃癌細胞系(BGC-823)、人肺癌細胞系(NCI-H460)、人肝癌細胞系(HepG-2)由天津醫科大學科研平臺提供。HeLa細胞用含10% 胎牛血清的DMEM(H)高糖培養基培養,其它細胞用含10% 胎牛血清的RPMI 1640培養基培養。
1.4.2 細胞毒性檢測
采用MTT法來評估2個配合物的體外抗腫瘤活性。將細胞接種于 96孔(每孔3×103~5×103個)細胞培養板中,置于培養箱(37℃,體積分數5% 的CO2)中孵育24h。除去舊的培養基,換入新鮮培養基,設定空白組、對照組(未加配合物組)、加藥組(配合物終濃度分別為 3.125、6.25、12.5、25、50、100、200 μmol·L-1),分別加入相對應的藥物后繼續孵育48 h,然后每孔中加入20μLMTT(5mg·mL-1)繼續孵育4 h。取出培養板并吸出上清液,每孔加入150μLDMSO,振蕩10min后使用酶標儀對其吸光度進行檢測,并計算IC50值。
1.4.3 Hoechst 33342染色
Hoechst 33342是一種可對DNA染色的細胞核染色試劑,常用于細胞凋亡形態學檢測,從而證明化合物是否通過誘導凋亡的方式來殺死腫瘤細胞[25]。取對數期且生長狀態良好的NCI-H460細胞接種于 12 孔板(每孔 3×104~5×104個),置于培養箱(37℃,體積分數5% 的CO2)中孵育24h。分別加入一定濃度的配合物1于12孔板中,并設置相應對照組,置于培養箱中繼續孵育24 h,吸去培養基并用冰冷的磷酸鹽緩沖鹽溶液(PBS)清洗2~3次,每次3 min,加入Hoechst 33342(10 μg·L-1)染液,置于培養箱中避光孵育15min,棄去染液并用PBS清洗2~3次,每次3min,置于熒光倒置顯微鏡選取合適的視野進行觀察并拍照。
1.4.4 ROS水平檢測
ROS的產生和堆積是細胞凋亡中的重要事件,因此細胞生長過程中ROS的產生可以作為檢測細胞早期凋亡的重要特征之一。我們利用凋亡細胞內產生的活性氧可以將沒有熒光的DCFH氧化生成具有綠色熒光的DCF這一特征來檢測細胞內活性氧水平[26]。取處于對數期且生長狀態良好的NCIH460 細胞接種于 12孔板(每孔 3×104~5×104個)中,置于培養箱(37℃,體積分數5% 的CO2)中孵育24 h。在細胞中加入不同濃度的配合物1繼續孵育24 h,吸出上清液,將用無血清培養基稀釋的DCFH-DA探針(10μmol·L-1)加入孔板中,置于培養箱中避光染色30min,取出后用PBS洗滌3次,每次3min,然后置于熒光倒置顯微鏡下進行觀察,選取合適的視野并拍照。
1.4.5 線粒體膜電位檢測
誘導細胞凋亡過程通常分為內源性(線粒體)、外源性(死亡受體)和內質網應激啟動3條通路,其中線粒體通路最為常見。大量研究表明在凋亡過程中一旦線粒體膜電位下降,則細胞將會發生不可逆轉的凋亡[27-28]。采用JC-1線粒體膜電位檢測試劑盒對線粒體膜電位進行檢測,通過紅綠熒光的變化來判斷細胞是否發生凋亡。其基本步驟為取對數期且生長狀態良好的NCI-H460細胞接種于12孔板(每孔3×104~5×104個)中,置于培養箱(37 ℃,體積分數5% 的CO2)中孵育24 h,在細胞中加入不同濃度的配合物1繼續孵育24 h,按照試劑盒步驟進行操作。
2 結果與討論
2.1 配合物的結構及其表征
對2個配合物進行表征發現,配合物1屬于正交晶系,P21212手性空間群,Flack因子為0.04(3)。晶體解析結果表明,1的每個Ni中心均為六配位模式,該雙核配合物由2個不對稱的L形成雙鏈螺旋分子盒狀,其基本單元是由1個[Ni2(L)2Cl2]2+與外界的2個ClO4-和3個水分子構成。而配合物2與1的配位模式相同,結構相似,兩者主要區別在于外界陰離子、配位原子與中心原子之間的空間排列不同以及空間群不同,2為非手性的Pbcn,晶體2也屬于正交晶系,其基本單元是由1個[Ni2(L)2Cl2]2+和外界的2個PF6-構成。2個配合物的結構如圖1所示。
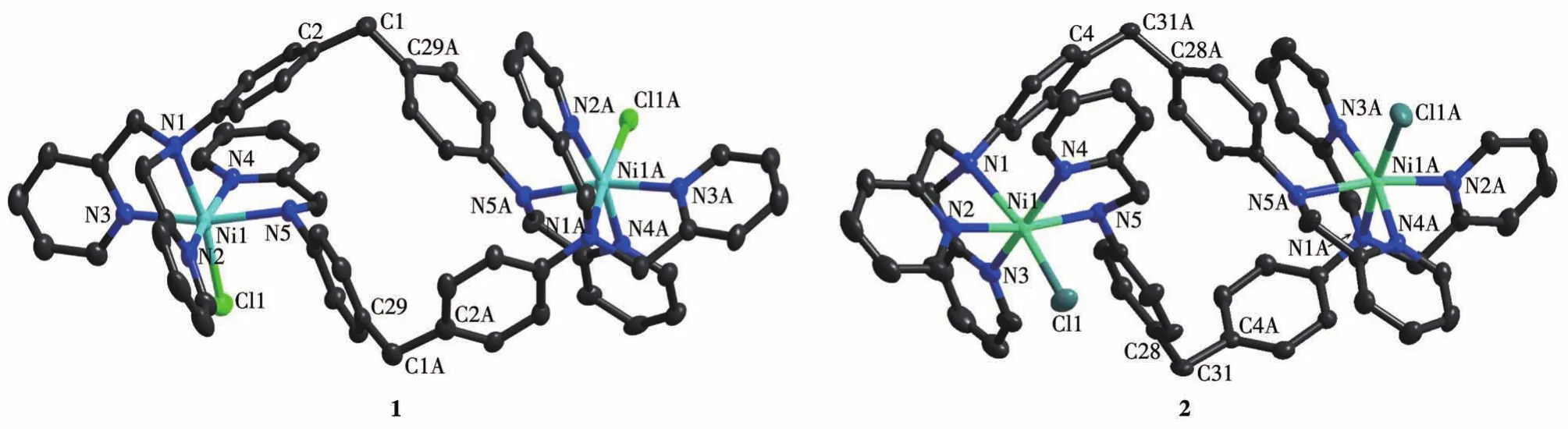
圖1 配合物1和2的晶體結構Fig.1 Crystal structures of complexes1 and 2
由圖1可見,1和2的Ni中心的配位原子由一個L的叔胺N原子、2個吡啶N原子及另一個L中的1個仲胺N原子、1個吡啶N原子和1個Cl原子組成,因此其構型可描述為畸變的八面體。L的二苯基甲烷基團中的—CH2—是柔性的,在配合物1中C2—C1—C29A的鍵角為110.6(5)°,Ni1和Ni1A之間的距離為 1.052 5 nm;而配合物2中C28—C31—C4A的鍵角為109.8(4)°,Ni1和Ni1A之間的距離為0.997 1 nm。
2.2 細胞毒性實驗
以順鉑作為陽性對照,對2個化合物進行體外抗腫瘤活性檢測(表3)。實驗結果表明,2個鎳配合物對幾種腫瘤細胞的毒性均高于配體,這說明配體與Ni2+的配位明顯增強了配體原有的抗癌活性。在2個配合物中,配合物1對腫瘤細胞表現出更高的毒性作用,其中對NCI-H460毒性作用最強,IC50=(26.0±2.2)μmol·L-1,因此我們選擇配合物1對NCIH460細胞的抗腫瘤作用進行進一步研究。

表3 配合物1和2及配體L對測試細胞系的IC50值Table 3 IC50values of complexes1,2 and ligand L toward the tested cell lines
2.3 凋亡形態檢測
利用Hoechst 33342染色法檢測了配合物1對NCI-H460細胞形態學改變,結果如圖2所示。可以看到,對照組細胞呈淺藍色或者沒有顏色;陽性對照組(順鉑)細胞染色加深、變亮,而且出現皺縮;而加藥組的細胞隨著濃度增大,細胞呈現明亮的深藍色,并伴隨著一定的皺縮,在高濃度組中細胞皺縮明顯增多。由此可以判定,配合物是以誘導細胞凋亡的方式[23]對NCI-H460細胞產生毒性作用,且具有一定的濃度依賴性。

圖2 Hoechst 33342染色法檢測配合物1對NCI-H460細胞形態的影響Fig.2 Effect of complex 1 on morphology of NCI-H460 cells determined by Hoechst 33342 staining method
2.4 ROS檢測
如圖3所示,在對照組中,由于低的ROS水平,DCHF-DA難以轉變成具有綠色熒光的DCF,因此觀察到微弱的綠色熒光斑點;當把NCI-H460細胞暴露于不同濃度的配合物1中孵育24 h后,DCHF-DA在高水平的ROS下被轉變成具有綠色熒光的DCF,因此在熒光顯微鏡下發現許多明亮的綠色斑點,且具有一定的濃度依賴性。該結果表明,配合物1通過提高細胞內的活性氧水平來誘導細胞凋亡[26]。

圖3 DCFH-DA探針染色法測定配合物1對NCI-H460細胞內ROS產生的影響Fig.3 Effect of complex 1 on ROS production in NCI-H460 cells determined by DCFH-DA probe staining method
2.5 線粒體膜電位檢測
以上2個實驗結果表明,配合物1可能通過誘導細胞凋亡的途徑來對腫瘤細胞產生致死作用,因此我們采用一種新型陽離子羰花青染料(JC-1)作為熒光探針測定了線粒體膜電位的變化。結果如圖4所示,對照組NCI-H460細胞由于高的膜電位所以呈現紅色熒光,但隨著配合物1的加入,其紅色熒光逐漸減弱,綠色熒光逐漸增強。從紅色到綠色熒光的變化表明配合物1的加入導致NCI-H460細胞線粒體膜電位降低,且具有明顯的濃度依賴性,據此推測該配合物很可能是通過線粒體途徑誘導細胞凋亡[27-28]。

圖4 JC-1探針染色法檢測配合物1對NCI-H460細胞內線粒體膜電位的影響Fig.4 Effect of complex 1 on mitochondrial membrane potential of NCI-H460 cells determined by JC-1 probe staining method
3 結 論
合成了2個未見文獻報道的雙核鎳(Ⅱ)配合物[Ni2(L)2Cl2](ClO4)2·3H2O(1)和[Ni2(L)2Cl2](PF6)2(2)并對其進行表征。MTT實驗表明配合物1和2對體外腫瘤細胞HeLa、BGC-823、NCI-H460及HepG-2均具有一定的細胞毒性,其中對于NCI-H460細胞毒性作用最強。進一步探究了配合物1對NCI-H460細胞的毒性作用機制,結果表明,隨著配合物1濃度的遞增,細胞內活性氧平衡遭到破壞,線粒體膜電位逐漸耗竭,說明該配合物很可能通過線粒體途徑來誘導細胞凋亡從而對癌細胞產生致死作用。
- 無機化學學報的其它文章
- Synthesis,Structures and Catalytic Activity in Knoevenagel Condensation Reaction of Cu(Ⅱ)/Co(Ⅱ)/Ni(Ⅱ) Coordination Polymers Based on Ether-Bridged Tetracarboxylic Acid
- Synthesis and Luminescence Properties of Double Perovskite Ca2Gd1-xTaO6∶xTb3+Green Phosphors
- Carbonized MoS2/S-Doped g-C3N4Heterojunction:Synthesis and Catalytic Degradation Mechanism of Rhodamine B under Visible Light
- I-Assisted Synthesis Erythrocyte-like Bi2WO6with Excellent Adsorption and Photocatalytic Activity
- Preparation of Li2Ni2(MoO4)3@C Composite as High-Performance Anode Material for Lithium-Ion Batteries with High Initial Coulombic Efficiency
- 單分散共價有機框架納米顆粒的室溫快速制備

