丙泊酚通過影響SIRT2調控線粒體自噬對酒精性肝損傷的保護作用
宣文婷,盧昕奕,李 俊
(1. 南京大學醫學院附屬鼓樓醫院麻醉科,江蘇 南京 210008;2.安徽醫科大學藥學院,安徽 合肥 230032)
酒精性肝病(alcoholic liver disease,ALD)是全球范圍內常見的肝臟疾病,任何程度的飲酒均會對肝臟造成損傷,輕度多無癥狀,中重度可呈現類似慢性肝炎的表現。長期發展下去,可逐漸由脂肪型肝炎演變為肝纖維化、肝硬化甚至是肝癌[1]。目前對ALD的可選的治療方法很有限,主要包括調脂、抗氧化、抗纖維化等,一旦疾病進展到肝硬化階段,有效的治療方案往往只有肝移植,但由于肝移植的供體緊缺,極大地限制了肝移植的進展。因此,如能及時的抑制肝臟的損傷,會極大地減緩疾病的惡化情況以及為患者進行治療而爭取極為寶貴的時間。
丙泊酚(propofol, Prop)是臨床上常用的靜脈麻醉鎮靜藥物,具有誘導快,患者恢復快的顯著優點,在手術室和ICU得到了廣泛的應用。有證據指出,Prop不僅具有良好的麻醉效果,還具有很多非麻醉效應。適量的Prop能夠顯著緩解因為外傷所導致的腦損傷。這是因為Prop能夠顯著地調節神經元細胞的細胞周期,使大部分細胞免于過量凋亡[2]。除此之外,Prop具有免疫調節作用,這可能與在多種腫瘤細胞中增強T細胞活性有關[3]。不僅如此,在大鼠原代心肌細胞的心肌缺血/再灌注模型中,Prop激活MAPK/ERK通路抑制凋亡發揮心肌保護作用[4]。在肝臟中,Prop能夠通過維護線粒體膜電位及線粒體呼吸鏈來減緩缺血/再灌注損傷[5]。
線粒體自噬(mitophagy)是自噬的一種選擇性形式,受損或功能障礙的線粒體被溶酶體吞噬后,形成自噬小體從而降解。肝細胞線粒體自噬是一種對線粒質量的控制機制,它可以清除在溶酶體消化過程中受損的、衰老和多余的線粒體,對酒精性肝損傷和脂肪肝起到保護作用。線粒體自噬還能通過維持正常數目的線粒體的β氧化的能力來阻止肝臟脂質堆積[6]。值得注意的是,在本課題組前期實驗中已經證實酒精性肝損傷中的線粒體自噬水平略有提升,這是基于機體的自我保護,大幅度增強線粒體自噬水平是可以扭轉酒精對肝臟的損傷[7]。有文獻報道,Prop可以誘發骨骼肌的自噬[8],但Prop在酒精性肝損傷中對自噬進程的影響的尚不明確。
SIRT2是廣泛存在于原核和真核生物的一類蛋白質去乙酰化酶,在哺乳動物中,有7種SIRT蛋白,分別是SIRT1-7,存在于不同的亞細胞定位并且具有不同的功能,在代謝應激、控制和限制能量、癌癥的進展等中有著重要的作用。SIRT2蛋白最初來自于酵母細胞老化的研究,研究發現SIRT2額外拷貝增加了50%的壽命,而SIRT2的缺失縮短了壽命[9]。在酵母中,SIRT2通過抑制染色體外有毒的環狀rDNA的生成來延長生命。在肝臟中,激活NAD+/SIRT2通路可以抑制NLRP3炎癥小體復合,減輕非酒精性肝損傷[10]。但是,在酒精性肝損傷中,SIRT2發揮著何種作用,尚無相關研究。因此,本研究通過高斌模型法建立小鼠酒精性肝損傷模型,腹腔注射Prop,探討Prop在小鼠酒精性肝損傷中發揮的作用及相關機制。
1 材料與方法
1.1 材料
1.1.1實驗動物 本實驗選用雄性C57BL/6J小鼠,8周齡,體質量約23 g,購自安徽醫科大學動物實驗中心,實驗動物合格號:SCXK(皖)2017-001。
1.1.2藥物與試劑 丙泊酚(批號:P-076)購自美國Sigma公司;SirReal購于美國Selleck公司;胎牛血清,購自美國Lonsera公司;0.25%胰酶消化液購自Gibco公司;DMEM/F-12細胞培養液購自美國Hyclone公司;標準型Lieber-DeCarli液體飼料購自特洛菲生物科技公司;ALT試劑盒,購自江蘇建成生物工程研究所;伊紅蘇木素染色試劑盒(hematoxylin-eosin staining,HE)購自北京碧云天公司;SIRT2(批號:ab211033)、TOM20(批號:ab186735)、LC3B(批號:ab192890)抗體購自英國Abcam公司,β-actin(批號:bsm-33036m)購自中國Bioss公司。ECL發光試劑盒購自美國Thermo公司。
1.2 方法
1.2.1動物模型構建 本實驗采用美國國立衛生研究院酒精濫用研究中心推薦的酒精性肝損傷模型。先給與小鼠5 d液體飲食適應,再給與10 d含酒精液體飼料喂養,最后1 d給與5 g·kg-120%的酒精灌胃。模型組的小鼠給予酒精含量為5%的液體飲食。Prop處理組小鼠預先2 d給予1、2、3 mg·kg-1Prop腹腔注射。SIRT2抑制劑處理組小鼠預先兩天給予 25、50 mg·kg-1SirReal2腹腔注射。對照組給與等量的液體飼料,最后1日灌胃予以麥芽糊精。
1.2.2HE染色 本實驗使用冰凍切片進行HE染色,使用4%的多聚甲醛固定小鼠肝臟,室溫干燥30 min后使用PBS溶液浸泡5 min,再蘇木精溶液浸泡5 min,流水沖洗去蘇木精染料,1%鹽酸乙醇浸泡數秒分色,分別使用20%、25%、50%、75%及無水酒精浸泡2 min,脫去肝臟中的水分,置于伊紅染料中浸泡2 min,沖洗后再經過兩次的二甲苯溶液進行透明化處理。在染色完畢后,應用中性樹膠蓋住切片,再加以蓋玻片封片。
1.2.3油紅O染色 將組織標本置于冰凍包埋劑中包埋,使用冰凍切片機將組織切成厚度為10 μm的切片。在多聚甲醛溶液中浸泡15 min以減少氧化,置于異丙醇溶液中浸泡5 min后,油紅O染料孵育10 min,洗凈切片后進行蘇木素復染,最后使用甘油明膠封片處理。
1.2.4Western blot實驗 造模成功的小鼠肝臟置于-80 ℃冰箱保存備用,取200 mg小鼠肝臟組織放入研磨器,加入1 mL RIPA裂解液,置于冰上研磨15 min。研磨后,2 000 r·min-1,離心15 min,棄去沉淀,取上清液加入SDS-PAGE,體積比例為4 ∶1,置于煮沸的水中,水浴15 min。取總量約為35 μg的總蛋白樣品加入SDS-PAGE凝膠中進行電泳,隨后使用三明治轉膜方法,電壓100 V,100 min,置于冰水浴,以濕法轉膜方式將目的蛋白轉至PVDF膜上。轉膜完成后,將PVDF膜放在5% 脫脂牛奶常溫封閉2 h,TBS洗滌3遍后,放置于已稀釋的一抗中,4 ℃孵育過夜。第二日,TBS洗滌3遍后,將入稀釋后的二抗室溫孵育1 h,隨后使用ECL發光試劑盒進行顯影。
1.2.5免疫熒光和免疫組化 免疫熒光:將儲存于-80 ℃的小鼠肝臟組織冰凍切片,常溫晾干15 min,再使用PBS浸泡10 min,再經10%山羊血清室溫封閉1 h,一抗(TOM20 1 ∶200;LC3 1 ∶200)4 ℃孵育過夜后。次日,PBS洗滌3次,每次5 min,二抗(1 ∶400)室溫避光孵育1 h,PBS洗滌3次后,加入含有DAPI染色劑封片劑封片。在熒光顯微鏡下比較不同組的熒光強度。免疫組化:取出冰凍切片,室溫放置5 min,用冷丙酮固定15 min后,PBS沖洗3次。0.1% Triton X-100浸泡10 min,PBS洗滌3次,再置于3% H2O2溶液避光浸泡20 min,PBS洗滌3次,將組織切片置于10%山羊血清室溫封閉1 h。吸取封閉液,小心滴加一抗(SIRT2 1 ∶200)置于4 ℃冰箱孵育過夜。次日,PBS洗滌3遍,每遍5 min,然后置于二抗室溫孵育1 h,PBS洗滌3次,每次5 min,使用DAB顯色,自來水沖洗終止后,蘇木精復染30 s,再使用自來水沖洗15 min返藍。最后二甲苯透明化5 min后,使用中性樹膠封片,置于光學顯微鏡下分析。
1.2.6分子靶向對接 此次試驗采用兩種方法預測。方法一,通過STITCH網站在線分析,對Prop進行配體預測,得到了迄今為止在公共數據庫中,Prop的配體信息,分數>0.8即有意義。方法二,通過靶向研究金標準Discovery studio分子模擬分子試驗。
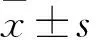
2 結果
2.1 丙泊酚抑制酒精誘導的肝損傷通過血清學中的ALT和AST檢測實驗(Fig 1A)結果發現,相對于對照組小鼠,模型組ALT、AST水平明顯上升(P<0.01)。進一步的實驗結果指出2 mg·kg-1的Prop即顯著降低酒精引起的ALT、AST上升(P<0.01)(Fig 1B)。如Fig 1C所示,通過HE染色發現,相較于對照組,模型組小鼠肝臟中脂肪空泡明顯增多(P<0.01),而Prop組(2 mg·kg-1)相較于模型組,脂肪空泡數量明顯減少(P<0.05)。由油紅O染色可知(Fig 1D),相比于對照組,模型組小鼠肝臟中脂質沉積明顯增加(P<0.05)。Prop處理組相較于酒精性肝損傷組,小鼠肝臟中脂肪沉積明顯減輕(P<0.01)。

2.2 丙泊酚顯著增強小鼠肝臟線粒體自噬水平通過免疫熒光對LC3和線粒體標記物TOM20進行共定位分析(Fig 2A),結果發現相較于對照組,在模型組中,小鼠肝臟中的LC3向線粒體募集(肝臟中的黃色信號點增多),提示線粒體自噬水平有所提升(P<0.05)。而對模型組小鼠進行Prop的處理后,結果發現LC3顯著地向線粒體轉移(P<0.01)。同時通過對各組小鼠血清中的mtDNA進行檢測(Fig 2B),結果發現,相較于對照組,模型組小鼠血清中mtDNA水平明顯升高(P<0.01),而Prop組能夠明顯降低酒精誘導的高mtDNA水平(Fig 2B)。同時Western blot實驗也證明酒精能夠略微上調LC3 II的表達水平,而Prop能夠明顯活化肝臟中的LC3蛋白(Fig 2C)。以上的實驗表明,Prop能夠明顯增高線粒體自噬水平來減緩酒精導致的線粒體損傷。

Fig 2 Mitophagy level in mouse liver enhanced by n=3)
2.3 丙泊酚靶向結合SIRT2蛋白通過STITCH網站預測Prop的受體,發現SIRT2蛋白可與Prop結合,且進一步分析中發現SIRT2蛋白與Prop有較高的結合分數(Fig 3A)。然后我們使用了藥物模擬對接試驗研究金標準進行研究,結果發現,SIRT2蛋白內側存在Prop的結合域(Fig 3B)。以上兩種方法提示Prop可以與SIRT2蛋白相結合。在Western blot實驗中,發現模型組中SIRT2蛋白水平下降(P<0.05),而在給予Prop處理后,其蛋白水平明顯上升(Fig 3C)。近一步的免疫組化實驗也表明,Prop能明顯上調酒精導致的SIRT2蛋白低水平(Fig 3D)。以上的實驗表明,Prop可能通過SIRT2蛋白來發揮肝臟保護作用。

Fig 3 SIRT2 protein specifically binding with propofol n=3)
2.4 SIRT2抑制劑減弱丙泊酚保護作用通過ALT和AST實驗,發現Prop可以明顯抑制肝臟損傷,而20 mg·kg-1的SIRT2抑制劑(SirReal2)即可顯著抑制Prop的保護作用(Fig 4A)。在毒性檢測實驗中發現50 mg·kg-1的SirReal2不會對正常小鼠的肝臟造成損傷(Fig 4B)。HE染色結果也表明SirReal2(20 mg·kg-1)即可以明顯抑制Prop的保護作用(Fig 4C)。同時Western blot實驗結果也表明,SirReal2能夠明顯抑制Prop對于LC3的活化作用(Fig 4D)。以上的實驗表明SIRT2蛋白是參與肝臟保護作用的關鍵因子,介導Prop對于線粒體自噬的調控。

3 討論
酒精性肝損傷是各種急性和慢性肝損傷的重要誘因,它是一個復雜的病理損傷過程,包括從肝臟脂肪化到肝硬化。之前對酒精性肝損傷病理機制研究主要集中細胞損傷、炎癥、氧化應激、細菌移位等。自噬是近年來研究的熱點,可分為巨自噬和微自噬,線粒體自噬是微自噬的一種,Youle等[11]的團隊發現由Park3基因編碼的Parkin蛋白和E3泛素連接酶(E3 ubiquitin ligase)通過促進自噬體吞噬喪失電子的線粒體從而清除功能障礙的線粒體。本課題組前期已經證實線粒體自噬在酒精性肝損傷中發揮保護作用,并且可將促進線粒體自噬當做靶點作為酒精性肝損傷未來的一項治療策略[7]。Prop在內毒素引起的急性肝損傷中,可通過調節TLR4/NF-κB/NLRP3通路降低炎癥和凋亡發揮保護作用。不僅如此,Prop還通過下調TLR4/NF-κ b介導的iNOS和IL-6基因表達抑制膿毒癥大鼠肝臟亞硝化和炎癥反應發揮保護作用[12]。本實驗采用高斌造模法在C57小鼠上構建酒精性肝損傷模型,通過腹腔注射Prop,發現Prop可以明顯改善酒精引起的肝損傷,并發現線粒體自噬參與了這一過程,并發揮巨大的作用。
不僅如此,我們還通過分子靶向對接技術,分析發現了SIRT2蛋白與Prop有較高的結合分數,并且在SIRT2蛋白內側存在Prop結合域。我們通過蛋白質Western blot和免疫組化實驗,證明在小鼠酒精性肝損傷模型中,相較于對照組,SIRT2蛋白水平顯著下降,肝臟出現些許的線粒體自噬水平上升(基于生理保護機制)。經Prop處理后,SIRT2蛋白水平和線粒體自噬水平相較于模型組發生了明顯的上升。這一系列的結果提示,酒精可能影響小鼠肝臟SIRT2蛋白水平,而SIRT2是參與線粒體自噬的關鍵分子,Prop可以顯著上調SIRT2蛋白水平,從而在酒精性肝損傷中發揮保護作用。為了證實這個結果,我們使用了SirReal2(特異性SIRT2蛋白抑制劑),發現在小鼠酒精性肝損傷模型中,SirReal2減弱Prop引起的線粒體自噬的增強和ALT水平的下降。
SIRT2是NAD+(Nicotinamide adenine dinucleotide,煙酰胺腺嘌呤二核苷酸)依賴的脫乙酰酶,它相較于其他SIRT家族成員目前研究較少。之前對SIRT2蛋白的研究主要集中在神經系統疾病和腫瘤中[13-14],我們首次發現在酒精性肝損傷中,SIRT2也發揮著重要作用,它通過上調自噬水平在酒精性肝損傷中發揮保護作用。Liu等[15]發現在SIRT2缺陷型小鼠中,自噬或線粒體自噬受損,這與我們的研究相一致。
綜上所述,Prop在小鼠酒精性肝損傷模型中發揮肝臟保護作用,其作用機制與調控SIRT2水平,促進線粒體自噬有關。酒精性肝病的患者在臨床上非常常見,Prop作為臨床上常用的靜脈麻醉藥物,在手術室內外發揮重要作用。本實驗為酒精性肝病患者臨床麻醉的藥物選擇提供了新的用藥參考。