沉默STC2對人結腸癌SW480細胞肝轉移裸鼠模型的影響及作用機制研究
李乾元 周秀扣 方征宇 潘志蕓
結直腸癌(CRC)是全球常見的惡性腫瘤[1]。近年來,隨著人們生活方式及飲食結構的變化,CRC的發病率呈持續升高趨勢。目前臨床上對CRC患者通常采用外科手術治療,但研究顯示有40%~50%的CRC患者在術后出現局部復發或遠處轉移,最終導致死亡[2-3]。CRC肝轉移是影響患者預后的主要因素,然而肝轉移的潛在機制尚未完全明確。因此,臨床亟需探尋新的CRC遠處轉移的分子標志物和治療策略。斯鈣素2(STC2)是一種分泌型糖蛋白激素,其以自分泌或旁分泌的方式在多種組織和器官中表達并發揮生物學作用[4]。研究表明,CRC組織中STC2較正常組織顯著升高,STC2高表達患者的總體生存期較短,并且STC2高表達與CRC患者的淋巴結轉移、遠處轉移、晚期臨床分期顯著相關[5]。此外,上皮間質轉化(EMT)與腫瘤遠處轉移有著密切聯系,EMT的發生會加快CRC進展。Wnt/β-連環蛋白(β-catenin)信號通路可通過影響腫瘤細胞的增殖、分化及凋亡,參與CRC的發生、發展。本研究基于Wnt/β-catenin信號通路,探討了沉默STC2對人結腸癌SW480細胞肝轉移裸鼠模型的影響及作用機制,以期為臨床尋找新的CRC遠處轉移的分子標志物和治療策略提供思路。
1 材料與方法
1.1 材料
1.1.1 細胞株與動物 人結腸癌細胞株SW480購自美國典型培養物保藏中心(ATCC)。SPF級BALB/c雄性裸鼠共30只(6~8周齡,體質量16~20 g),購自上海市西普爾-必凱實驗動物有限公司,于SPF級實驗室中飼養,濕度、溫度適宜。本研究動物實驗獲得醫院動物倫理委員會批準,同時遵循中國動物護理和機構倫理指導方針。
1.1.2 主要試劑與儀器 (1)實驗材料:H-E染色試劑盒購自上海信帆生物科技有限公司;蛋白提取試劑盒購自武漢純度生物科技有限公司;BCA蛋白濃度測定試劑盒購自上海烜雅生物科技有限公司;反轉錄試劑盒購自美國賽默飛世爾科技有限公司;脂質體lipofectamine 2000試劑盒購自北京伊塔生物科技有限公司;一抗[STC2、波形蛋白(Vimentin)、基質金屬蛋白酶-9(MMP-9)、T細胞因子4(TCF-4)、C-myc、細胞周期蛋白D1(Cyclin D1)、GAPDH]和二抗(羊抗鼠、羊抗兔)均購自美國Abcam公司;一抗[E-鈣黏蛋白(E-cadherin)、β-catenin]購自美國CST公司;(2)實驗儀器:1855195-OG型定量PCR儀購自美國Biorad公司;DYCZ-20E型電泳設備購自北京六一生物科技有限公司。
1.3 方法
1.3.1 細胞培養和傳代 將SW480細胞置于含10%胎牛血清、青霉素/鏈霉素雙抗RPMI-1640培養基中,并于37 ℃、5% CO2培養箱中貼壁培養。按1︰2.5的比例隔天傳代。待培養基細胞密度達80%,用吸管抽吸培養基中舊培養液,用PBS沖洗一遍,加入少量乙二胺四乙酸(EDTA)與胰蛋白酶的混合液,輕輕旋轉培養瓶,使液體能覆蓋整個細胞面為宜。在顯微鏡下觀察,當細胞間隙增大、細胞質回縮時吸出消化液,加入新的培養液,用移液管輕輕吹打培養基形成單細胞懸液。在顯微鏡下采用計數板計數后,取2.5 mL細胞懸液接種至新的培養基中,輕輕旋轉培養瓶,使細胞在培養基中均勻分布,置于37 ℃、5% CO2培養箱中貼壁培養。
1.3.2 慢病毒載體介導的基因沉默 pLL3.7載體購自上海柯雷生物科技有限公司,設計針對STC2的RNA干擾序列shRNA,并構建pLL3.7-shSTC2質粒,根據脂質體lipofectamine 2000試劑盒說明書進行細胞轉染,構建pLL3.7-shSTC2細胞,記為pLL3.7-shSTC2組。將以陰性病毒載體(pLL3.7-NC)轉染的SW480細胞作為陰性對照,記為pLL3.7-NC組。將僅以轉染試劑處理的SW480細胞作為空白對照,記為pLL3.7-Con組。
1.3.3 構建結腸癌肝轉移動物模型 SPF級雄性BALB/c裸鼠共30只,隨機分為pLL3.7-STC2組、pLL3.7-NC組和pLL3.7-Con組,每組各10只。3組分別于脾下緩慢注射2.5×107/mL的SW480細胞懸液,待注射部位腫脹、發白后拔針,并立即用棉球按壓止血,保留脾臟建立結腸癌肝轉移動物模型。常規飼養并定期觀察裸鼠的精神活動狀態、體質量變化,3周后頸椎脫臼處死裸鼠。各組裸鼠處死后剖腹,觀察記錄肝轉移瘤數量、直徑及肝臟質量,留取各組肝轉移瘤組織以備后續實驗使用。
1.3.4 H-E染色觀察 取肝轉移瘤組織塊,用10%甲醛固定,常規脫水、透明、包埋、切片、脫蠟、水化,經H-E染色,中性樹膠封片,在100倍顯微鏡下觀察病理變化,實驗重復3次。
1.3.5 RT-PCR法檢測 取各組肝轉移瘤組織,加入1 mL TRIzol試劑提取總RNA,采用紫外分光光度計檢測其濃度,并用TaKaRa反轉錄試劑盒行反轉錄合成cDNA,反應模式:預變性95 ℃ 10 min,變性95 ℃ 10 s,退火60 ℃ 10 s,共40個循環。采用2-ΔΔCT法計算各基因相對表達量,以GAPDH為內參,引物序列見表1。

表1 引物序列
1.3.6 蛋白質印跡法檢測 取組織及細胞,采用蛋白質提取試劑盒提取總蛋白,并根據BCA蛋白水平測定各種蛋白水平,取20 μL樣品上樣至SDS-PAGE凝膠泳道上進行電泳,并轉移至PVDF膜上,封閉,加入一抗(STC2、Vimentin、MMP-9、TCF-4、C-myc、Cyclin D1、GAPDH、E-cadherin及β-catenin),4 ℃孵育過夜,用TBST漂洗3次(10 min/次)。加入二抗(羊抗兔IgG、羊抗鼠IgG),用TBST漂洗3次(10 min/次)。采用ECL化學發光法進行圖像顯影,以GAPDH為內參,應用ImageJ軟件進行分析。
1.3.7 免疫組織化學法觀察 取小鼠肝轉移瘤組織,組織切片采用二甲苯乙醇水化,加熱進行抗原修復,在室溫下用H2O2孵育。組織切片加入β-catenin一抗于4 ℃孵育過夜,滴加AP標記羊抗鼠二抗于室溫下孵育20 min。采用DAB顯色,蘇木精染液復染,脫水、透明、干燥、封片,在100倍顯微鏡下觀察各組的β-catenin表達水平。
1.4 統計學方法
應用SPSS 20.0軟件進行統計學分析,計量資料以均數±標準差表示,多組間比較采用單因素方差分析。P<0.05為差異有統計學意義。
2 結果
2.1 蛋白質印跡法檢驗建模效果
蛋白質印跡法(Western blotting)檢測結果顯示,pLL3.7-shSTC2組SW480細胞的STC2蛋白表達水平明顯低于pLL3.7-NC組和pLL3.7-Con組,差異有統計學意義(P<0.05),見圖1。
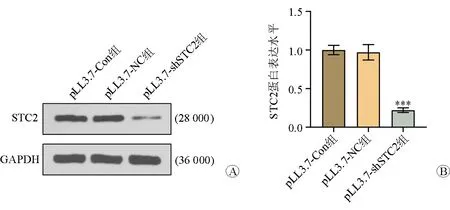
注:與pLL3.7-NC組比較,***P<0.001圖1 3組SW480細胞的STC2蛋白表達水平比較 A STC2蛋白電泳圖 B STC2蛋白表達柱狀圖
2.2 建模后各組的一般情況比較
建模后第1周,各組裸鼠的精神狀態、攝食飲水正常,活動自如,腹部未見明顯腫塊。建模后第2周開始,pLL3.7-Con組和pLL3.7-NC組裸鼠的精神狀態較差,攝食量減少,行動逐漸遲緩,部分裸鼠可見腹部膨隆;pLL3.7-shSTC2組中部分裸鼠出現精神狀態欠佳、攝食量偏少、行動較緩慢、體質量下降現象。建模3周后,頸椎脫臼處死裸鼠,解剖取出肝臟。各組的肝臟體積變小,外形部分受損,質地脆硬;各組的部分肝組織被轉移瘤替代,肝臟表面可見散在分布的灰白色針尖大小的微小轉移灶,轉移瘤主要位于肝葉邊緣和肝葉臟面。與pLL3.7-shSTC2組相比,pLL3.7-NC組和pLL3.7-Con組的肝臟外形不規則程度、質地脆硬度、瘤體破潰等現象均更嚴重,見圖2。
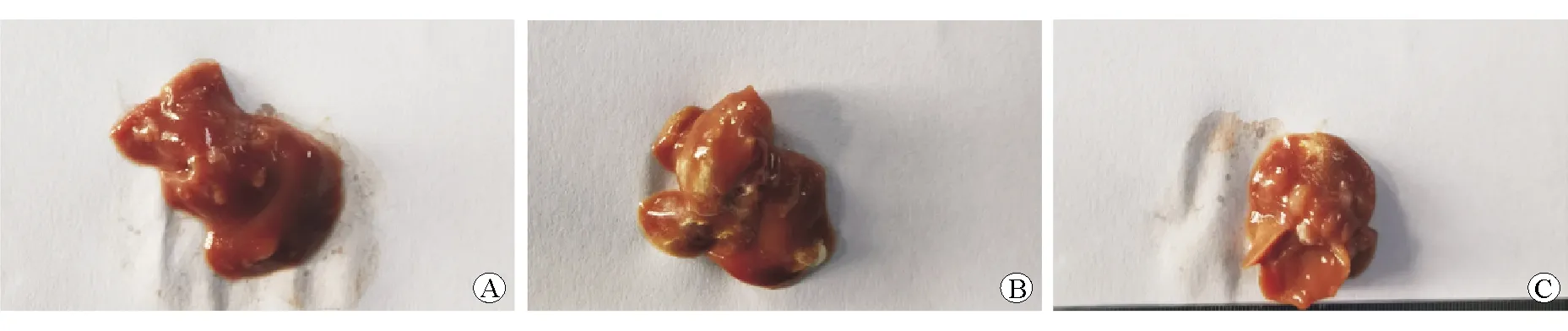
圖2 建模3周后各組的肝臟標本比較 A pLL3.7-Con組 B pLL3.7-NC組 C pLL3.7-shSTC2組
pLL3.7-Con組、pLL3.7-NC組、pLL3.7-shSTC2組的肝轉移瘤數量分別為(11.75±1.25)個、(12.15±1.38)個、(5.72±1.02)個,肝轉移瘤直徑分別為(2.22±0.21)mm、(2.24±0.20)mm、(1.51±0.18)mm,肝臟質量分別為(1.81±0.14)g、(1.85±0.15)g、(1.59±0.11)g。結果提示pLL3.7-shSTC2組的肝轉移瘤數量、直徑及肝臟質量均明顯小于pLL3.7-Con組和pLL3.7-NC組。見圖3。
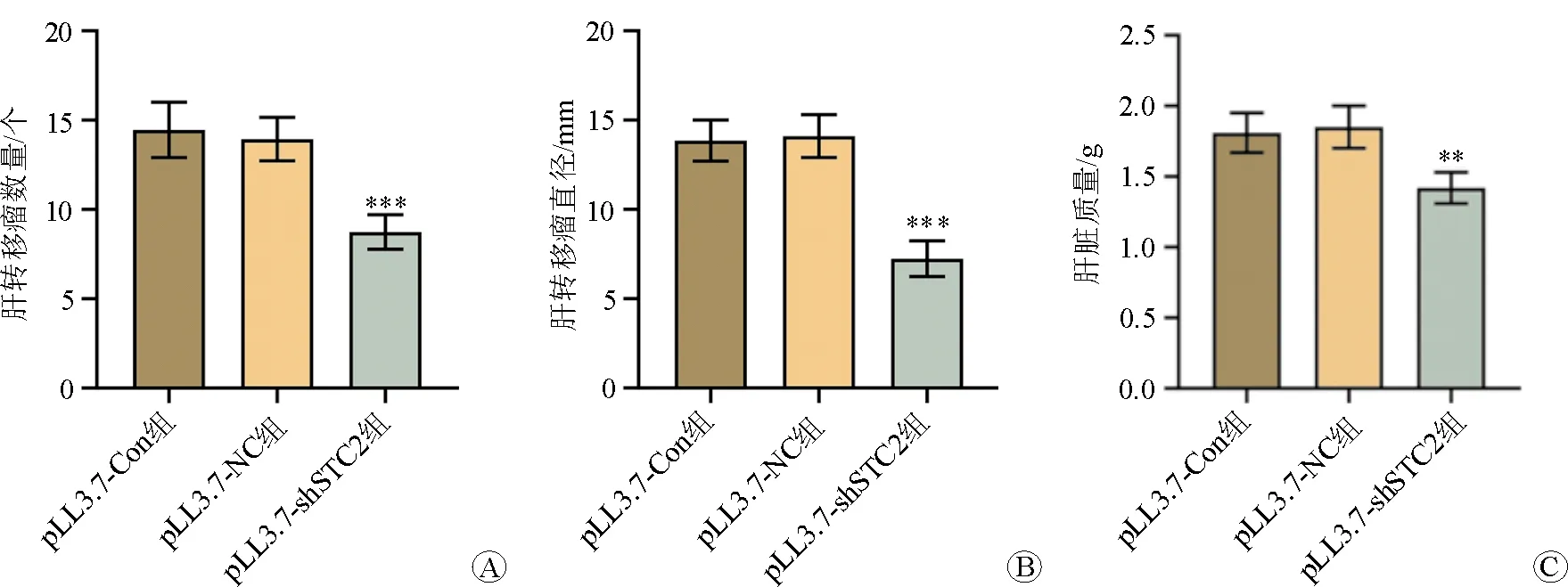
注:與pLL3.7-NC組比較,**P<0.01,***P<0.001圖3 各組的肝轉移瘤數量、直徑及肝臟質量比較 A 肝轉移瘤數量 B 肝轉移瘤直徑 C 肝臟質量
各組的肝組織H-E染色結果顯示,pLL3.7-Con組和pLL3.7-NC組的肝小葉結構大部分被破壞,且肝轉移瘤區可見大量腫瘤細胞聚集成團形成癌結節,腫瘤細胞異型性明顯,腫瘤細胞呈梭形,細胞質較少,細胞核呈圓形,核分裂相增多。pLL3.7-shSTC2組的肝小葉結構被破壞,視野內見少許腫瘤細胞聚集成團或散在分布,腫瘤細胞異型性明顯,細胞質較少,細胞核固縮,核分裂相增多。結果提示pLL3.7-shSTC2組的肝臟病理變化較pLL3.7-NC組和pLL3.7-Con組輕。見圖4。
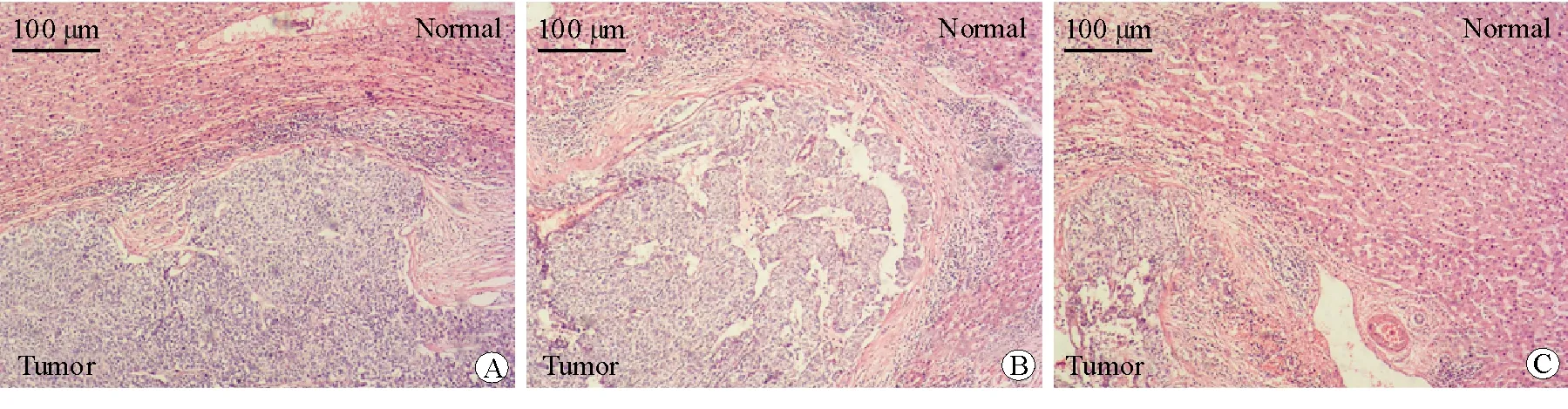
圖4 各組裸鼠的肝組織病理圖 H-E染色 ×100 A pLL3.7-Con組 B pLL3.7-NC組 C pLL3.7-shSTC2組
2.3 各組肝轉移瘤組織中STC2、EMT及Wnt/β-catenin信號通路相關基因的蛋白表達水平比較
Western blotting法檢測結果顯示,與pLL3.7-Con組、pLL3.7-NC組相比,pLL3.7-shSTC2組肝轉移瘤組織中STC2、Vimentin、MMP-9、β-catenin、TCF-4、C-myc及Cyclin D1的蛋白表達水平表達明顯降低(P<0.05),E-cadherin蛋白表達水平明顯升高(P<0.05)。見圖5、表2。
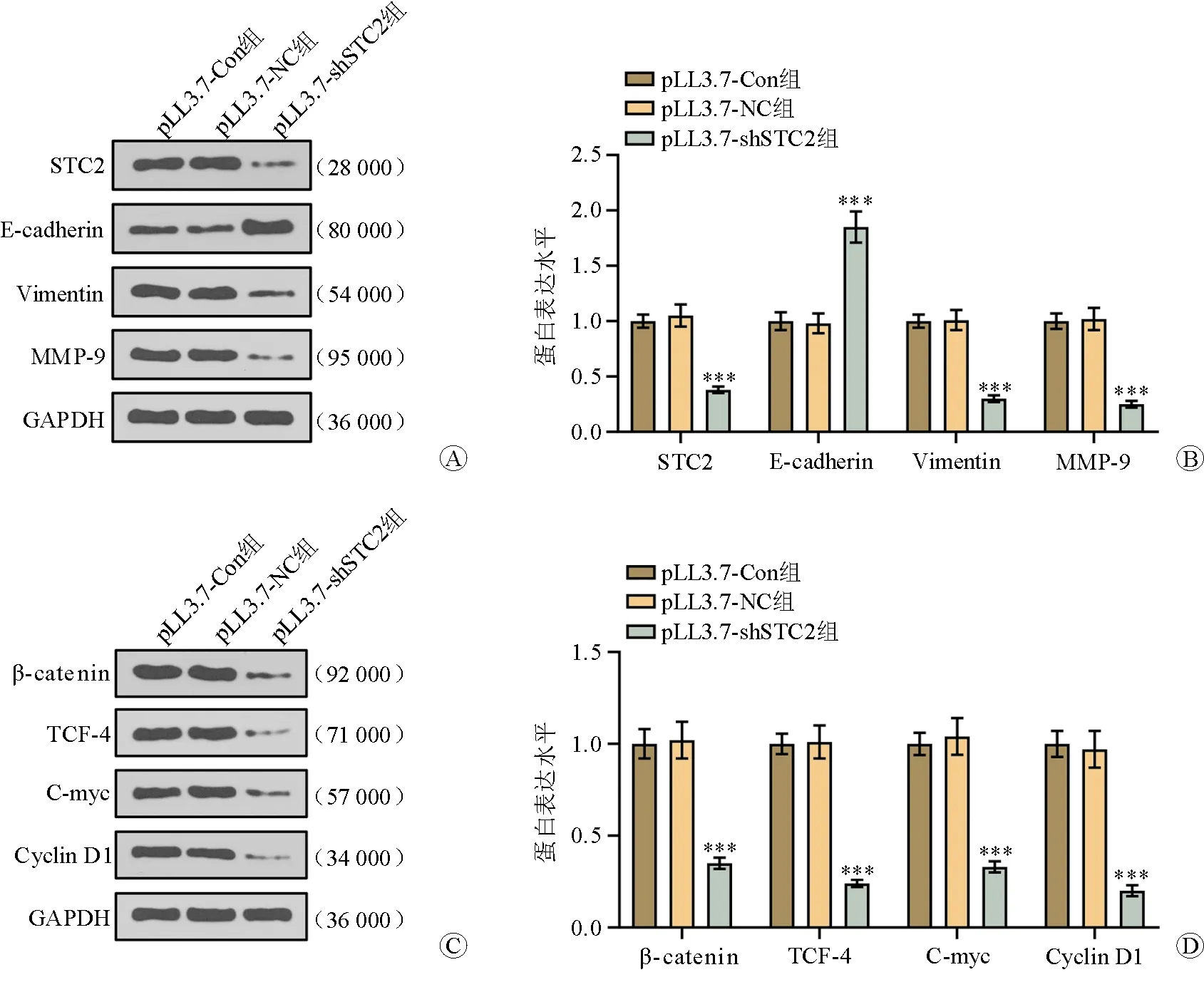
注:與pLL3.7-NC組比較,***P<0.001圖5 各組肝轉移瘤組織中STC2、EMT及Wnt/β-catenin信號通路相關基因的蛋白表達水平比較 A STC2、E-cadherin、Vimentin、MMP-9蛋白電泳圖 B STC2、E-cadherin、Vimentin、MMP-9蛋白表達柱狀圖 C β-catenin、TCF-4、C-myc、Cyclin D1蛋白電泳圖 D β-catenin、TCF-4、C-myc及Cyclin D1蛋白表達柱狀圖
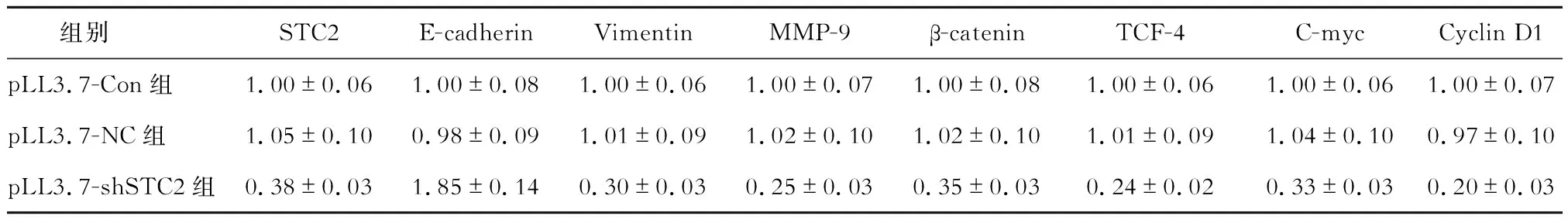
表2 各組肝轉移瘤組織中STC2、EMT及Wnt/β-catenin信號通路相關基因的蛋白表達水平比較
本研究中,RT-PCR法檢測結果顯示,與pLL3.7-Con組、pLL3.7-NC組相比,pLL3.7-shSTC2組裸鼠的肝轉移瘤組織中TCF-4、C-myc、CyclinD1的mRNA表達水平均明顯降低(P均<0.05)。見圖6、表3。

注:與pLL3.7-NC組比較,***P<0.001圖6 各組TCF-4、C-myc、Cyclin D1的mRNA表達水平比較

表3 各組肝轉移瘤組織中TCF-4、C-myc、Cyclin D1的mRNA表達水平比較
本研究中,免疫組織化學染色結果顯示,與pLL3.7-Con組、pLL3.7-NC組相比,pLL3.7-shSTC2組裸鼠的肝轉移瘤組織中β-catenin表達水平明顯降低。見圖7。

圖7 各組的β-catenin表達比較 免疫組織化學染色 ×100 A pLL3.7-Con組 B pLL3.7-NC組 C pLL3.7-shSTC2組
3 討論
在中國,CRC是常見的消化系統惡性腫瘤。研究報道,全球每年CRC新發病例約110萬,死亡病例約50萬[6-7]。近年來,隨著中國人口老齡化及飲食結構中脂肪占比的升高等原因,CRC的發病率呈升高趨勢。研究表明,肝轉移是造成CRC患者死亡的主要原因,該過程中有多因素、多基因參與[8]。雖然CRC的發病機制研究取得了一定的進展,但CRC發生肝轉移的具體機制迄今未完全明確。因此,探討新的CRC肝轉移標志物及治療策略是目前亟待解決的重要問題。
STC2是一種糖蛋白激素,主要在魚的腸道及腮中發揮抑制鈣攝取的作用[9]。研究發現,STC2廣泛存在于人體的十二指腸、腎小管和集合管等組織中,在細胞增殖、代謝等生理過程中發揮著一定的作用[10]。近年來,多項研究表明,STC2與惡性腫瘤的發生、發展密切相關[11-12]。為進一步探討STC2對CRC肝轉移的影響,本研究將pLL3.7-shSTC2質粒轉染入SW480細胞,發現pLL3.7-shSTC2組SW480細胞的STC2蛋白表達水平明顯低于pLL3.7-Con組和pLL3.7-NC組,提示成功構建沉默STC2的SW480細胞。本研究進一步構建了結腸癌細胞肝轉移裸鼠模型,結果顯示pLL3.7-shSTC2組裸鼠的一般情況較pLL3.7-Con組和pLL3.7-NC組好,肝轉移瘤數量、直徑及肝臟質量較小,肝組織病理變化較輕,提示沉默STC2對結腸癌細胞肝轉移有抑制作用。
腫瘤遠處轉移與EMT的發生、腫瘤微環境的變化,以及細胞質基質的降解密切相關[13]。EMT是指上皮細胞在生理、病理因素作用下,通過一系列基因的表達轉化為間質表型細胞的過程,在胚胎發育、器官形成和腫瘤細胞侵襲、遠處轉移等諸多生理、病理現象中發揮重要作用[14]。Vimentin、MMP-9及E-cadherin是EMT相關分子標志物,Vimentin、MMP-9表達水平上調,可通過重塑基質膜與細胞外基質,繼而下調E-cadherin水平,改變上皮細胞的微環境,促使EMT發生,誘導腫瘤細胞發生遠處轉移。此外,上述過程與Wnt/β-catenin信號通路轉導途徑密切相關,在生長因子的刺激下,激活Wnt/β-catenin通路的級聯反應,能增強腫瘤細胞的增殖和抗凋亡能力[15]。β-catenin是Wnt/β-catenin通路的核心元件,其在正常結腸細胞中可與E-cadherin及α-catenin結合形成復合體,發揮細胞間黏附作用,可防止細胞轉移。而在腫瘤細胞中,Wnt處于失活狀態,復合體被降解,導致β-catenin聚集于細胞質內,當細胞質內β-catenin達到一定水平后可激活細胞核內的TCF-4,導致通路下游靶基因C-myc、CyclinD1被激活,從而導致腫瘤細胞過度增殖及凋亡受阻[16]。
目前STC2是否通過調控Wnt/β-catenin信號通路促進結腸癌細胞肝轉移仍有待研究。為進一步闡明沉默STC2在結腸癌細胞肝轉移中的作用機制,本研究分析了結腸癌細胞肝轉移裸鼠模型中STC2、EMT及Wnt/β-catenin信號通路相關基因的蛋白表達,結果發現,與pLL3.7-Con組、pLL3.7-NC組相比,pLL3.7-shSTC2組肝轉移瘤組織中β-catenin、TCF-4、C-myc、Cyclin D1、Vimentin及MMP-9的蛋白表達均明顯降低,E-cadherin蛋白表達明顯升高,提示沉默STC2可能通過下調β-catenin表達,進而阻礙Wnt/β-catenin信號通路下游靶基因啟動子激活,阻礙TCF-4激活,下調C-myc及Cyclin D1表達水平,阻礙EMT的發生,從而抑制CRC肝轉移進程。
綜上所述,沉默STC2可通過抑制Wnt/β-catenin信號通路減少結腸癌細胞的增殖和侵襲,以及EMT的發生,從而抑制腫瘤肝轉移。本研究結果為臨床探尋新的CRC遠處轉移的分子標志物和治療策略提供了思路,本研究僅用SW480細胞進行了初步探討,今后將采用多種結腸癌細胞株及開展臨床研究進行驗證。

