高山植物威氏綠絨蒿種子表型及萌發特性研究
左 杰, 張國棟, 李紫倩, 浦 杰, 屈 燕, 區 智
(1.西南林業大學園林園藝學院,國家林業和草原局西南風景園林工程技術研究中心,云南省功能性花卉資源及產業化技術工程研究中心, 昆明 650224;2.大理州云龍縣漕澗林場, 云南 大理 672711)
威氏綠絨蒿(MeconopsiswilsoniiGrey-Wilson)是罌粟科(Papaveraceae)綠絨蒿屬(Meconopsis)的多年生草本植物,綠絨蒿為綠絨蒿屬植物的總稱,是云南八大名花之一,被歐洲人稱為世界名花,其花朵碩大,花色豐富,具有很高的藥用價值,是亟待開發的園林植物與藥用植物[1],威氏綠絨蒿花大且多,呈藍紫色至紫紅色,高可達1.5 m,常分布于海拔3 000 m以上區域,屬珍稀瀕危物種,具有巨大的育種潛力[2]。
目前,有關綠絨蒿無性繁殖研究報道較少,技術尚不成熟,主要靠種子進行繁殖。與植物的其他營養器官相比,種子的發育一直處于相對封閉的環境中,其表面特征受環境影響較小[3],應用體視鏡和掃描電鏡分別對種子外部形態及種皮的微形態特征進行初步觀察研究,旨在豐富、完善對威氏綠絨蒿植物的認識。
種子萌發的程度是影響出苗率的關鍵因素之一[4],在種子萌發試驗之前通過測定種子的生理生化指標以及種子的基本生物學特征,能夠更好地判斷種子是否具備萌發的潛力。同時,進行種子萌發實驗過程中提高種子的萌發率對綠絨蒿屬的后續實驗研究至關重要,因此迫切需要盡快找到促進綠絨蒿種子萌發的措施。植物激素對植物的生長發育有著重要作用,適宜種類與適宜濃度的激素可有效促進植物種子的萌發[5]。近年來,關于植物外源激素對種子萌發影響的研究很多,但對于不同種類外源激素處理威氏綠絨蒿種子萌發的研究鮮有報道。本實驗通過對種子表型特征、生理特性及不同濃度GA3、6-BA、NAA、SA對威氏綠絨蒿種子萌發的影響進行初步研究,以期找到適宜的激素及其濃度促進威氏綠絨蒿種子萌發,為威氏綠絨蒿引種馴化和播種栽培提供理論和實踐指導。
1 材料與方法
1.1 試驗材料
威氏綠絨蒿種子于2019年9月22日采自云南轎子雪山(海拔4 344.1 m,102°48′49″~102°58′50″E,26°00′23″~26°10′20″N),采后放置陰涼通風處自然干燥,儲存于4 ℃冰箱備用。
1.2 試驗方法
1.2.1種子基本生物學特性
種子大小、千粒重測定:選用發育良好的成熟種子,分別置于體視顯微鏡和掃描電鏡下觀察,拍照。
種子含水量測定:稱取1 g種子,放入80 ℃烘箱,每隔12 h稱量并記錄種子的質量,直到稱重樣品3次恒重為止。設3組重復,計算含水量,結果取平均值。
含水量(%)=[(樣品烘前質量-樣品烘后質量)/樣品烘前質量]×100%;
種子吸水率測定:隨機選取3 000粒種子,分為3組,用電子天平稱重后放置于2 mL離心管,加純水反復震蕩后靜置,分別于吸水2、4、6、8、10、12、14、16、18、20、22、24 h時取出種子,用吸水紙擦干種子表面水分并稱量,計算平均值。
吸水率(%)=[(浸種后重量-浸種前重量)/浸種前重量]×100%。
1.2.2種子生理指標的測定
在進行種子萌發實驗之前測定種子的生理生化指標。MDA含量、可溶性蛋白含量、SOD活性、CAT活性和POD活性的測定均參照李合生[6]的實驗方法,稍有改動。
1.2.3種子萌發試驗
隨機選取2 520粒威氏綠絨蒿種子,放入裝有1%的過氧化氫溶液的2 mL離心管中消毒30 s,用蒸餾水洗凈殘余過氧化氫。用4種激素進行處理,每種激素分別設置7個不同濃度(ck為0 mg·L-1處理)(表1),每個處理3次重復,每重復30粒種子。用相應激素處理浸種24 h,在墊有濕潤濾紙的玻璃培養皿中播種,播種后放入20 ℃、光照12 h·d-1、濕度70%的培養箱中培養(前48 h做暗處理)。
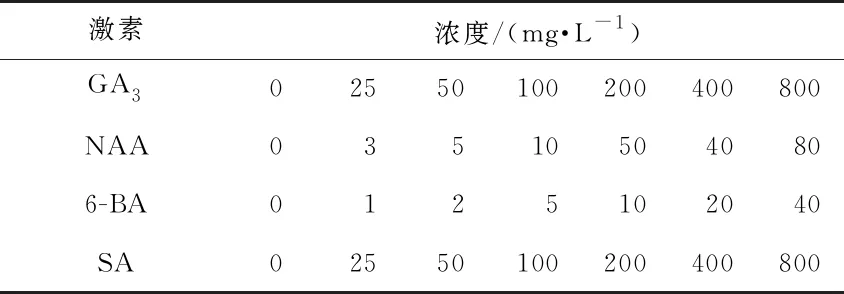
表1 不同激素及其濃度設置
每天定時統計種子萌發情況,以胚根伸出種子長度等于種子長度的1/2視為萌發。測定指標包括:發芽率、發芽勢、發芽指數、平均發芽時間、發芽啟動時間。
1.3 數據處理
圖表繪制軟件為Oringin Pro 9.0,顯著性差異分析軟件為SPSS 25。
2 結果與分析
2.1 威氏綠絨蒿種子表型特征
電鏡及體視鏡觀察,威氏綠絨蒿成熟種子近腎形,種子干燥后種皮黑褐色,具有較深的、蜂窩狀孔的凹陷和短條紋狀、近網狀皺褶。經測量,威氏綠絨蒿的種子長度為(1.19±0.11)mm,寬度為(0.73±0.12)mm;種子千粒重為(0.31±0.01)g,屬于小型種子;含水量為(8.74±0.2)%(圖1)。
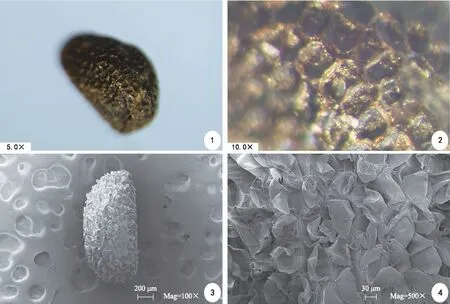
注:體視鏡下種子形態(1)、(2);掃描電鏡下種子形態(3)、(4)。
2.2 威氏綠絨蒿種子吸水規律
由圖2可知,隨著純水浸種時間的延長,威氏綠絨蒿種子吸水速度先快后慢,呈現出3個階段,在0~2 h為急劇吸水階段,吸水率從0上升到36.7%,平均每小時吸水速率為18.35%。在2~12 h為緩慢吸水階段,吸水率從36.7%上升到最大值70.07%,平均吸水速率為3.34%。12~24 h為飽和吸水階段,吸水率維持動態恒定。
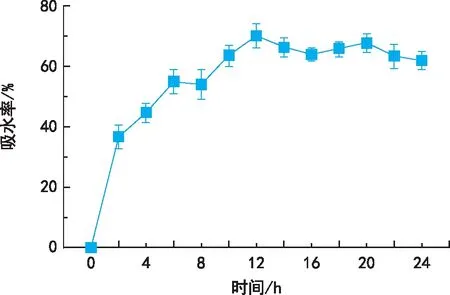
圖2 威氏綠絨蒿種子吸水率隨吸水時間變化規律
2.3 威氏綠絨蒿種子生理特性
經測定,未經激素處理的威氏綠絨蒿種子中丙二醛含量為(5.10±0.81)mmol·g-1;可溶性蛋白含量為(46.37±0.67)mg·g-1;超氧化物歧化酶活性為(559.33±17.80)U·g-1;過氧化物酶活性為(83.33±22.68)U·g-1;過氧化氫酶含量為(2 777.78±444.88)U·g-1。
2.4 不同濃度GA3對威氏綠絨蒿種子萌發的影響
由圖3可知,100 mg·L-1、200 mg·L-1、800 mg·L-1GA3處理均能提高威氏綠絨蒿種子的發芽率,當GA3濃度為800 mg·L-1時促進種子萌發的效果最顯著(p<0.05)。當GA3濃度在200~800 mg·L-1之間時均能顯著提高種子的發芽勢(p<0.01),400 mg·L-1和800 mg·L-1GA3濃度處理過的威氏綠絨蒿種子平均發芽時間和發芽啟動時間均顯著縮短(p<0.05),800 mg·L-1GA3處理顯著提高了種子發芽指數(p<0.05)。總體來看,GA3處理能夠促進種子萌發,800 mg·L-1GA3促進效果最顯著(p<0.05),相較于ck發芽率、發芽勢和發芽指數分別增加了23.89%、12.56%和2.03,但平均發芽時間縮短了8.43 d,發芽啟動時間提前了5 d。
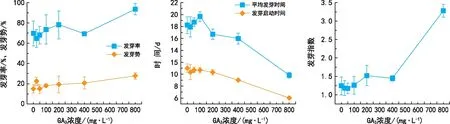
圖3 不同濃度GA3對威氏綠絨蒿種子萌發的影響
2.5 不同濃度NAA對威氏綠絨蒿種子萌發的影響
由圖4可知,20 mg·L-1、40 mg·L-1、80 mg·L-1NAA在一定程度上提高了種子發芽率和發芽勢,80 mg·L-1NAA顯著提高了種子的發芽指數(p<0.05),而3 mg·L-1、5 mg·L-1、10 mg·L-1NAA處理則降低了種子的發芽率和發芽勢。各濃度NAA處理對種子平均發芽時間影響均不顯著(p>0.05),40 mg·L-1、80 mg·L-1NAA處理縮短了種子的發芽啟動時間。總體來看,實驗設置的各濃度NAA對威氏綠絨蒿種子萌發有一定的促進作用,但都沒有達到顯著性差異水平(p>0.05),80 mg·L-1NAA處理更有利于種子萌發。
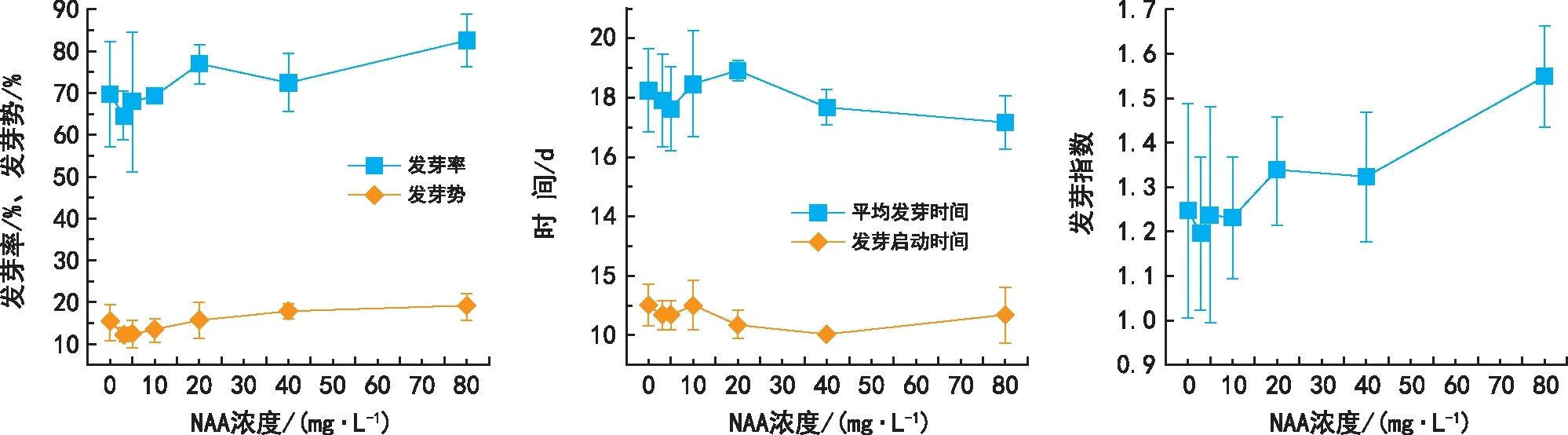
圖4 不同濃度NAA對威氏綠絨蒿種子萌發的影響
2.6 不同濃度6-BA對威氏綠絨蒿種子萌發的影響
由圖5可知,經低濃度6-BA處理后的威氏綠絨蒿種子發芽率和發芽勢較ck變化不大(p>0.05),當6-BA濃度超過10 mg·L-1時,種子的發芽率和發芽勢隨激素濃度的增加而降低(p<0.05);在發芽指數、平均發芽時間以及發芽啟動時間上,各濃度6-BA處理的種子相對于ck無顯著性差異(p>0.05)。總體來看,低濃度6-BA對威氏綠絨蒿種子萌發影響不明顯,當6-BA濃度達到20 mg·L-1時,開始抑制威氏綠絨蒿種子發芽率、發芽勢和發芽指數,使發芽率和發芽勢分別降低67.12%和6.12%,當6-BA 濃度為40 mg·L-1時對種子的發芽率和發芽勢抑制更明顯,分別降低了69.37%和14.7%。

圖5 不同濃度6-BA對威氏綠絨蒿種子萌發的影響
2.7 不同濃度SA對威氏綠絨蒿種子萌發的影響
由圖6可知,當SA處理濃度在25~400 mg·L-1之間時,除發芽指數外其他各項測定指標均與ck無顯著性差異(p>0.05),當SA濃度為800 mg·L-1時不僅降低了種子的發芽率,并且延長了種子的平均發芽時間和發芽啟動時間。總體來看,低濃度SA處理對威氏綠絨蒿種子萌發的影響不明顯,而高濃度的SA處理則抑制了威氏綠絨蒿種子的萌發,800 mg·L-1濃度的SA處理種子時,對種子萌發產生了明顯的抑制。

圖6 不同濃度SA對威氏綠絨蒿種子萌發的影響
2.8 各激素處理促進種子萌發效果綜合比較
由圖7可知,選取對威氏綠絨蒿種子萌發促進效果最好的激素濃度,綜合比較各激素對種子萌發促進效果的差異。在發芽率的促進效果上,800 mg·L-1GA3>80 mg·L-1NAA>25 mg·L-1SA>1 mg·L-16-BA;在發芽勢的促進效果上,800 mg·L-1GA3>80 mg·L-1NAA,25 mg·L-1SA和1 mg·L-16-BA降低了發芽勢;在縮短平均發芽天數上,800 mg·L-1GA3>1 mg·L-16-BA>80 mg·L-1NAA>25 mg·L-1SA;在縮短發芽啟動時間上,800 mg·L-1GA3>1 mg·L-16-BA>80 mg·L-1NAA,25 mg·L-1SA增加的發芽啟動時間;在提升發芽指數上,800 mg·L-1GA3>80 mg·L-1NAA>1 mg·L-16-BA>25 mg·L-1SA。
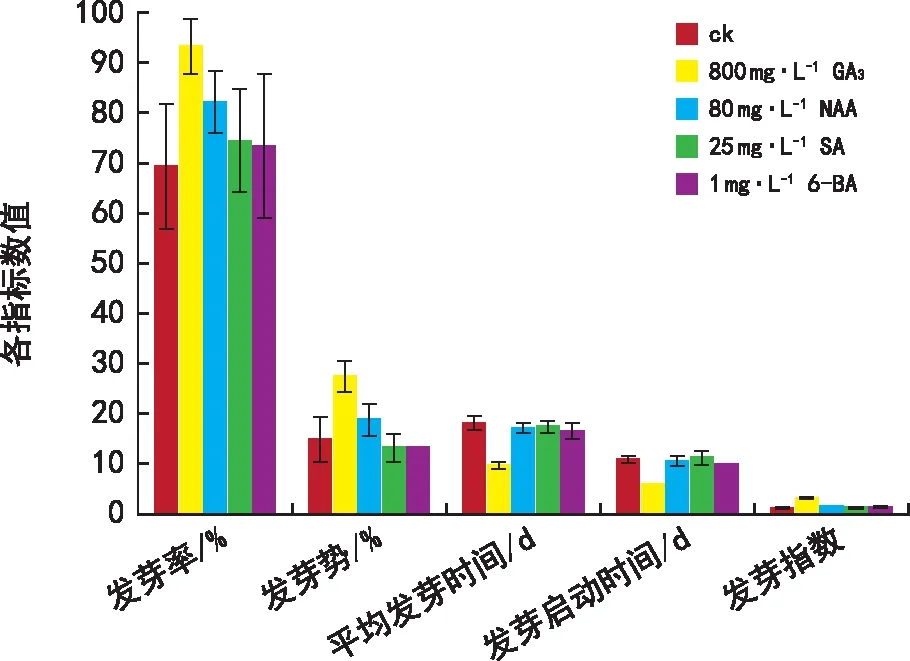
圖7 各激素處理促進種子萌發效果綜合比較
3 討 論
種子作為重要的繁殖器官,在植物適應環境及繁殖過程中都具有重要作用。種子的形態特征具有相對穩定性,種子微形態結構與種子水分的吸收、種子的生活力以及種子的傳播、壽命、萌發速度的快慢和萌發率有著密切的聯系,種子的形態和質量還能影響種子的散布距離[2]。袁長春[7]利用掃描電鏡對32種綠絨蒿種子進行觀察研究,根據外種皮表面的紋飾和附屬物的差異,將綠絨蒿植物的種皮紋飾分為條紋型、網紋型、褶皺型和泡狀型。綜合體視鏡和掃面電鏡的觀察,威氏綠絨蒿種子近腎形,在低倍放大時,外種皮表面具有較密集的褶皺,且部分褶皺呈片塊狀,在高倍放大后,片塊狀褶皺呈雜亂狀的擠在一起,并有部分細絲狀物交織在一起,屬于褶皺型種子。
種子從收獲到播種都需要經過一段時間的儲藏,隨著儲藏時間的增加,種子會逐漸失去活力,發芽率明顯下降,甚至難以萌發。在播種之前測定種子的生理生化反應能更準確地反應出種子的活力和內在品質,也能更好的對儲藏中的種子是否能順利萌發做一個預判。目前關于種子活力的測定方法常用的有3種:第一是進行標準發芽試驗;第二是測定生理生化指標;第三是復合逆境法測定[8]。本實驗通過測定種子的部分生理生化指標以及進行種子萌發實驗,證明威氏綠絨蒿種子在進行萌發實驗前是處于正常狀態且具有活力的種子。
種子休眠是指具有生活力的種子在適宜的萌發條件下仍不能萌發的現象, 大多數植物種子有或強或弱的休眠特性[9]。綠絨蒿生長于海拔2 500~5 500 m的高山上,高山上氣候多變,休眠可以防止種子在不適于自身生長的外界環境條件下萌發,種子休眠可能是綠絨蒿的一種生存策略[10]。不管這種策略是否存在,種子休眠都給綠絨蒿的科研栽培和生產栽培上帶來諸多不便,因此,科研和生產上都迫切需求找到破除綠絨蒿種子休眠、促進種子萌發的有效措施。
周健[11]研究表明,種子休眠可能是由于植物角質層和柵欄層的結構影響種子種皮透性所引起的。賴小連等[12]研究認為,夏臘梅萌發困難是由于種皮堅硬,透水性較弱而導致。本研究表明,威氏綠絨蒿種子吸水速度先快后慢,浸種12 h種子吸水達到飽和并趨于穩定,飽和時吸水率為67.65%,說明威氏綠絨蒿種子在萌發時不存在吸水障礙。另外,威氏綠絨蒿種子經純水浸泡12 h后吸水率趨于飽和,這可為以后研究激素及其他物質溶液對威氏綠絨蒿種子作用效果時種子浸泡處理時間的確定提供參考。
外源激素能夠對植物種子萌發起到促進或抑制的作用[13],常見的外源激素有GA3、NAA、6-BA、SA等。
GA3可促進糊粉層細胞合成淀粉酶,淀粉酶能夠促進胚乳中淀粉的水解,為胚的生長發育提供物質和能量,進而促進種子萌發[14]。200~300 mg·L-1GA3處理可提高長果綠絨蒿種子發芽率、發芽勢和發芽指數,縮短平均發芽時間[15],當使用200 mg·L-1的GA3處理頂果木種子時,可顯著提高其發芽率、發芽勢和發芽指數,但濃度提升至300 mg·L-1時對種子萌發的促進效果不如200 mg·L-1的處理好[16]。本實驗表明,低濃度GA3對威氏綠絨蒿種子萌發影響不顯著(p>0.05),但當GA3濃度達到800 mg·L-1時,可以極顯著地提高種子的發芽率和發芽勢,降低平均發芽時間和發芽啟動時間(p<0.05)。但屈燕等[17]研究表明,100 mg·L-1GA3對總狀綠絨蒿種子萌發促進最顯著。因此可以推斷,不同種類的綠絨蒿對不同外源激素處理的最適濃度不同。
NAA是一種廣譜型植物生長調節劑, 能夠促進植物細胞的分裂和擴大, 誘導不定根的形成[18]。研究表明,一定濃度的NAA預處理能夠提高植物種子的發芽率和發芽勢[19-21],也有研究表明,NAA可抑制植物種子萌發[22]。本實驗表明,NAA對威氏綠絨蒿種子萌發影響不顯著,80 mg·L-1NAA雖可提高種子的萌發,但未能達到顯著性差異水平(p>0.05),這可能是由于促進威氏綠絨蒿種子萌發的NAA濃度高于80 mg·L-1。
6-BA是一種非植物內源的生長調節劑,可以促進細胞的分裂,濃度適宜時可促進種子的萌發,如0.1 mg·L-1、0.5 mg·L-1、1.0 mg·L-1和1.5 mg·L-16-BA均能促進花葉莧菜種子萌發,但6-BA 濃度為2 mg·L-1時則對種子萌發產生了抑制[23]。對于威氏綠絨蒿來說,1 mg·L-1、2 mg·L-1、5 mg·L-1和10 mg·L-16-BA處理的種子在發芽率和發芽勢上相對于ck均無顯著性差異(p>0.05),但濃度大于20 mg·L-1時反而會降低種子發芽率和發芽勢,因此6-BA可能對威氏綠絨蒿種子萌發無促進作用,相反,20 mg·L-1以上濃度還會抑制種子萌發。
SA是植物界普遍存在的酚類化合物,對植物有積極的生理效應, 被認為是一種新的植物內源激素[24]。達清璟等[25]研究表明,不同濃度的SA處理能夠對總狀綠絨蒿種子萌發產生不同程度的促進和抑制作用。在本實驗中,當SA濃度小于800 mg·L-1時對威氏綠絨蒿種子萌發影響不明顯(p>0.05),當濃度提升至800 mg·L-1時,SA不僅極顯著地降低了種子發芽率和發芽勢(p<0.01),還增加了平均發芽時間和發芽啟動時間(p<0.01),這說明總狀綠絨蒿與威氏綠絨蒿種子萌發特性并不相同。
4 結 論
威氏綠絨蒿種子近腎形,屬褶皺型種子。種子的休眠并不來源于吸水障礙,經過不同濃度GA3、NAA、6-BA、SA處理后,發芽率最高的是GA3處理組,當GA3濃度達到800 mg·L-1時,種子的發芽率和發芽勢最高,平均發芽時間和發芽啟動時間最短。因此,為提升種子萌發效率,在播種威氏綠絨蒿時,建議預先采用800 mg·L-1GA3浸種24 h處理,6-BA和SA不適宜作為威氏綠絨蒿播種時的外源添加激素。

