吲哚菁綠熒光實時顯影技術在兒童復雜腎積水機器人輔助腹腔鏡手術中的初步應用
馬立飛 周輝霞 周曉光 陶 天 曹華林李 品 趙 揚 郭 濤 朱煒瑋
腎盂輸尿管連接部梗阻(ureteropelvic junction obstruction,UPJO)是指由于各種原因引起的腎盂與輸尿管連接處狹窄,尿液引流不暢,繼而導致患者出現各種癥狀、體征以及腎臟功能改變的先天性輸尿管異常疾病。 自Anderson 等[1]首次提出離斷式腎盂成形術以來,開放Anderson-Hynes 離斷式腎盂成形術一直被認為是治療該病的標準術式。 隨著微創技術的發展,腹腔鏡及機器人輔助腹腔鏡腎盂成形術以其疼痛輕、創傷小、恢復快、美容效果好及成功率等于或優于開放手術等優點而被廣泛應用,尤其在復雜性輸尿管重建手術中,應用機器人輔助腹腔鏡技術的優勢更加明顯[2-4]。 可視化工具是輔助外科醫生進行術中判斷的重要手段。 吲哚菁綠(indocyanine green,ICG)是目前使用最廣泛的無輻射熒光造影劑,近年來已在多個領域的外科手術治療中顯示出獨特優勢[5-7]。 其波長為700 ~850 nm,可通過近紅外線熒光顯像,在外科手術中鑒別血供豐富和血供薄弱區域,從而為腫瘤界限或重建手術中組織瓣血供情況的判斷等提供實時依據。本研究總結分析2017 年10 月至2019 年8 月中國人民解放軍總醫院第七醫學中心附屬八一兒童醫院收治的36 例腎積水患者臨床資料。 術中均應用靜脈注射吲哚菁綠的區域血流熒光可視化成像輸尿管顯影技術,根據熒光顯影血流灌注區域可視化成像結果,指導并優化機器人兒童腎盂成形術的手術策略。
材料與方法
一、臨床資料
2017 年10 月至2019 年8 月,本中心共收治復雜腎盂輸尿管連接部梗阻患者36 例。 其中男29例,女7 例,右側22 例,左側14 例。 年齡3 ~126 個月,中位年齡58 個月。 伴腹痛21 例,伴泌尿系感染9 例。 初次狹窄8 例,經腎盂成形術后再次狹窄28例。 因腎盂成形術中靜脈注射吲哚菁綠并非注射用吲哚菁綠的臨床適應證,經醫院倫理委員會審批同意后,患者家屬術前均被告知操作風險并簽署了書面同意書。 患者均行機器人輔助腹腔鏡腎盂成形術,其中腎盂翻瓣成型術18 例,口腔黏膜代輸尿管10 例,闌尾代輸尿管5 例,回腸代輸尿管3 例。所有患者無泌尿系結石、膀胱輸尿管狹窄或梗阻等其他合并癥。
二、手術方法及術后處理
患者全麻后先取健側臥位,患側腰背部墊高70°。 達芬奇機器人系統床旁機械臂采用3 臂,自臍窩置入8.5 cm 套管作為鏡頭孔,于恥骨聯合上緣與腹橫紋交叉處置入一8 mm 的1 號機械臂,于劍突下置入5 mm 的2 號機械臂,于臍下機械臂操作通道患側3 cm 處置入1 個5 mm 輔助通道。 各操作孔均用2-0 慕絲線縫合固定。
手術步驟: ①打開患側結腸外側腹膜,游離腎周脂肪及筋膜或粘連組織,充分顯露腎下極及輸尿管上段; ②裁剪擴張的腎盂,吸盡積液,經腹壁穿一牽引線將腎盂上極懸吊牽引。 然后切除狹窄段輸尿管,并于輸尿管外側壁縱行剖開一段距離; ③輸尿管狹窄段≥5 cm 者,裁剪腎盂并翻瓣,或截取闌尾、相應長度的回腸或口腔黏膜作為組織材料以替代輸尿管; ④確定腎盂最低點,并以雪橇針將腎盂最低點與輸尿管劈開最低處或組織材料末端行點對點定位縫合,連續或間斷縫合吻合口后壁,經吻合口順行置入雙J 管,連續縫合吻合口前壁及多余的腎盂瓣開口; ⑤注射吲哚菁綠,運用機器人系統集成的熒光實時顯影技術,觀察重建后組織的血運情況; ⑥如血運良好,則關閉腹膜,吸盡積液,結束手術;如血運不理想則更換組織材料,重新自上述第③步繼續手術。
術后常規留置尿管3 ~4 d,保持尿管通暢。 術后6 ~8 周拔除雙J 管,術后1 個月、3 個月、6 個月、12 個月分別復查泌尿系超聲,術后6 個月評估利尿性腎動態顯像。 術后并發癥情況采用Clavien-Dindo分類標準進行分級。 手術成功定義為術后臨床癥狀解除,泌尿系超聲檢查提示腎盂分離前后徑恢復正常,拔除雙J 管后利尿性腎動態顯像提示梗阻解除。
結 果
本組36 例均順利完成手術,無一例中轉開放手術或改變術式。 手術時間65 ~150 min,平均(93.2±16.7)min。 術中出血量10 ~50 mL,平均(26.8 ±8.3)mL。 術后拔除引流管時間2 ~5 d,平均(3.7 ±1.3)d,術后住院時間4 ~9 d,平均(7.4 ±1.6)d。 5例術后出現泌尿系感染(Clavien-Dindo Ⅱ級并發癥),給予靜脈滴注抗生素治療后好轉,無一例出現Clavien Ⅲ、Ⅳ級并發癥。
隨訪時間4 ~26 個月,平均(12.8 ±5.3)個月。所有患者術后癥狀消失,術后3 ~6 個月復查超聲及腎圖檢查,結果提示患腎功能不同程度恢復,無吻合口狹窄、再次梗阻、泌尿系感染等并發癥。 拔除引流管6 個月后復查利尿性腎動態顯像,結果顯示患者梗阻均解除,繼續隨訪觀察。
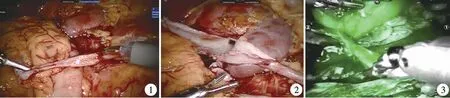
圖1 一例輸尿管長段狹窄患者的術中情況 圖2 采用腎盂翻瓣技術進行輸尿管吻合 圖3 熒光顯影技術顯示腎盂翻瓣部分血運良好Fig1 Intraoperative finding of a child with long ureteral stenosis Fig.2 Flap of renal pelvis Fig.3 Fine blood circulation of flap with fluorescent technique
討 論
吲哚菁綠是一種水溶性的三碳菁染料,1955 年由美國柯達公司研發并于1956 年由美國FDA 批準用于人類疾病診斷,其靜脈注射后以與血清蛋白結合或游離兩種形式在血液中運輸,其中約98%與血清蛋白結合,主要與球蛋白和脂蛋白結合。 肝臟從血流攝取ICG 并通過谷胱甘肽S-轉換酶代謝,較其他造影劑具有無輻射、高吸光度、低毒性、價格便宜等優勢[8,9]。 游離ICG 會被肝臟迅速從血管系統中清除,并通過蛋白谷胱甘肽S-轉移酶轉運到膽汁中代謝。 而與血清蛋白結合的ICG 可以在1 min 內將熒光顯示在整個血管系統中[10]。 其不良反應發生率很低,藥代動力學亦已得到充分的研究[11,12]。 近紅外熒光成像技術是集成在達芬奇外科手術系統中的一套可以在術中實時對ICG 進行顯像的專利技術。 ICG-NIRF 成像技術在腫瘤切除術及外科各專科中均已得到廣泛應用。 該技術通過靜脈注射ICG 并利用NIRF 頻段進行術中實時顯影,從而讓外科醫生確認腫瘤區域和正常組織的血流灌注情況;心臟外科和胃腸外科可利用ICG 的NIRF 成像技術來判斷用于人體組織修復或流出道組織吻合后的部位是否存在局部缺血[13,14]。
ICG-NIRF 技術在泌尿外科手術也得到了一定應用[15]。 雖然美國FDA 至今未批準ICG 在泌尿外科手術中常規應用,但自2006 年起已有30 余篇文獻報道在臨床研究中試驗性使用ICG 進行術中輔助判斷。 多數研究集中在腎移植手術及腎上腺、腎臟、膀胱、前列腺、腹膜后組織等器官組織惡性腫瘤的界限判斷和分辨腫瘤的淋巴結轉移范圍等。
ICG 在上尿路疾病修復性手術中的應用研究相對較少。 Marc 等[16]于2013 年報道了ICG-NIRF 技術在上尿路機器人輔助手術中的初步應用,在其納入的42 例上尿路重建手術患者中,采用靜脈注射ICG 的方法來輔助判斷組織血流灌注情況。 Ziho等[17]于2014 年報道了一組ICG-NIRF 在機器人輸尿管重建手術中的應用研究,其納入的病例術式包括腎盂成形術、輸尿管吻合術及膀胱輸尿管再植術等。 和先前研究不同,他們利用逆行置管將ICG 直接灌注到腎盂及輸尿管內,從而實現了輔助輸尿管定位和精確判斷狹窄段輸尿管長度的目的。
本研究中,我們主要評估了ICG 對于較為復雜的兒童腎盂輸尿管連接部梗阻病例的臨床應用價值。 對于輸尿管長段狹窄或手術后再次狹窄的患者,采用翻轉腎盂瓣、口腔黏膜及闌尾或部分腸管等自身人體組織材料代替部分輸尿管進行腎盂成形術。 這些情況下,轉移組織材料在鑲嵌入輸尿管后血供是否豐富,是其能否存活的關鍵。 達芬奇機器人系統因其自身集成的NIRF 顯示模式,使得術中應用ICG 實時熒光顯影技術成為可能,術者可及時發現缺血的組織段,避免術后再次狹窄及再次手術的情況發生。 我們認為通過靜脈注射ICG 而非在腎盂輸尿管灌注ICG 更符合我們的實驗設計,在完成腎盂組織瓣轉移并與輸尿管后壁吻合后,即刻采用熒光實時顯影技術觀察吻合口血流情況,通過比對轉移腎盂組織瓣與周圍正常尿路組織間的熒光顯影亮度變化來判斷其血運情況。 本研究首次報道較大樣本量的ICG-NIRF 技術在復雜兒童腎盂成形術中應用。 在復雜腎盂輸尿管連接部梗阻手術中,ICG-NIRF 技術的可行性、安全性和有效性均得到了驗證,其實時判斷轉移組織瓣血供的功能優勢明顯,能更好地指導術者手術方式的決策,幫助提高手術的成功率。
本研究的主要缺陷是熒光顯影技術在臨床應用經驗尚淺,對于血供判斷的時機及灌注程度主要依靠術者經驗,缺乏相應的客觀指標及遠期隨訪帶來的效果反饋。 未來我們將繼續對這批患者進行相應的隨訪。

