青霉菌液體發酵及發酵液效價測定
奚逢源,薛長艷,季芳琴,屈曉璐
[1.臺州技師學院(籌),浙江 臺州 318001;2.臺州職業技術學院,浙江 臺州 318000]
青霉素從發現到應用對人類的生命征途起到了巨大的作用[1]。青霉素不是單一的結構,又被稱為青霉素G[2]、青霉素鈉等。青霉素分為天然青霉素和半合成青霉素,兩者的生產方法有著天壤之別。例如青霉素G的生產較為簡單,只需要通過培養青霉菌孢子培養物來進行發酵,再提取青霉素精制就可以獲得鈉鹽[3]。半合成青霉素則是通過裂解工藝得到的6APA與多種合成有機酸發生酰化反應而得。青霉素的發酵難以實現在線測量關鍵變量,所以發酵過程的控制是一個較大的難題。現如今,對青霉素發酵的優化重點就在于如何減輕污染以及對發酵過程中的相關生理特性進行優化,盡量降低發酵成本[4]。在青霉素多年的研究中,其生產工藝也在不斷完善[5]。本實驗首先對青桔霉進行搖瓶淺層液態發酵生產以獲取青霉素,其次對獲得的發酵液進行效價測定來觀察發酵液中青霉素的抑菌活性[6]。通過簡單的實驗來學習效價測定的方法和青霉素對微生物的抑制作用。
1 材料與方法
1.1 實驗菌種
(1)菌種:青桔菌,保藏于臺州職業技術學院。
(2)指示菌:金黃色葡萄球菌。
(3)用具及試劑:培養皿(90 mm),試管,錐形瓶 (250.0 mL),移液槍,移液管,無菌水,生理鹽水,pH為6.0的磷酸緩沖溶液(PBS),氨芐青霉素鈉鹽(1 667.00 U/mL)。
1.2 儀器設備
超凈臺、搖床、恒溫培養箱、高壓蒸汽滅菌鍋、離心機等。
1.3 培養基
營養瓊脂(Nutrient Agar,NA)培養基:牛肉浸膏 3.00 g/L,氯化鈉1.00 g/L,蛋白胨10.00 g/L,瓊脂20.00 g/L,pH為7.4~7.6。
馬鈴薯葡萄糖瓊脂(Potato Dextrose Agar,PDA)培養基:土豆200.00 g/L,瓊脂20.00 g/L,葡萄糖20.00 g/L,純化水。
種子培養基:葡萄糖5.00 g/L,蔗糖60.00 g/L,玉米淀粉20.00 g/L,碳酸鈣5.00 g/L,硫酸銨10.00 g/L,純化水,pH為6.4。
液體發酵培養基:玉米淀粉0.30 g/L,葡萄糖0.40 g/L,蛋白胨0.04 g/L,KH2PO40.02 g/L,MgSO4·7H2O 0.01 g/L,純化水。
1.4 實驗方法
1.4.1 菌種活化
將在-20 ℃下保藏的青桔霉甘油凍存管放置在室溫自然融化,然后在PDA斜面培養基中28 ℃培養6~7 d。
1.4.2 搖瓶種子培養
從生長好的PDA斜面培養基接種到液體種子培養基中,25 ℃條件下 200 r/min振蕩培養3 d。
1.4.3 菌種搖瓶發酵培養
將培養3 d的種子液以10%的接種量接種到液體發酵培養基中,25 ℃條件下200 r/min振蕩培養5~7 d。
1.4.4 制備金黃色葡萄球菌菌懸液
NA培養基在37 ℃下培養24 h后,用生理鹽水清洗菌體,3 000 r/min下離心5 min,去除上清液,洗濯1~2次。稀釋成濃度約109個/mL的菌懸液后,在冰箱4 ℃下保存待用。
1.4.5 青霉素標準溶液的配制
(1)青霉素標準母液:稱取純氨芐青霉素鈉鹽0.06 g,溶解在100.0 mL、0.2 mol/L、pH為6的磷酸鹽緩沖溶液中,制成1 000.00 U/mL的青霉素標準工作溶液,冷藏存放。
(2)青霉素標準溶液:按照表1配成不同濃度的青霉素標準溶液。

表1 不同濃度青霉素標準溶液的配制
1.4.6 制備生測平板
在超凈工作臺上,以瓊脂培養基為底,取實驗用菌懸液 1.0 mL,加入未凝固(一般細菌48~50 ℃,芽孢菌60 ℃)的NA培養基中,取約20.0 mL NA注入雙碟上層,參考劑量和其他劑量點各1皿,重復2次,用滅菌1.0 mL移液槍槍頭打孔(4個/皿,間距相等),用陶瓷蓋覆蓋,放置20~30 min,備用。
1.4.7 滴加抗生素溶液
每孔滴加0.2 mL,注意滴加溶液間隔不可過長,溶液的擴散時間不同會影響測定結果。滴加完畢后,用陶瓷蓋覆蓋雙碟,平穩置于雙碟托盤內,雙碟疊放不可超過3個,以免受熱不均,影響抑菌圈大小,將制好的雙碟以水平方向平穩移入37 ℃恒溫培養箱培養24 h[7]。
1.4.8 測定抑菌圈的直徑大小
用直尺或游標卡尺測量抑菌圈的直徑,以毫米為單位,誤差不超過0.1 mm,記錄,并以青霉素標準溶液濃度為縱坐標、抑菌圈直徑的校正值為橫坐標來繪制標準曲線。
1.4.9 發酵液效價的測定
將發酵液離心,取上清液原液進行生測,每個被測樣品進行3次重復測試,測定方法同標準曲線的測定[8]。在37 ℃下培養24 h,測量抑菌圈的直徑并記錄在表中。
1.4.10 發酵液效價的計算
求校正值,校正發酵液的值,檢查標準曲線值,即發酵原液的效價(如發酵液經過稀釋的效價值×稀釋倍數即發酵液原液的效價值)[9]。
2 結果與分析
2.1 青霉素標準曲線繪制
每一稀釋度做2次重復實驗,首先算出實驗組平均抑菌圈直徑,其次算出各組100.00 U/mL青霉素抑菌圈直徑平均值及8套平皿中100.00 U/mL青霉素抑菌圈直徑總平均值,以 100.00 U/mL抑制圈的總平均值來校正各組的100.00 U/mL抑制圈平均值,求得各組的校正數值,最后以各組100.00 U/mL抑制圈的校正數值來校正各單位濃度的抑制圈直徑,獲得各組抑制圈的校正值。本次實驗數據驗證和實踐總結表明,青霉素濃度越高,抑菌圈直徑越大,60.00 U/mL青霉素無抑菌圈,可能是因為濃度太低,起不到抑菌、殺菌的效果。以標準青霉素效價為縱坐標、抑菌圈直徑的校正值為橫坐標來繪制標準曲線,結果如圖1所示。
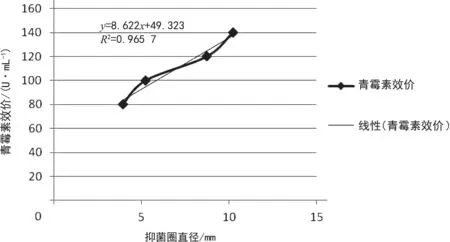
圖1 青霉素標準曲線
2.2 發酵液效價測定
將發酵液離心,取上清液進行生測,做3次重復實驗,將青霉素標準測定液(100.00 U/mL)在3套培養皿中抑菌圈的平均值與在曲線上100.00 U/mL抑菌圈的直徑相比,求得其校正數值-0.812 5 mm。運用此校正值校正被檢發酵液抑菌圈直徑,求得其校正值10.217 5 mm,檢查標準曲線值,將此校正值在標準曲線上查得被檢發酵液青霉素濃度為137.42 U/mL。
3 總結與討論
研究了青霉素的發酵工藝,學習了發酵液的效價測定,實驗數據表明,青霉素能對細菌起到有效殺滅作用[10]。通過斜面菌種制作、種子培養、發酵培養、發酵液預處理,再進行青霉素效價測定,測得抑菌圈大小并判斷青霉素對細菌的抑制作用。結果表明,青霉素濃度越高,抑菌作用越好。發酵過程的控制和培養基的配制都至關重要,對發酵工藝的優化在今后的實驗中也可深入進行[11],做到減輕污染、提高效率。在實驗中,注意嚴謹、規范地在超凈工作臺上操作,避免雜菌的污染導致結果產生誤差或實驗失敗。

