miR-223靶向RhoB抑制Aβ1-42誘導的海馬神經元凋亡
張峪涵,付暉,劉翠娟,廖成鉅,羅昊棟
(1.東莞市松山湖中心醫院 神經內科,廣東 東莞 523326; 2. 廣東醫科大學 藥學院,廣東 東莞 524023)
阿爾茨海默病(Alzheimer’s disease,AD)是一種與衰老有關的神經退行性疾病[1]。其主要病理特征是相關腦區中神經纖維纏結和由β-淀粉樣蛋白(β-amyloid,Aβ)組成的老年斑沉積[2]。Aβ寡聚體沉積具有神經毒性,可促發神經元凋亡,是引發AD的重要機制之一[3]。微小RNA(miRNAs)是一類長21~23個核苷酸的內源性非編碼小分子RNA,廣泛存在于人類大腦組織中,與神經元凋亡、增殖、分化等有關[4]。miR-223是miRNA的一種,因在很多惡性腫瘤或炎癥組織中呈低表達而受到普遍關注[5]。2020年,Serpente等[6]通過研究AD進展過程中miRNAs網絡的變化發現,與健康人群相比,miR-223在AD患者腦脊液和血液樣本中表達量顯著下調。但是,miR-223的特異性作用機制,如AD的相關靶點和通路尚未完全清楚。本研究以寡聚態Aβ1-42誘導的海馬神經元為研究模型,通過調控miR-223和RhoB的表達來觀察其對神經元細胞凋亡的影響,為AD的預防或治療提供新的作用靶點。
1 材料與方法
1.1 實驗動物
SPF級新生1 d的SD雄性大鼠12只,購自山西省腫瘤研究所。實驗動物許可證號:SCXK(晉)2017-0001。
1.2 主要儀器及試劑
CO2細胞培養箱購自美國Forma Scientific公司,倒置顯微鏡購自日本Olympus公司,流式細胞儀購自美國 Beckman Coulter公司,0.25%胰酶/EDTA、Aβ1-42、多聚右旋賴氨酸購自Sigma公司,PCR引物由上海生工生物工程技術有限公司合成,Bcl-2單克隆抗體、Bax單克隆抗體、caspase-3單克隆抗體、RhoB單克隆抗體、β-actin單克隆抗體和二抗均購自賽信通(上海)生物試劑有限公司, miR-223 mimics、mimics control、si-RhoB和si-con均購自百奧邁科生物技術有限公司,轉染試劑Lipofectamine2000購自上海陽光生物科技有限公司。
1.3 方法
1.3.1 海馬神經元細胞分離和培養 用體積分數75%乙醇消毒SD大鼠,腹腔注射10%水合氯醛(5 ml·kg-1)麻醉后,斷頭取全腦,在無菌條件下分離海馬組織。本研究得到了醫院倫理委員會的批準。將海馬組織置于預冷磷酸鹽緩沖液中,去除血管和筋膜后切成1 mm3小塊。用含15% 胎牛血清的DMEM/F12懸浮海馬神經元。以1 000 r·min-1離心5 min后,將海馬神經元重新分散于DMEM/F12(15%FBS)中,密度為3× 105ml-1。將海馬神經元接種至多聚賴氨酸預先包被的6孔細胞培養板中,置于37 ℃、體積分數5%CO2培養箱中孵育24、72 h。后更換為含有阿糖胞苷(質量濃度為2.5 mg·L-1)的新鮮培養基代替(阿糖胞苷能抑制成纖維細胞和膠質細胞的生長)。連續培養海馬神經元7 d,倒置顯微鏡下觀察其形態學變化。
1.3.2 海馬神經元細胞免疫熒光染色 將海馬神經元接種于6孔板中,孵育7 d后用4%多聚甲醛固定20 min。10%山羊血清白蛋白阻斷非特異性結合位點30 min,4 ℃條件下用小鼠抗大鼠微管相關蛋白(microtubule-associated protein-2,MAP-2)單克隆抗體孵育12 h,加入異硫氰酸熒光素(FITC)標記的山羊抗鼠IgG二級抗體室溫培養2 h。用Hoechst 33258(50 g·ml-1)逆染1 h。清洗3次,干燥過量液體后倒置熒光顯微鏡觀察海馬神經元。在同一視野內,用不同的激發光分別獲得神經元和神經元核的熒光圖像。使用Image Pro 6.0軟件測量每個視野海馬神經元的最長神經突長度。
1.3.3 細胞轉染 將生長狀態良好的神經元細胞隨機分為空白組(不作任何轉染處理)、陰性組(轉染miR-NC)、miR-223-m組(轉染miR-223 mimics)、miR-223-m+LV組(轉染miR-223 mimics+慢病毒骨架)、miR-223-m+LV-RhoB組(轉染miR-223 mimics+RhoB過表達載體)。參照脂質體 LipofectamineTM2000 說明書操作步驟轉染細胞。轉染后繼續培養24 h,用于后續試驗。
1.3.4 寡聚態Aβ1-42的制備及應用 參考文獻[4]制備寡聚態Aβ1-42:取1 mg凍干粉Aβ1-42經有機溶劑HFIP室溫孵育1 h處理后真空風干,用少量DMSO助溶后溶解于無血清的DMEM-F12低糖培養基中,配成100 μmol·L-1濃度的母液,4 ℃孵育24 h后,每組轉染后的細胞加入Aβ1-42寡聚肽片段30.0 μmol·L-1孵育48 h。
1.3.5 MTT法檢測細胞存活率 將密度為1×103ml-1海馬神經元接種于96孔板上,每孔接種100 μl(含2.5 mg·L-1阿糖胞苷)。培養24 h后,用不同濃度的Aβ1-42(0、10、20、30、40、50 μmol·L-1)誘導海馬神經元。以0 μmol·L-1Aβ1-42為陰性對照。培養48 h后加入20 μl·孔-1MTT溶液(5 mg·ml-1),37 ℃培養4 h,加入150 μl二甲基亞砜,振動10 min,促進紫晶完全溶解。在微板閱讀器上檢測每個孔490 nm的吸光度(OD490 nm)值,計算每組海馬神經元的存活率。
1.3.6 流式細胞術檢測細胞凋亡情況 每組轉染后的細胞加入Aβ1-42寡聚肽片段30.0 μmol·L-1孵育48 h。將各組細胞用0.25%的胰蛋白酶消化后,離心收集,加入200 μl緩沖液制備細胞懸液。分別加入5 μl 的Annexin V-/FITC和PI混合均勻,室溫避光孵育15 min后,再次加入200 μl緩沖液,置于流式細胞儀觀察細胞凋亡情況。
1.3.7 雙熒光素酶報告基因檢測 構建 WT-RhoB(含RhoB 3′UTR片段)和MUT-RhoB(含RhoB 3′UTR片段突變體)的熒光素酶報告載體,采用LipofectamineTM2000分別將WT-RhoB及MUT-RhoB與miR-223 mimics、miR-223 inhibitor或miR-NC共轉染。轉染后培養24 h,按雙熒光素酶報告基因檢測試劑盒技術說明書操作,記錄螢火蟲熒光素酶和海腎熒光素酶激發值,以兩者的比值評價RhoB基因的激活程度。
1.3.8 qRT-PCR實驗 用TRIzol液裂解細胞后,提取總的RNA。取1 μg RNA按反轉錄試劑盒說明書用于合成cDNA。取1.0 μg cDNA用Fast Start Universal SYBR Green Master mix試劑盒進行PCR擴增,預變性95 ℃ 10 min,隨后40個循環(變性95 ℃ 10 s,退火60 ℃ 20 s,延伸72 ℃ 34 s)。miR-223引物:正向5′-TCCGAAGTGTACCTCAAC-3′,反向5′-GTGCAGGGTCCGAGGT-3′。U6 mRNA引物:正向5′-CTCGCTTCGGCAGCACATATACT-3′,反向5′-ACGCTTCACGAATTTGCGTGTC-3′。RhoB mRNA引物:正向5′-AGTAAGGACGAGTTCCCCGA-3′,反向5′-GGTGAAGGGCGAACATCTGA-3′。GAPDH引物:正向5′-GGTGCTGAGTATGTCGTGGAGT-3′,反向5′-CAGTCTTCTGAGTGGCAGTGATG-3′。miR-223表達歸一化為U6, RhoB mRNA表達歸一化為GAPDH。采用2-ΔΔCt法對數據進行處理。
1.3.9 Western blotting實驗 將細胞加入適量RIPA裂解液裂解后,提取總蛋白,并用BCA法測定神經元中的蛋白量。提取的蛋白與loading buffer充分混合后,置于100 ℃煮沸5 min,變性后進行蛋白質電泳。電泳后用轉膜儀將蛋白轉移至PVDF膜上,脫脂奶粉封閉2 h后,加入Ⅰ抗[caspase-3(1∶500)、Bcl-2(1∶1 000)、Bax(1∶1 000)、RhoB(1∶500)、GAPDH(1∶1 000)]4 ℃ 孵育過夜。次日,Ⅱ抗37 ℃孵育2 h后顯影。
1.4 統計學處理
應用SPSS 21.0軟件包進行數據分析處理,所有數據均以平均值±標準差表示。兩組間比較采用雙尾t檢驗;多組間比較采用方差分析或單因素重復測量的方差分析,然后采用SNK-q法進行兩兩比較。P<0.05為差異有統計學意義。所有實驗至少重復3次。
2 結 果
2.1 海馬神經元分離培養和鑒定
培養4~6 h,大部分海馬神經元粘連形成突觸。相鄰神經細胞突觸間的神經網絡在3~7 d形成。海馬神經元分布均勻,胞體完全伸展,呈錐體狀,有長軸突和1~2個樹突。用神經元特異性標志物(MAP-2)進行熒光標記后,顯示海馬神經元純度達(94.2±3.6)%,可滿足進一步實驗的要求(圖1)。

A. 接種后3 d、4~6 h、7 d時海馬神經元形態學觀察; B. 免疫熒光雙染法觀察大鼠海馬神經元特征
2.2 Aβ1-42對海馬神經元存活率的影響
經MTT法檢測,不同濃度的Aβ1-42(0、10、20、30、40、50 μmol·L-1)誘導海馬神經元48 h時,隨著作用濃度的升高,細胞存活率逐漸降低。當濃度超過30 μmol·L-1時,海馬神經元的活力明顯受到抑制,存活率<80%(F=118.530,P<0.05)(圖2A)。
2.3 Aβ1-42對海馬神經元miR- 223和RhoB表達的影響
經qRT-PCR和Western blotting法檢測,不同濃度的Aβ1-42(0、10、20、30、40、50 μmol·L-1)誘導海馬神經元48 h時,隨著作用濃度的升高,細胞miR-223相對表達量逐漸降低,同時RhoB蛋白表達逐漸升高(F值分別為39.849、77.243,均P<0.05,圖2B和圖2C)。但是當Aβ1-42≥30 μmol·L-1時,細胞miR-223表達變化不是很明顯,差異無統計學意義(F=1.983,P>0.05),因此選擇Aβ1-4230μmol·L-1用于后續實驗。
2.4 過表達miR- 223對Aβ1-42誘導海馬神經元細胞凋亡的影響
經qRT-PCR法檢測,miR-223-m組細胞miR-223相對表達量較空白組和陰性組升高(F=68.215,P<0.05);而與miR-223-m組及miR-223-m+LV組相比,miR-223-m+LV-RhoB組RhoB mRNA相對表達量也升高(F=129.650,P<0.05),說明轉染成功,可用于后續實驗。經流式細胞術法檢測,經Aβ1-42寡聚肽片段30.0 μmol·L-1孵育48 h后,與空白組及陰性組相比,miR-223-m組細胞凋亡率降低;而與miR-223-m組及miR-223-m+LV組相比,miR-223-m+LV-RhoB組細胞凋亡率升高(F=11.915,P<0.05)(圖3)。
2.5 過表達miR- 223對海馬神經元RhoB蛋白和凋亡相關蛋白表達的影響
Western blotting法檢測,空白組、陰性組、miR-223-m組、miR-223-m+LV組和miR-223-m+LV-RhoB組RhoB、Bcl-2、Bax、caspase-3蛋白表達量比較,差異均有統計學意義(F值分別為27.815、18.790、21.331、7.843,P<0.05);與空白組及陰性組相比,miR-223-m組細胞RhoB、Bax和caspase-3蛋白表達降低,同時Bcl-2蛋白表達升高(P<0.05),而與miR-223-m組及miR-223-m+LV組相比,miR-223-m+LV-RhoB組細胞RhoB、Bax和caspase-3蛋白表達升高,同時Bcl-2蛋白表達降低(P<0.05)。見圖4。
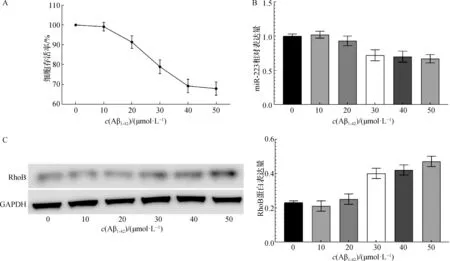
A. MTT法檢測細胞存活情況;B. qRT-PCR法檢測細胞miR-223相對表達量;C. Western blotting法檢測細胞RhoB蛋白表達情況
2.6 miR- 223與RhoB的靶向關系
通過miRcode預測到RhoB 3′UTR存在2個與miR-223相結合的位點。雙熒光素酶活性檢測結果顯示,與miR-NC組相比,miR-223 mimics分別和含有兩個假定的miR-223結合序列的熒光素酶構建的RhoB 3′-UTR共轉染后,熒光活性顯著降低(F=165.73,P<0.05),同樣,miR-223 inhibitor與RhoB 3′-UTR共轉染后,熒光活性顯著升高(F=89.435,P<0.05),表明它們之間存在直接相互作用。見圖5。
3 討 論
隨著近年來對AD發病機制的深入研究,Aβ寡聚體觸發的神經元細胞凋亡引起了大量學者的關注[7]。據報道,Aβ1-42主要用于建立AD細胞模型。本研究原代海馬神經元被成功地分離和培養,而經Aβ1-42處理后可抑制海馬神經元活動,并以劑量依賴性方式促進其凋亡。綜合考慮細胞存活率、miR-223表達量的差異,選用30 μmol·L-1的Aβ1-42以成功地誘導AD細胞模型。miR-223在Aβ1-42轉導的海馬神經元中表達下調,同時RhoB表達上調。進一步的深入研究表明,miR-223通過靶向抑制RhoB蛋白的表達,阻止了海馬神經元的凋亡。
RhoB作為GTPase信號分子家族中的一個較為獨特的分子,通過與下游靶蛋白相互作用,進而誘導多種細胞反應,包括調節肌動蛋白骨架和基因轉錄等[8]。RhoB與RhoA及RhoC一起,共同構成Rho亞家族。Rho亞家族各成員是細胞分裂、細胞遷移、傷口愈合或免疫監視等多種細胞和生理過程中的關鍵介質,其功能失調與不同的人類疾病有關[9]。這3個蛋白質有高度的相似性(87%以上的氨基酸序列具有同源性)。但是與RhoA及RhoC相反,RhoB是由一個外顯子編碼的蛋白分子,它被認為是在脊椎動物進化過程中從RhoA反向拷貝整合而來[10]。目前關于RhoB研究最廣泛的是在腫瘤領域。楊鵬春等[11]通過細胞實驗證實,miR-223可能靶向作用于RhoB,進而影響結直腸癌的發展及轉移。在許多類型的細胞中,RhoB基因表達是由損壞的DNA刺激引起的,說明RhoB可能參與了DNA 損傷信號機制的某些下游水平,進而成為細胞死亡效應器或死亡信號修飾器。他汀類藥物與降低AD的發生風險有關,其可能機制在于抑制類異戊二烯途徑,調節小GTP酶RhoA、B和C分子的活性[12]。因此,小分子RhoB可能是中樞神經系統病理反應最重要的介導因子之一。在中毒或創傷性刺激下,RhoB在神經元中的表達量會迅速上調,RhoB有望成為神經退行性疾病嚴重性的重要預測分子[13],但是目前關于RhoB在AD進展中的作用尚不明確。
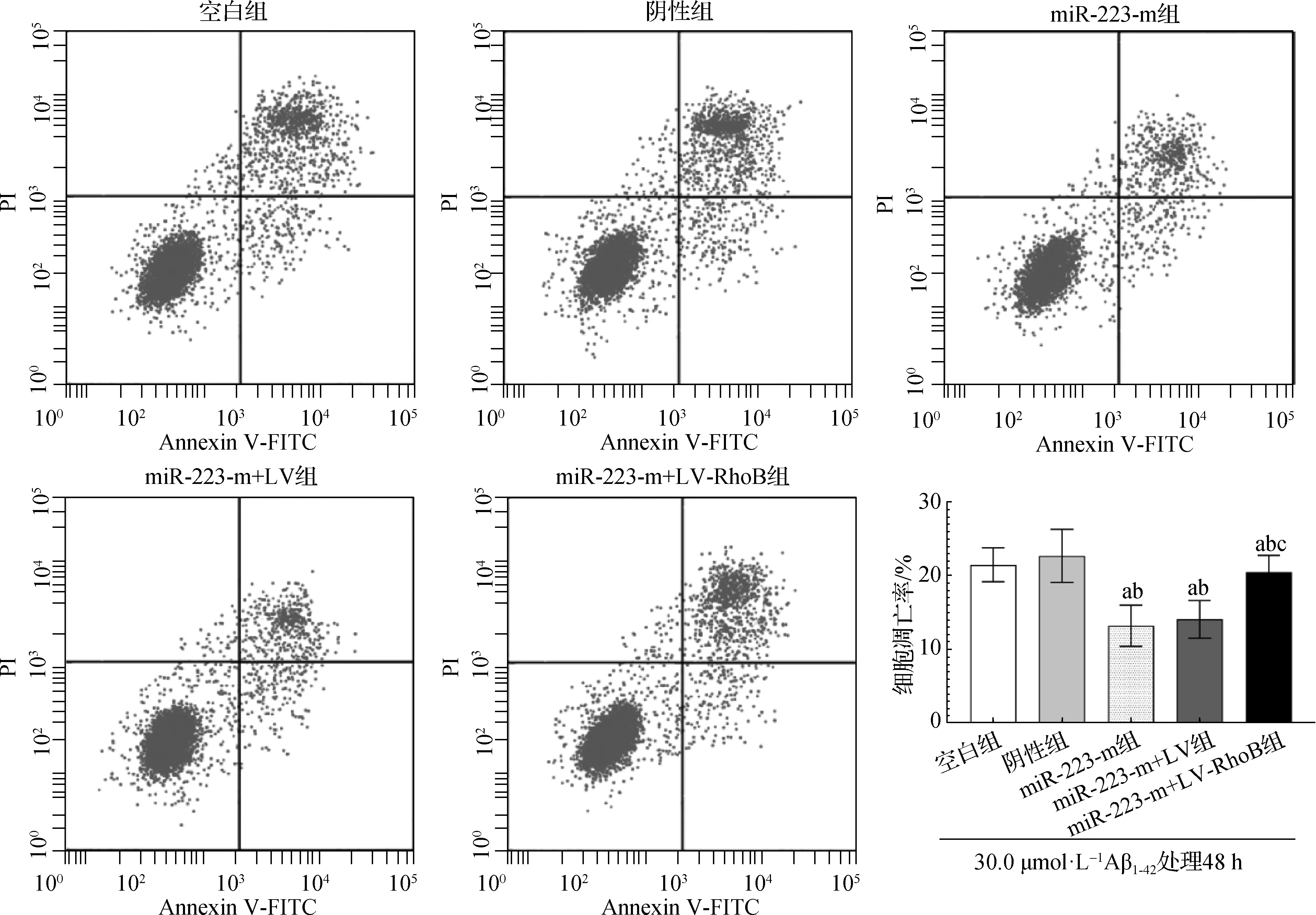
a 與空白組相比,P<0.05; b 與陰性組相比,P<0.05; c 與miR-223-m組及miR-223-m+LV組相比,P<0.05

a 與空白組相比,P<0.05; b 與陰性組相比,P<0.05; c 與miR-223-m組相比,P<0.05
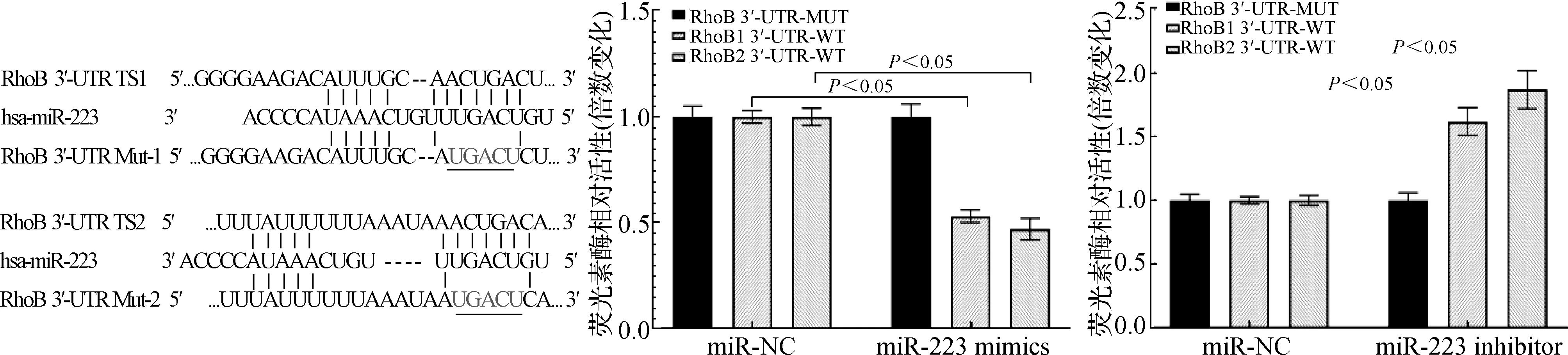
圖5 miR-223和RhoB存在靶向結合關系
通過miRcode預測到RhoB 3′UTR存在2個與miR-223相結合的位點;雙熒光素酶報告基因分析也進一步證實了miR-223對于RhoB表達具有一定的靶向調控作用。miR-223參與多種細胞病理過程的調節,如癌癥、自身免疫性疾病和炎癥性疾病。既往miR-223被認為是NLRP3炎癥小體的陰性調節因子。慢性炎癥體激活為神經退行性疾病的一個基本特征,是由包括淀粉樣β蛋白和α-突觸核蛋白在內的錯誤折疊的蛋白質聚集體引起的,導致促炎癥細胞因子的分泌和神經炎癥的傳播[14]。Mancuso等[15]也通過人體血液樣本證實,與健康人群相比,miR-223在AD患者、帕金森患者、輕度認知功能障礙者人群血清中表達量降低。miR-223有望成為鑒別診斷神經退行性疾病的潛在非侵入性生物標志物。在本研究miR-223對Aβ1-42誘導的海馬神經元生物學行為的影響結果提示,miR-223通過抑制RhoB的表達,進而增加海馬神經元活性,并抑制其凋亡,說明miR-223/RhoB軸在損傷神經元修復和再生中具有重要作用,但本研究的不足之處是還未探討RhoB是如何調控Bax、Bcl-2和caspase-3蛋白的表達量,進而誘導細胞凋亡的。
綜上所述,本研究結果表明,Aβ1-42誘導的海馬神經元中miR-223表達下調,同時RhoB表達下調。miR-223通過靶向抑制RhoB表達阻止AD海馬神經元的凋亡。

