阻塞性睡眠呼吸暫停綜合征患者左室幾何構型與血漿同型半胱氨酸的相關性
馮曉麗 水 雯 張 勇 田 云 康彩虹 崔 桐 王 健
阻塞性睡眠呼吸暫停綜合征(obstructive sleep apnea syndrome,OSAS)是由于上呼吸道完全或不完全阻塞,導致睡眠期間反復出現呼吸暫停和低通氣的臨床綜合征[1]。該病與多系統并發癥尤其是心血管系統疾病密切相關,左室幾何構型異常是較常見的心臟改變[2]。異常左室幾何構型嚴重影響心肌的收縮及舒張功能,是心血管疾病發生和預后的獨立影響因素[3]。研究[4]表明OSAS患者血漿同型半胱氨酸(homocysteine,Hcy)表達水平較高,且隨著病情的加重而升高,認為血漿Hcy的升高可能是發生OSAS相關性心血管疾病的重要危險因素之一。基于此,本研究探討了OSAS患者血漿Hcy與左室幾何構型的相關性,旨在為臨床干預和治療提供依據。
資料與方法
一、研究對象
選取2019年7月至2020年1月于我院呼吸內科就診的192例OSAS患者,其中男145例,女47例,年齡20~69歲,平均(46.96±12.57)歲。OSAS診斷標準依據2011年修訂的《阻塞性睡眠呼吸暫停低通氣綜合征診治指南》[5],即每晚7 h睡眠期間呼吸暫停及低通氣反復發作次數≥30次,或呼吸暫停低通氣指數(AHI)≥5次/h,伴有打鼾、睡眠呼吸暫停、白天嗜睡等癥狀。排除標準:①患有心肌梗死、慢性阻塞性肺疾病及其他肺源性心臟病、心力衰竭、心肌病、心律失常、糖尿病、瓣膜疾病或心電圖表現可能與心肌缺血有關的疾病;②曾接受相關治療;③從事夜班工作者及常規超聲心動圖檢查提示左心收縮功能異常[左室射血分數(LVEF)≤50%]。另選性別、年齡與之匹配,血糖、血脂、胸片、心電圖和多導睡眠呼吸監測等檢查均正常的健康成人30例作為對照組,其中男23例,女7例,年齡26~66歲,平均(48.60±10.52)歲。本研究經我院醫學倫理委員會批準,受試者均知情同意。
二、儀器與方法
1.常規超聲心動圖檢查及分組:使用Philips EPIQ 7C彩色多普勒超聲診斷儀,S5-1探頭,頻率1~5 MHz。受試者平靜呼吸,取左側臥位或平臥位,同步連接心電圖。參照美國超聲心動圖協會標準[6],M型超聲于胸骨旁左室長軸切面二尖瓣腱索水平測量左室舒張末期內徑(LVEDd)、舒張期室間隔厚度(IVSd)和左室后壁厚度(LVPWd),并計算左室質量指數(LVMI)和相對室壁厚度(RWT)。組織多普勒于心尖四腔心切面將取樣點置于房室交界處,測量二尖瓣環舒張早期和舒張晚期峰值流速(Em、Am),計算二者比值(Em/Am);于心尖四腔心及兩腔心切面采用Simpson法計算LVEF。以上參數均測量3個以上心動周期,取其平均值。參考盛媛媛等[7]研究中男性LVMI臨界值為108 g/m2,RWT臨界值為0.51;女性LVMI臨界值為99 g/m2,RWT臨界值為0.49,根據左室幾何構型將192例OSAS患者分為4組:①正常構型(NG)組82例,LVMI和RWT均在正常范圍;②向心性重構(CR)組47例,LVMI在正常范圍,RWT>臨界值;③向心性肥厚(CH)組34例,LVMI和RWT>臨界值;④離心性肥厚(EH)組29例,LVMI>臨界值,RWT在正常范圍。
2.臨床資料采集:測量并記錄受試者的身高、體質量、血壓、心率、頸圍、腹圍、臀圍,計算體質量指數(BMI)。
3.多導睡眠呼吸監測:使用德國施曼諾V系列多導睡眠分析儀,對所有受試者行7 h以上多導睡眠監測,同時記錄AHI、夜間最低血氧飽和度(L-SaO2)、平均血氧飽和度(M-SaO2)、血氧飽和度低于90%的時間占總睡眠時間的百分比(T90)。根據美國睡眠醫學會成人睡眠呼吸暫停的診斷標準[8]將OSAS患者分為正常和輕度、中度、重度OSAS。
4.實驗室檢查:受試者均于行多導睡眠呼吸監測的次日晨起空腹靜脈采血檢測血糖、血脂及血漿Hcy水平。所有標本均嚴格按照使用說明書進行操作,檢測2次取平均值。
三、統計學處理
應用SPSS 20.0統計軟件,計量資料均行Kolmogorov Smirnov正態性檢驗,服從正態分布者以±s表示,組間比較采用單因素方差分析,多重比較采用LSD-t檢驗。計數資料以例或百分比表示,行χ2檢驗。血漿Hcy與臨床變量的相關性分析采用Spearman相關分析法;多變量的相關性分析采用多元線性回歸。P<0.05為差異有統計學意義。
結 果
一、各組臨床資料、實驗室指標及多導睡眠呼吸檢測參數比較
各組性別、年齡、心率、頸圍、臀圍、舒張壓、膽固醇、血糖比較差異均無統計學意義,BMI、腹圍、收縮壓、甘油三酯、血漿Hcy比較,差異均有統計學意義(均P<0.05)。與對照組比較,CR組、CH組、EH組BMI、腹圍、收縮壓、甘油三酯、血漿Hcy均增加,NG組甘油三酯增加,差異均有統計學意義(均P<0.05)。OSAS各組間BMI、腹圍、收縮壓、甘油三酯、AHI、T90、M-SaO2、L-SaO2比較,差異均無統計學意義。見表1。
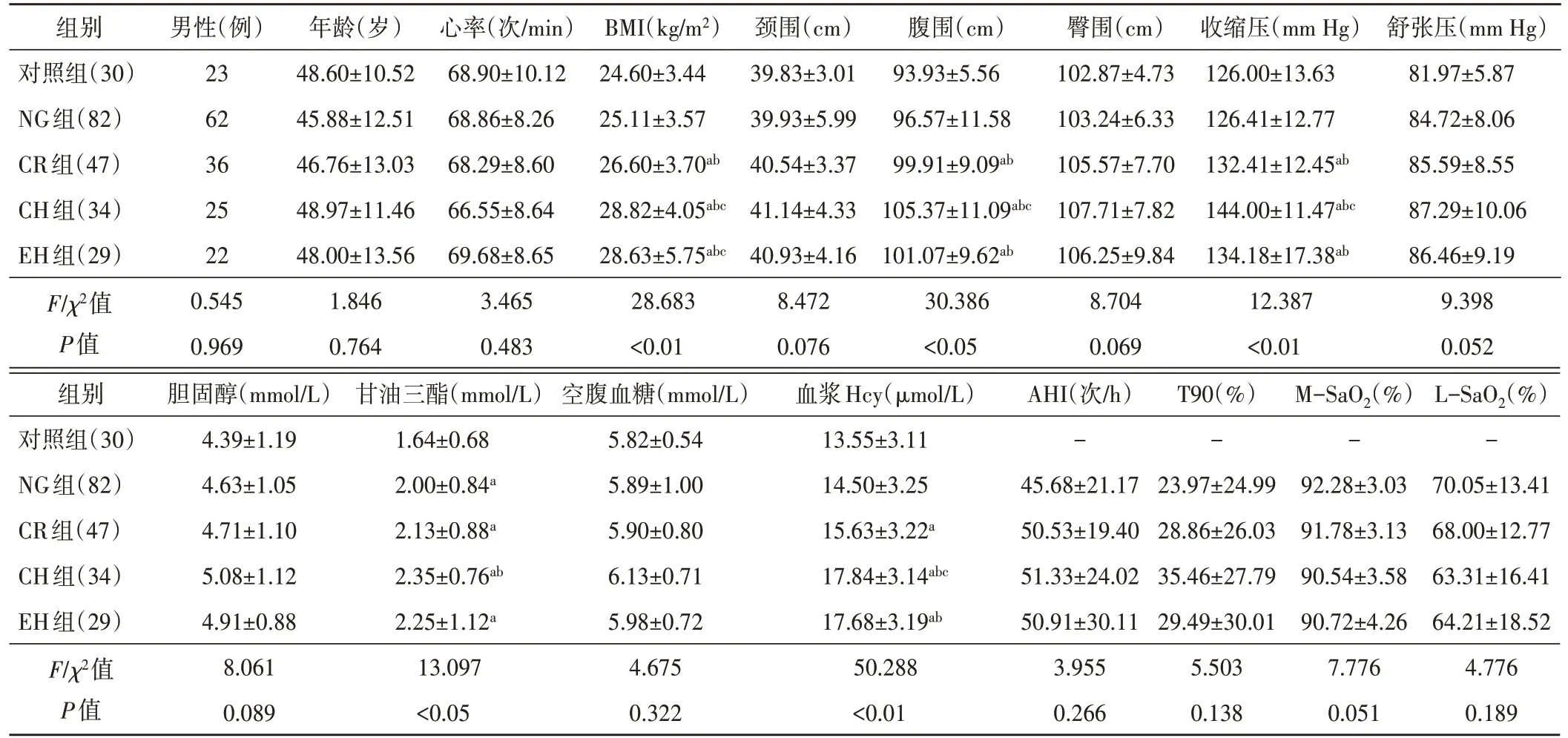
表1 各組臨床資料、實驗室指標及多導睡眠呼吸監測參數比較
二、各組左室結構及功能參數比較
各組IVSd、LVPWd、LVEDd、LVMI、RWT及Em/Am比較,差異均有統計學意義(均P<0.05)。CR組、CH組、EH組IVSd、LVPWd均較對照組、NG組增高;NG組、CR組、CH組、EH組Em/Am均較對照組減低,CR組、CH組、EH組LVEDd、RWT均較NG組增加;CH組、EH組LVMI均較對照組、NG組、CR組增加,差異均有統計學意義(均P<0.05)。見表2和圖1~4。
圖1 NG組患者測量左室結構與功能參數聲像圖
表2 各組左室結構及功能參數比較(±s)
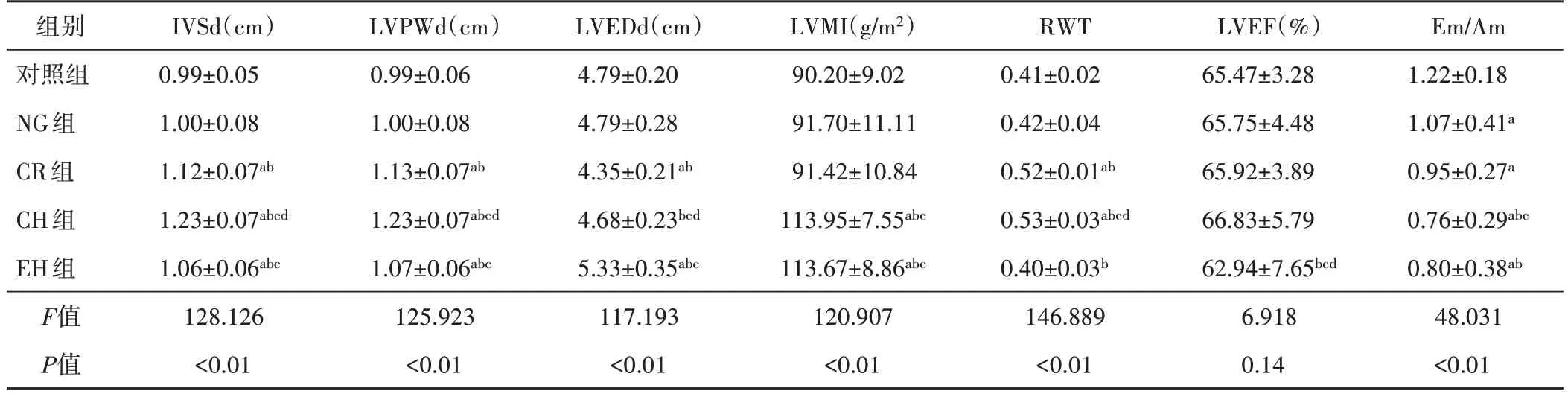
表2 各組左室結構及功能參數比較(±s)
與對照組比較,a P<0.05;與NG組比較,b P<0.05;與CR組比較,c P<0.05;與EH組比較,d P<0.05。IVSd:室間隔厚度;LVPWd:左室后壁厚度;LVEDd:左室舒張末期內徑;LVMI:左室質量指數;RWT:相對室壁厚度;LVEF:左室射血分數;Em/Am:二尖瓣環舒張早期與舒張晚期峰值流速比值
LVMI(g/m2)90.20±9.02 91.70±11.11 91.42±10.84 113.95±7.55abc 113.67±8.86abc 120.907<0.01 Em/Am 1.22±0.18 1.07±0.41a 0.95±0.27a 0.76±0.29abc 0.80±0.38ab 48.031<0.01組別對照組NG組CR組CH組EH組F值P值IVSd(cm)0.99±0.05 1.00±0.08 1.12±0.07ab 1.23±0.07abcd 1.06±0.06abc 128.126<0.01 LVPWd(cm)0.99±0.06 1.00±0.08 1.13±0.07ab 1.23±0.07abcd 1.07±0.06abc 125.923<0.01 LVEDd(cm)4.79±0.20 4.79±0.28 4.35±0.21ab 4.68±0.23bcd 5.33±0.35abc 117.193<0.01 RWT 0.41±0.02 0.42±0.04 0.52±0.01ab 0.53±0.03abcd 0.40±0.03b 146.889<0.01 LVEF(%)65.47±3.28 65.75±4.48 65.92±3.89 66.83±5.79 62.94±7.65bcd 6.918 0.14
圖2 CR組患者測量左室結構與功能參數聲像圖
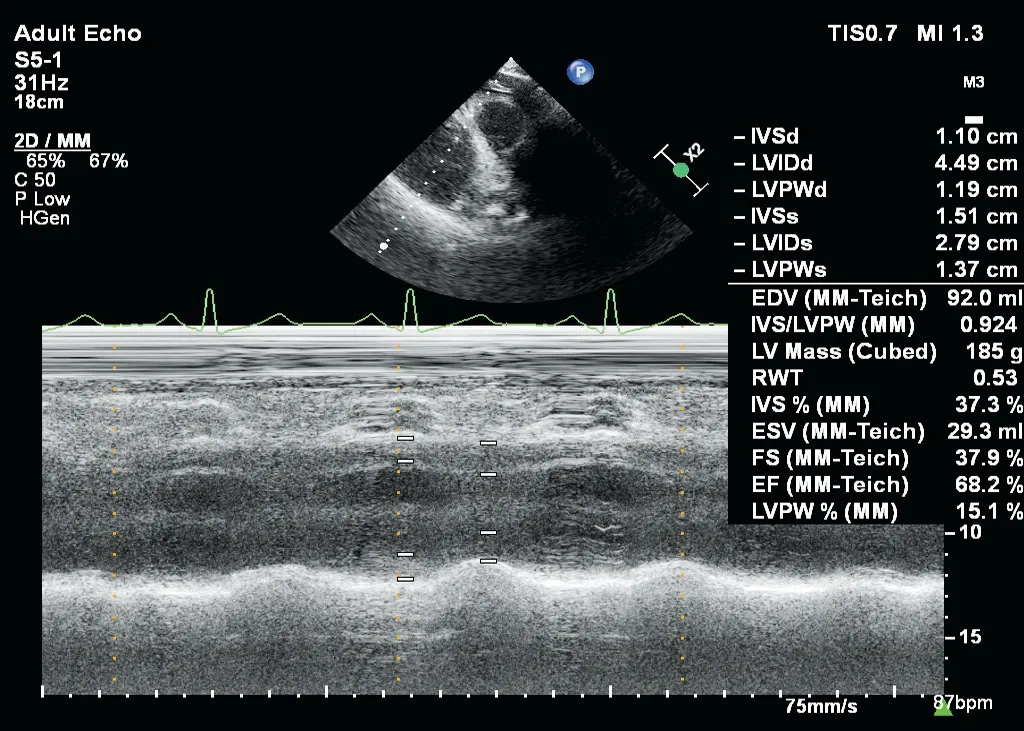
圖3 CH組患者測量左室結構與功能參數聲像圖
三、各組血漿Hcy比較
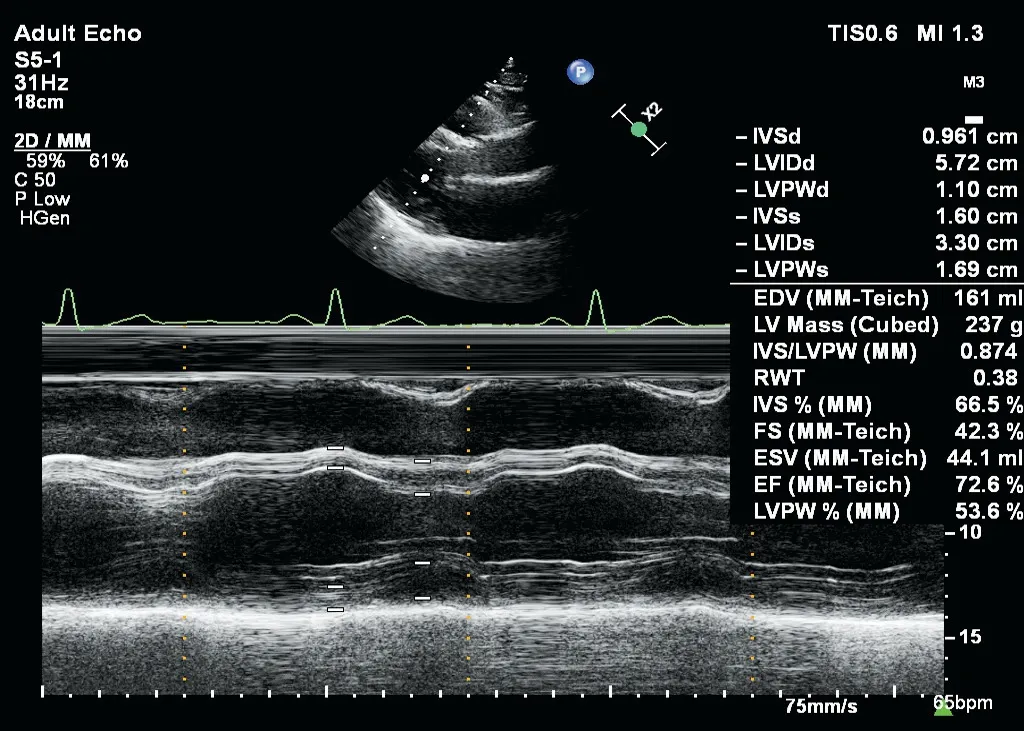
圖4 EH組患者測量左室結構與功能參數聲像圖
各組血漿Hcy比較,差異有統計學意義(P<0.01)。CH組、EH組血漿Hcy均高于對照組、NG組、CR組,CR組、CH組、EH組血漿Hcy均高于對照組,差異均有統計學意義(均P<0.05);CH組血漿Hcy高于EH組,但差異無統計學意義。
四、單因素相關性分析
單因素相關性分析表明:血漿Hcy與BMI、收縮壓、腹圍、AHI、血糖、LVMI、左室幾何構型、OSAS嚴重程度均呈正相關(r=0.277、0.253、0.249、0.233、0.184、0.418、0.461、0.163,均P<0.05),與Em/Am、LVEF均呈負相關(r=-0.248、-0.138,均P<0.05),與性別、年齡、舒張壓、頸圍、臀圍、T90、M-SaO2、L-SaO2、RWT均無相關性。見表3。
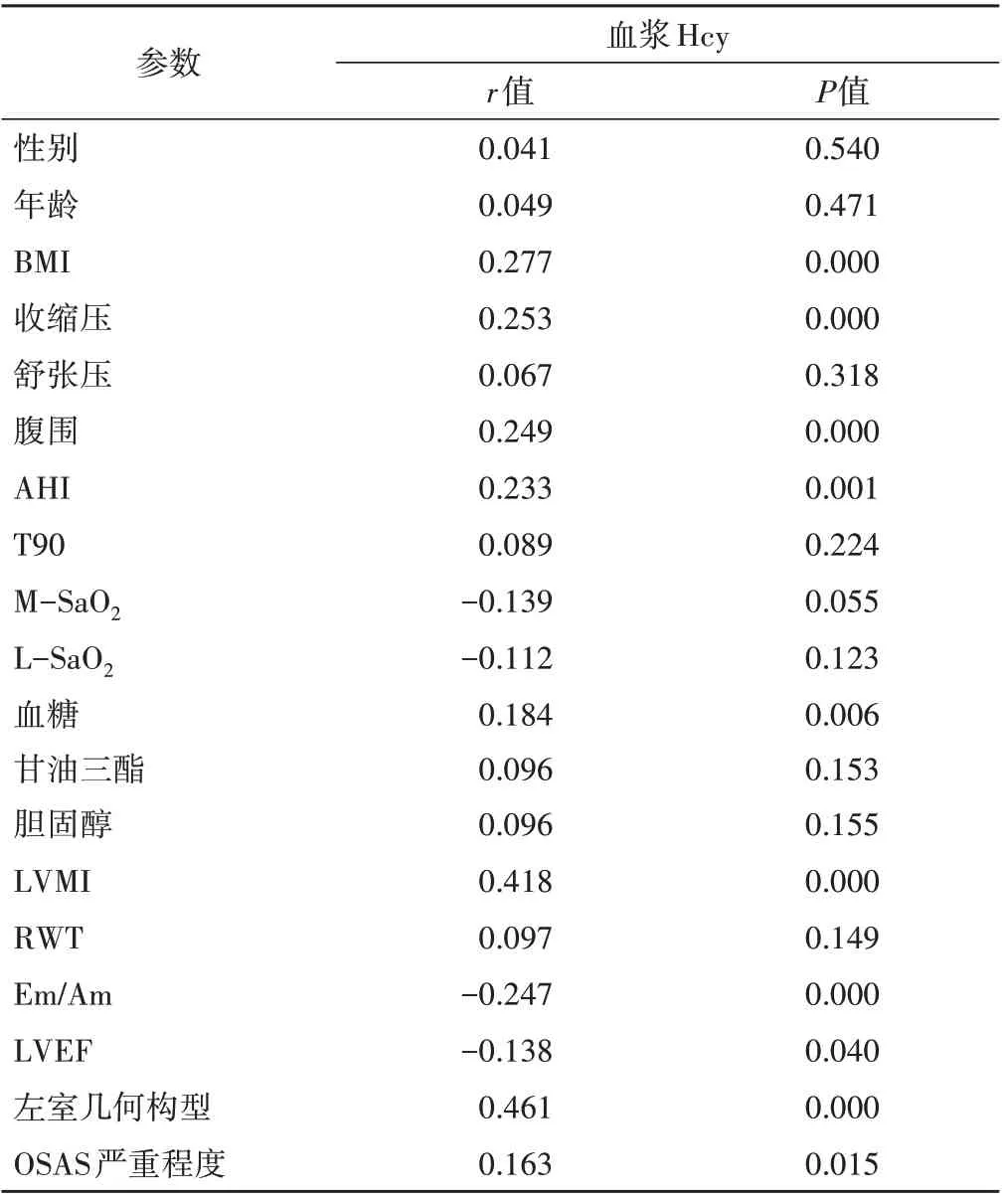
表3 血漿Hcy與各參數的單因素相關性分析
五、多元線性回歸分析
以血漿Hcy為因變量,BMI、腹圍、收縮壓、AHI、空腹血糖、LVMI、LVEF、Em/Am、左室幾何構型、OSAS嚴重程度為自變量,多元線性回歸分析結果顯示,在調整了BMI、收縮壓、腹圍、空腹血糖、Em/Am、LVEF等混雜因素后,血漿Hcy與AHI、LVMI、左室幾何構型CH、OSAS嚴重程度均獨立相關(t=3.327、2.780、2.268、2.299,P=0.003、0.007、0.045、0.023)。見表4。
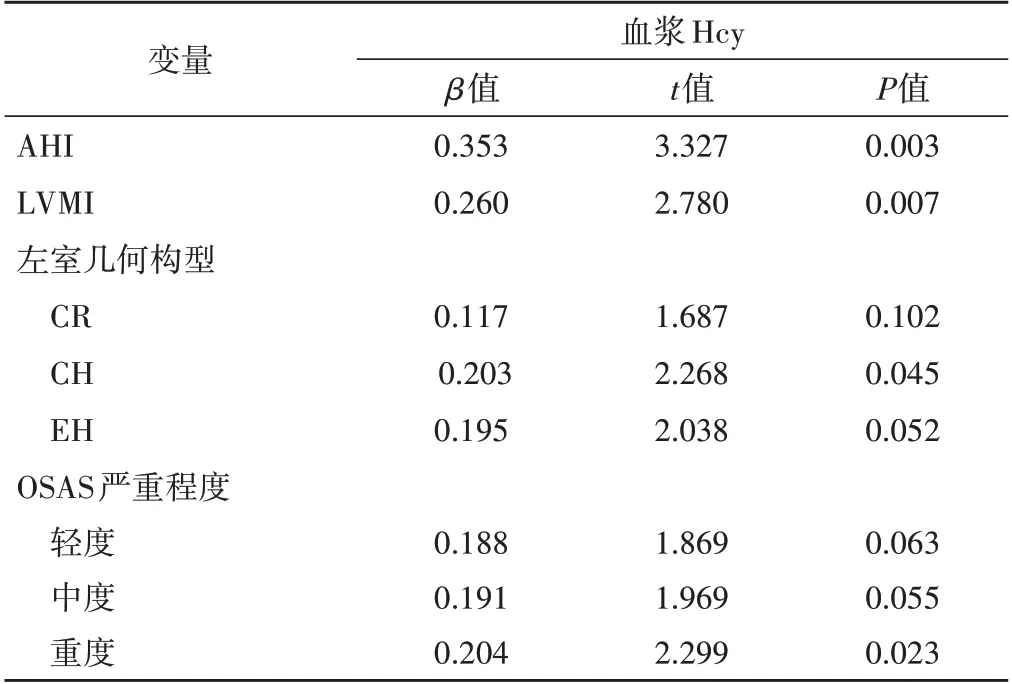
表4 血漿Hcy的多元線性回歸分析
討 論
OSAS的病理生理過程較復雜,患者睡眠期間反復發生低氧-復氧,機體內環境的穩定狀態遭受破壞,從而啟動氧化應激,促進炎癥反應,進而使交感神經興奮,導致血管內皮損傷,脂質代謝紊亂,與全身多系統、多臟器并發癥尤其是心血管疾病密切相關[9]。其中左室幾何構型的改變是心臟應對機體血流動力學的改變、內分泌系統的激活、體液激素的分泌等病理狀態的適應。異常左室幾何構型嚴重影響心臟的收縮及舒張功能,并隨著病情的發展失代償為心力衰竭,是導致OSAS患者心血管并發癥發生率和致死率升高的主要危險因素。Hcy是一種含硫氨基酸,是蛋氨酸代謝的中間產物,當體內蛋氨酸代謝出現異常,血漿Hcy生成和代謝失衡,從而導致高Hcy血癥[10]。血漿Hcy升高會加重機體氧化應激,降低機體抗氧化能力,介導機體炎癥反應和免疫反應,從而增加機體患病風險[11]。OSAS患者血漿Hcy持續升高會加重由OSAS引起的間歇性低氧所致的氧化應激損傷程度,增加了心血管并發癥的發生率和患者死亡率[12]。本研究旨在探討OSAS患者血漿Hcy與異常左室幾何構型的關系,以期為臨床干預和治療提供依據。
本研究結果顯示,與對照組比較,異常左室幾何構型(CR組、CH組、EH組)患者血漿Hcy均顯著升高,差異均有統計學意義(均P<0.05);單因素及多因素相關性分析也表明血漿Hcy與AHI、OSAS嚴重程度獨立相關,提示OSAS患者的血漿Hcy水平明顯升高,且與OSAS嚴重程度成正比。一項Meta分析[13]表明,OSAS患者血漿Hcy水平明顯高于對照組,在中重度OSAS患者中尤為明顯;Chan等[14]研究表明OSAS患者血漿Hcy與AHI呈正相關,可能與夜間低氧和高碳酸血癥對Hcy代謝過程中某些酶產生的影響有關。本研究結果與上述研究一致,提示臨床應密切關注OSAS患者的血漿Hcy水平。
本研究將OSAS組患者按照左室幾何構型分為NG、CR、CH、EH 4組,其中CH組、EH組血漿Hcy較對照組、NG組、CR組均升高,差異均有統計學意義(均P<0.05);CH組較EH組升高,但差異無統計學意義。隨著左室幾何構型改變的進展,血漿Hcy明顯升高,提示OSAS患者血漿Hcy升高加速左室幾何構型改變進程。魯軒浩等[15]動物實驗表明高血壓病伴高Hcy組大鼠激活心肌的內質網應激,其IVSd和LVPWd較單純高血壓組均明顯增厚,且依葉片治療組血漿Hcy明顯降低,減輕心肌內質網應激,則其心肌肥厚也有所緩解。高Hcy可以激活心肌細胞線粒體中的基質金屬蛋白酶,提高心肌細胞的氧化應激性,使得OSAS患者引發左室肥厚,同時導致心肌細胞收縮功能異常。但目前血漿Hcy導致左室幾何構型改變階段性的確切機制尚不清楚,有待進行深入的分子機制的研究。
本研究單因素相關性分析結果顯示,血漿Hcy與BMI、腹圍、AHI、血糖、LVMI、收縮壓、左室幾何構型均呈正相關,與LVEF、Em/Am均呈負相關。在調整了BMI、腹圍、血糖、收縮壓、LVEF、Em/Am后,多元線性回歸分析顯示OSAS患者血漿Hcy仍與LVMI、異常左室幾何構型(CH)獨立相關。提示血漿Hcy是OSAS患者左室幾何構型改變的主要影響因素之一。在OSAS的基礎上,血漿Hcy參與了左室幾何構型改變的發生、發展過程。聶亞紅等[16]發現血漿Hcy與LVMI呈獨立正相關,與E/A呈負相關,提示血漿Hcy對高血壓合并左室肥厚有一定的預測價值。李秀昌等[17]研究結果表明血漿Hcy與IVSd、LVM、LVMI均呈正相關,且這種相關性在剔除了年齡、收縮壓、舒張壓等因素后仍然存在,提示OSAS患者血漿Hcy升高可能是導致左室幾何構型異常的一個風險因子。
本研究的局限性:①作為單中心研究,樣本量有限,研究結果有待多中心、大樣本研究進一步驗證;②未能使用左室幾何構型最新分組,未來還需要以6種構型的大樣本OSAS研究進一步探討血漿Hcy對左室幾何構型改變的影響和作用;③作為橫向研究,未來需要更大的患者群體進行長期隨訪,來進行縱向研究。
綜上所述,血漿Hcy與OSAS患者異常左室幾何構型存在相關性,是OSAS患者左室幾何構型改變的主要影響因素之一。對于Hcy增高的OSAS患者,應采取預防性干預措施,并可作為減少或延緩OSAS患者心血管并發癥的潛在治療途徑,改善OSAS患者預后。

