氧化鋅和二氧化鈦納米顆粒對淡水綠藻的單一及聯合毒性研究
王壯,金世光,張帆,王德高
(1.南京信息工程大學環境科學與工程學院,南京 210044;2.大連海事大學環境科學與工程學院,遼寧 大連 116026)
伴隨著納米科技的快速發展,各種工程納米結構材料正被廣泛應用于各行各業[1?2]。值得關注的是,納米技術已逐漸滲透到農業生產鏈條的各環節,其中納米科技與農業結合最密切的領域是納米農業化學品,如納米型殺蟲劑[3]、納米肥料[4]。隨著現有納米材料市場滲透的日益增加和不間斷的新納米材料的開發,大量的工程納米顆粒(ENPs)將不可避免地釋放到大氣[5]、水[6]、土壤[7]中,成為潛在的環境污染物[8]。化學污染物通常以各種混合形式存在于環境中[9?10],因此在靠近或遠離點源處,ENPs 可能會以混合物的形式暴露于自然生態系統中。據報道,多元ENPs 混合物和各單一ENPs 均表現出截然不同的生態毒性[11?14]。因此,闡明多元混合ENPs 對生態物種的聯合毒性作用及機制,將有利于為ENPs 在自然環境中的生態效應提供更為全面的評估。
多元ENPs對生態物種的聯合毒性作用方式主要表現為拮抗作用[15?16]、協同作用[17?18]及加和作用[11,19]。不同化學成分的ENPs所組成的混合物對同一物種表現出的毒性效應也明顯不同。如CuO NPs 與CuNPs對發光細菌——費氏弧菌(Vibrio fischeri)的聯合毒性表現為拮抗作用,而CuO NPs 與Zn NPs 對費氏弧菌的聯合毒性表現為協同作用[11];類似地,CeO2NPs 與TiO2NPs 組成的二元混合物對氨氧化模式菌株——歐洲亞硝化毛桿菌(Nitrosomonas europaea)的毒性作用為拮抗作用,而CeO2NPs 與ZnO NPs 組成的二元混合物對該細菌的毒性作用為協同作用[20]。此外,具有相同成分的ENPs混合物對不同物種也會呈現出不同的毒性效應。例如Cu NPs 與ZnO NPs 對虹鱒魚(Rainbow trout)的聯合毒性為協同作用[21],而該二元混合體系對費氏弧菌[10]和生菜(Lactuca sativaL.)[22]的聯合毒性作用方式為拮抗。因此,混合組分類型和受試生物類型均是影響多元ENPs聯合毒性的重要因素。
ENPs對生態物種的毒性效應會隨著作用時間的變化而發生變化[23?24]。這意味著不同暴露時間可能會影響多元ENPs對生態物種的聯合毒性及其作用方式。然而,有關不同暴露時間對多元ENPs 聯合毒性及其作用方式的影響研究仍是空白。同時,目前的研究通常只評估單一劑量/濃度下多元ENPs 的聯合毒性作用方式,卻很少有研究從全劑量/濃度的角度評價多元ENPs的聯合毒性作用方式。本研究選取兩種廣泛應用且具有代表性的金屬氧化物ENPs(即ZnO NPs[25]和TiO2NPs[26])為研究對象,通過毒性測試,考察在不同暴露時間和全濃度下ZnO NPs 和TiO2NPs 分別對兩種淡水綠藻[斜生柵藻(Scenedes?mus obliquus)和蛋白核小球藻(Chlorella pyrenoidosa)]的單一和聯合毒性;利用毒性單位法(毒理學中用來定量研究混合物中毒物相互作用的常用方法),評估在不同暴露時間和全濃度下ZnO NPs 和TiO2NPs 分別對斜生柵藻和蛋白核小球藻的聯合毒性作用方式;應用經典混合毒理方法,預測在不同暴露時間和全濃度下ZnO NPs 和TiO2NPs 分別對斜生柵藻和蛋白核小球藻的聯合毒性。
1 材料與方法
1.1 實驗材料及測試介質
ZnO NPs 和TiO2NPs 粉體購自德國PlasmaChem公司。ZnO NPs 的純度>99%,原始粒徑約為14 nm,比表面積為(30±5)m2·g?1;TiO2NPs 為金紅石相/銳鈦礦相混合物,純度>99.5%,原始粒徑為(21±5)nm,比表面積為(50±10)m2·g?1。將測試材料的粉體分散于高純水中以制備儲備液,隨即將儲備液在可控溫度下超聲處理30 min 備用。本研究選取ZnCl2中的Zn2+作為ZnO NPs 溶解釋放的Zn2+的毒性參考物質,ZnCl2(純度>99.99%)購自上海阿拉丁生化科技股份有限公司。兩種淡水綠藻(斜生柵藻和蛋白核小球藻)的原種購自中國科學院武漢水生生物研究所。熒光探針2′,7′?二氯熒光素酶(DCFH?DA)購自上海麥克林生化科技有限公司。
實驗所用的測試介質參考國際經濟合作與發展組織(OECD)制定的藻類生長抑制實驗準則配制(附表1,掃描文章首頁OSID 碼瀏覽)[27]。在磁力攪拌器的攪拌下,將ENPs 儲備液加入測試介質中以制備其測試組懸浮液。
1.2 物理化學性質表征
使用透射電子顯微鏡對ZnO NPs 和TiO2NPs 及其二元混合物在測試介質中的形貌進行表征(TEM,JOEL 2100f,JOEL 有限公司,日本東京)。使用馬爾文激光粒度儀(ZetaSizer Nano ZS90,Malvern Instru?ments Ltd.,Worcester?shire,英國)對 ZnO NPs 和 TiO2NPs 及其二元混合物在測試介質中的零點電勢和水動力學直徑進行表征,考慮到該儀器的檢出限,本測試選取懸浮顆粒濃度為10 mg·L?1。基于經典DL?VO理論[28],通過計算顆粒間相互作用的總勢能確定測試介質中ZnO NPs和TiO2NPs及其二元混合物的懸浮穩定性。使用電感耦合等離子體質譜儀(ICP?MS,Thermo Fisher iCAP?Q,德國)確定ZnO NPs 溶解部分的濃度。
1.3 藻類生長抑制實驗
實驗期間,取一定量對數生長期的斜生柵藻和蛋白核小球藻重新懸浮于新鮮的OECD 培養基中,培養至藻細胞密度分別為3×105個·mL?1和4×105個·mL?1。淡水綠藻的培養和毒性測試條件為溫度(24±1)℃,光暗周期比12 h∶12 h,將培養基靜置于人工氣候箱中,每日搖動3 次以保證綠藻處于懸浮狀態且使得ENPs 與藻細胞均衡接觸。選取 24、48、72、96 h 的生長抑制率作為斜生柵藻的毒性終點,選取24、48、72 h的生長抑制率作為蛋白核小球藻的毒性終點。
1.4 藻細胞氧化損傷檢測
藻細胞內的活性氧(ROS)含量通過熒光探針法測定。ROS測定過程如下:取對數生長期的藻液分別暴露于ZnO NPs 和TiO2NPs 及其二元混合物中30 min,并設立對照組(未染毒納米顆粒的藻液)。為突出這兩種ENPs 對ROS 生成的顯著性誘導,選取中高效應濃度10 mg·L?1為主要研究濃度。將暴露于各測試組后的藻液在15 000 r·min?1下離心10 min,棄去上清液,加入DCFH?DA 熒光探針,使其濃度為10μmol·L?1。25 ℃下黑暗避光孵育 30 min,然后用OECD 培養基清洗藻細胞以去除松散結合的顆粒物,使用熒光分光光度計(F96PRO,上海棱光技術有限公司)檢測各測試組的熒光信號。
1.5 評估和預測聯合毒性
應用對數模型(公式1)構建ZnO NPs 和TiO2NPs及其二元混合物的濃度?反應曲線(CRCs)。通過CRCs 得到每個處理組的效應值(E)。本研究選取單一ENPs 的毒性終點時的均值效應濃度(EC50)值作為混合比率對ZnO NPs和TiO2NPs進行二元混合。
式中:C為顆粒物濃度,mg·L?1;θ代表斜率。
利用毒性單位(TU)法評估ZnO NPs 和TiO2NPs的聯合毒性作用方式,參考KIM 等[29]的方法。利用測試材料的EC50值計算其毒性單位值(U):
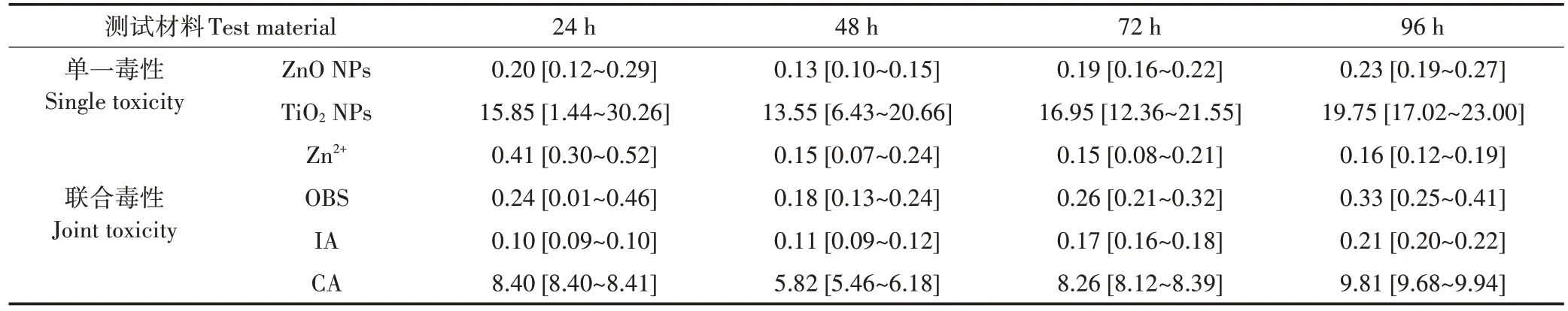
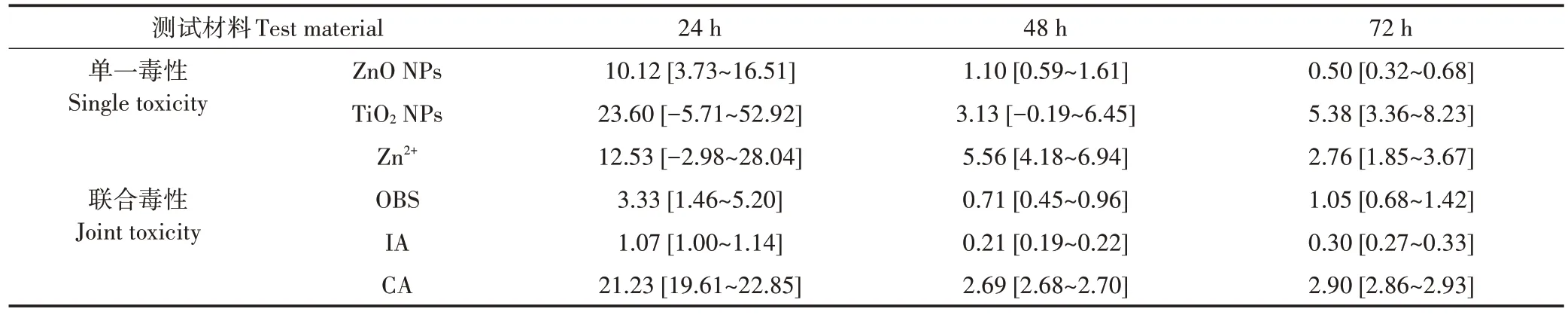
式中:Ci為某一測試材料的濃度,mg·L?1;UTotal為 ZnO NPs(UZnONPs)與 TiO2NPs(UTiO2NPs)的 TU 值之和。混合毒性作用方式通過比對由毒性數據計算而來的實驗觀察 TU 值(Uobs)和預測的 TU 值(Uexp)得到:當Uobs≈Uexp,表現為加和作用;當Uobs>Uexp,表現為協同作用;當Uobs 應用兩種經典混合毒理方法即濃度加和(CA)模型和獨立作用(IA)模型預測ZnO NPs 和TiO2NPs 的聯合毒性。CA和IA模型如公式(4)和公式(5)所示: 式中:Cxmix為混合體系在產生x%效應時所對應的濃度,mg·L?1;Pi為組分i的濃度比值;Cxi為混合組分i在產生x%效應時所對應的濃度,mg·L?1。 式中:E(Cmix)為混合體系的效應值;E(Ci)為混合組分i的效應值。 每組實驗均設3 個平行,實驗結果表示為平均值±標準差。采用SigmaPlot(14.0版)統計分析模塊對實驗數據進行t檢驗,P<0.05表示有顯著性差異。 使用 TEM 技術表征了 ZnO NPs、TiO2NPs 及其二元混合物在測試介質中的形貌。如圖1 所示,ZnO NPs(圖1A)和TiO2NPs(圖1B)在測試介質中均呈現團聚現象,當兩種ENPs 共存時(圖1C)顆粒間團聚行為亦存在。這是由于ENPs比表面積大、比表面能高,屬于熱力學不穩定體系,在水中極易發生團聚現象,并形成大小不等的團聚體。 ENPs的表面電勢和水動力學直徑是表征納米顆粒在水相中分散穩定性和團聚行為的重要物理化學性質[30?31]。圖 2 為 ZnO NPs、TiO2NPs 及其二元混合物在測試介質中的表面電勢和團聚粒徑大小隨時間的變化。如圖2A所示,ZnO NPs和TiO2NPs在96 h時的表面電勢與0 h時相比均未發生顯著性的變化。在初始時刻,ZnO NPs 和TiO2NPs 二元混合物的表面電勢與各單一組分的表面電勢均不存在顯著差異。然而,在96 h 后,與其他處理組相比,二元混合物的表面電勢發生了顯著性降低(P<0.05)。這可能是由于納米顆粒不斷發生沉降,當體系達到平衡,ZnO NPs 和TiO2NPs 表面所攜帶的負電荷整體表現出疊加作用,故呈現出表面電勢降低的現象。如圖2B 所示,在96 h 后,ZnO NPs 和TiO2NPs 的水動力學直徑均高于其原始粒徑,進一步說明這兩種ENPs 在測試介質中發生了團聚行為。ZnO NPs 在96 h 時的水動力學直徑與0 h 時相比未發生顯著性的變化,且TiO2NPs 的水動力學直徑顯著小于ZnO NPs 的水動力學直徑。在0 h,二元混合物的水動力學直徑介于單獨存在的TiO2NPs 和ZnO NPs 的水動力學直徑之間。在96 h,二元混合物的水動力學直徑與ZnO NPs 的水動力學直徑無顯著性的差異,說明TiO2NPs可能被“包裹”在ZnO NPs之間。 應用經典DLVO 理論可有效地評估ENPs 在水相中的分散穩定性[32?33]。基于DLVO 理論,計算得到10 mg·L?1ZnO NPs、10 mg·L?1TiO2NPs 及其二元混合物的總勢能曲線,如圖3 所示。由于線性疊加而導致的勢能曲線上出現的最大值,被稱為勢能峰值。通常勢能峰值越大,體系保持穩定的時間越長。如圖3A 所示,在0 h 時,二元混合物的穩定性介于TiO2NPs 和ZnO NPs 的穩定性之間。如圖3B 所示,在 96 h 時,二元混合物的穩定性高于TiO2NPs 和ZnO NPs 的穩定性。這與前述的理化性質表征結果一致,即在96 h后二元混合物的顆粒表面電勢降低,表明顆粒間以斥力為主,難以團聚而處于穩定懸浮狀態。 由于ZnO NPs 表面性質活潑,進入水相后可溶解釋放 Zn2+[34?35],而共存的惰性 TiO2NPs 可利用表面效應吸附水中游離態的Zn2+,進而能夠降低Zn2+的生物活性[36]。本文定量分析了 10 mg·L?1TiO2NPs 對 10 mg·L?1ZnO NPs 溶解釋放 Zn2+的影響。如圖 4 所示,單獨存在的ZnO NPs 溶解釋放Zn2+的比例為16%±1.7%,而當與TiO2NPs共存時,ZnO NPs溶解釋放Zn2+的比例為2.2%±0.2%。由此可見,TiO2NPs 的存在降低了ZnO NPs溶解釋放Zn2+的濃度。如圖2B所示,與ZnO NPs相比,TiO2NPs具有更小的水動力學直徑,這使得TiO2NPs的團聚體擁有更大的比表面積,易于通過表面吸附降低ZnO NPs 溶解釋放Zn2+的量。另外,具有更小水動力學直徑的TiO2NPs 可能更易于占據ZnO NPs 表面的活性位點,從而抑制Zn2+的釋放。同時,如圖2A 所示,TiO2NPs 在測試介質中表面電勢為負,即攜帶負電荷,故靜電作用是上述吸附過程的主要驅動力。 圖 5 為不同暴露時間下 ZnO NPs、TiO2NPs、Zn2+對斜生柵藻和蛋白核小球藻的濃度?反應曲線(CRCs)。整體而言,ZnO NPs、TiO2NPs、Zn2+對兩種淡水綠藻均以濃度依賴的方式產生生長抑制毒性。對于斜生柵藻,不同暴露時間下ZnO NPs(圖5A)、TiO2NPs(圖 5C)和 Zn2+(圖 5E)的 CRCs 有明顯的交叉。對于蛋白核小球藻,在48 h 和72 h 下ZnO NPs(圖5B)、TiO2NPs(圖5D)和Zn2(+圖5F)的CRCs 向較高的生長抑制毒性區域移動。結合EC50值進一步比較 ZnO NPs、TiO2NPs、Zn2+的毒性大小,結果如表 1 和表2所示,結合置信區間,在不同暴露時間下ZnO NPs的EC50值均小于 TiO2NPs 的EC50值,說明 ZnO NPs 對兩種淡水綠藻的生長抑制毒性均高于TiO2NPs。ZnO NPs 和TiO2NPs 在不同暴露時間下對斜生柵藻的EC50值無顯著差異(表1)。ZnO NPs 和TiO2NPs 在48 h 和72 h 對蛋白核小球藻的EC50值明顯小于其在24 h 的EC50值(表2),表明隨著暴露時間的延長,ZnO NPs 和TiO2NPs 對蛋白核小球藻的生長抑制毒性逐漸增強。在毒性終點,ZnO NPs 對斜生柵藻的毒性高于其對蛋白核小球藻的毒性,而TiO2NPs對蛋白核小球藻的毒性高于其對斜生柵藻的毒性。這也說明,不同種類的淡水綠藻對ENPs 的敏感性存在差別,且蛋白核小球藻對ENPs的敏感性依賴于暴露時間。斜生柵藻通常由4 個細胞組成,細胞寬度為12~34μm,長度為10~21 μm,呈扁平狀,而蛋白核小球藻為單細胞,呈球形,直徑3~5 μm。蛋白核小球藻直徑更小,比表面積更高,可維持更穩定的懸浮狀態。隨著暴露時間的延長,蛋白核小球藻可維持對ENPs 更有效的攝取,進而隨著暴露時間的延長毒性效應逐漸增強。 如表1和表2所示,就EC50值及其置信區間而言,Zn2+與ZnO NPs對斜生柵藻生長的抑制毒性在不同暴露時間下均無顯著性差異,而Zn2+對蛋白核小球藻的生長抑制毒性略低于ZnO NPs。ZnO NPs暴露濃度為10 mg·L?1時,其溶解釋放 Zn2+的平均濃度為 1.6 mg·L?1。1.6 mg·L?1Zn2+對斜生柵藻在不同暴露時間的生長抑制效應分別為65%(24 h)、86%(48 h)、99%(72 h)、99%(96 h);Zn2+對蛋白核小球藻在不同暴露時間的生長抑制效應分別為4%(24 h)、30%(48 h)、39%(72 h)。這說明Zn2+是ZnO NPs 對淡水綠藻生長抑制毒性的主要來源。前人研究也證實,ZnO NPs 表現出的毒性主要來源于其顆粒自身及其溶解釋放的Zn2+[19,35]。本研究還發現 Zn2+對斜生柵藻的EC50值明顯小于Zn2+對蛋白核小球藻的EC50值(表1 和表2),說明Zn2+對斜生柵藻的毒性高于對蛋白核小球藻的毒性。這也表明斜生柵藻對Zn2+的敏感性高于蛋白核小球藻對Zn2+的敏感性。綜上,溶解釋放的Zn2+在ZnO NPs對斜生柵藻毒性中的貢獻高于其在ZnO NPs對蛋白核小球藻毒性中的貢獻,ZnO NPs 對斜生柵藻的毒性主要來源于溶解釋放的Zn2+,而其對蛋白核小球藻的毒性不僅來源于溶解釋放的Zn2+,還來源于顆粒自身。同時,作為一種惰性ENPs 的TiO2NPs,其對淡水綠藻的毒性取決于其顆粒自身。 ZnO NPs 和TiO2NPs 的二元混合物對兩種淡水綠藻生長抑制毒性的CRCs如圖5G和圖5H所示。二元混合物對斜生柵藻和蛋白核小球藻的EC50值如表1 和表 2 所示。與 ZnO NPs 和 TiO2NPs 的單一毒性類似,二元混合物以混合暴露濃度依賴的方式對淡水綠藻產生生長抑制毒性。同樣地,二元混合物在不同暴露時間下對斜生柵藻的EC50值無顯著差異(表1),二元混合物在48 h 和72 h 對蛋白核小球藻的EC50值明顯小于其在24 h 時的EC50值(表2)。另外,二元混合物對兩種淡水綠藻的EC50值與ZnO NPs 的EC50值并無顯著差異,說明ZnO NPs 在二元混合物中對淡水綠藻的毒性起主要的作用。在不同暴露時間下,二元混合物對斜生柵藻的EC50值明顯小于其對蛋白核小球的EC50值,表明二元混合物對斜生柵藻的毒性大于其對蛋白核小球的毒性。這也意味著斜生柵藻對ZnO NPs 和TiO2NPs 二元混合物的敏感性高于蛋白核小球藻對二元混合物的敏感性。 表1 通過濃度?反應曲線得到單一測試材料和二元混合物對斜生柵藻的均值效應濃度(EC50,mg·L?1)Table 1 Mean effect concentrations(EC50)derived from concentration-response curves of the single test materials and the binary mixtures to Scenedesmus obliquus(mg·L?1) 表2 通過濃度?反應曲線得到單一測試材料和二元混合物對蛋白核小球藻的均值效應濃度(EC50,mg·L?1)Table 2 Mean effect concentrations(EC50)derived from concentration-response curves of the single test materials and the binary mixtures to Chlorella pyrenoidosa(mg·L?1) 基于TU 法評估ZnO NPs 和TiO2NPs 對兩種淡水綠藻全濃度范圍內的聯合毒性作用方式。如圖6A所示,ZnO NPs 與TiO2NPs 對斜生柵藻的聯合毒性作用方式在毒性單位值小于10(即混合暴露濃度小于1 mg·L?1)時表現為加和,而在毒性單位值大于10(即混合暴露濃度大于1 mg·L?1)時表現為拮抗。在組分濃度較低時,ZnO NPs 與TiO2NPs 共同競爭與藻細胞間的相互作用,在所有效應達到平衡時,產生加和效應。當混合組分濃度增加,一方面ZnO NPs 顆粒間團聚性增加而抑制了Zn2+的釋放,另一方面共存的TiO2NPs通過吸附作用和占據ZnO NPs 表面活性位點的方式降低了Zn2+的釋放量(圖4),從而導致ZnO NPs 毒性降低,混合體系產生了拮抗作用。如圖6B 所示,ZnO NPs 與TiO2NPs 二元混合物對蛋白核小球藻在24 h的聯合毒性作用方式表現為協同,而在48 h和72 h的聯合毒性作用方式表現為拮抗。如物理化學性質的表征結果(見2.1)所示,ZnO NPs與TiO2NPs的二元混合物可產生復合團聚體,該復合體可與藻細胞直接接觸,破壞藻細胞壁,并可被攝入細胞內,加上各混合組分對藻細胞的毒性作用,進而產生了協同作用。隨著時間的延長,復合團聚體的尺度逐漸增大,較難進入藻細胞,毒性逐漸降低。加上TiO2NPs 通過控制ZnO NPs 溶解釋放Zn2+量降低了ZnO NPs 的毒性,故混合體系在48 h 和72 h 產生拮抗作用。綜上可知,ZnO NPs 和TiO2NPs 對斜生柵藻的聯合毒性作用方式與混合暴露濃度有關,對蛋白核小球藻的聯合毒性作用方式與暴露時間有關。同時,控制Zn2+釋放量及顆粒團聚體與細胞間的相互作用是導致混合體系聯合毒性作用方式變化的內在驅動力。 據報道,由顆粒誘導產生ROS 所引起的細胞內氧化應激效應是ENPs 主要的毒性作用機制[37?38]。本研究通過熒光探針法檢測了兩種淡水綠藻暴露于單獨ZnO NPs 和TiO2NPs 及其二元混合物后藻細胞內ROS 的含量變化(圖7)。相比于對照組,單獨ZnO NPs 和TiO2NPs 均顯著誘導了兩種淡水綠藻細胞內ROS水平的升高,且ZnO NPs誘導細胞內ROS升高的水平顯著高于TiO2NPs,這可能會導致藻細胞產生更嚴重的氧化損傷,進而造成更嚴重的生長抑制毒性,該結果與生長抑制毒性結果一致(表1 和表2)。此外,ZnO NPs 和 TiO2NPs 二元混合物誘導的 ROS 水平也顯著高于對照組,說明氧化損傷效應也可能是二元混合物對淡水綠藻產生毒性的作用機制。同時發現二元混合物誘導的ROS 水平介于ZnO NPs 和TiO2NPs 誘導的ROS 水平之間,表明這兩種ENPs 間的相互作用可能調節了各自誘導藻細胞內ROS的水平。 為了滿足對混合污染物風險評價的需要,定量預測混合污染物的聯合毒性已成為生態毒理研究的一項重要工作[39?40]。本文應用混合毒理研究中兩種最常用的模型,即IA 和CA 模型預測ZnO NPs 和TiO2NPs 對兩種淡水綠藻的聯合毒性。如圖8 所示,對于斜生柵藻,IA 模型預測的CRCs 適度的偏離了實驗觀察的CRCs,而CA 模型預測的CRCs 嚴重偏離了實驗觀察的CRCs。同時,IA 模型預測的CRCs 位于實驗觀察的CRCs 的置信區間內,而CA 模型預測的CRCs位于實驗觀察的CRCs 的預測區間之外,這表明IA 模型可有效預測ZnO NPs 和TiO2NPs 的聯合毒性,且預測能力遠高于CA 模型。此外,IA 模型預測的CRCs位于實驗觀察的CRCs 的左側,表明IA 模型高估了該二元混合物的聯合毒性;而CA 模型預測的CRCs 位于實驗觀察的CRCs 的右側,表明CA 模型低估了該二元混合物的聯合毒性。由表1 可知,對于斜生柵藻,IA 模型預測的EC50值在24 h 時與實驗觀察得到的EC50值無顯著差異,而在 48、72、96 h 時 IA 模型預測的EC50值顯著低于實驗觀察得到的EC50值。同時CA 模型預測的EC50值在不同暴露時間均高于實驗觀察得到的EC50值。這進一步說明IA 模型高估了二元混合物對斜生柵藻的毒性,而CA 模型低估了二元混合物對斜生柵藻的毒性。對比不同模型預測的EC50值與實驗觀察得到的EC50值,發現IA 模型預測的EC50值與實驗觀察得到的EC50值之間的差異明顯小于CA模型預測的EC50值與實驗觀察得到的EC50值之間的差異,說明IA模型的預測能力高于CA模型。 如圖9所示,對于蛋白核小球藻,IA模型和CA 模型預測的CRCs均明顯偏離了實驗觀察得到的CRCs。在 24 h 時,IA 模型和 CA 模型預測的 CRCs 均位于實驗觀察的CRCs的置信區間內,而在48 h和72 h,IA模型和CA 模型預測的CRCs 均位于實驗觀察的CRCs的預測區間的邊緣。與斜生柵藻類似,IA 模型預測的CRCs 位于實驗觀察的CRCs 的左側,表明IA 模型高估了該二元混合物的聯合毒性;而CA 模型預測的CRCs 位于實驗觀察的CRCs 的右側,表明CA 模型低估了該二元混合物的聯合毒性。由表2 可知,對于蛋白核小球藻,不同的暴露時間下,IA 模型預測的EC50值均顯著低于實驗觀察得到的EC50值,同時CA 模型預測的EC50值均高于實驗觀察得到的EC50值。這也說明IA 模型高估了二元混合物對蛋白核小球藻的毒性,而CA 模型低估了二元混合物對蛋白核小球藻的毒性。對比不同模型預測的EC50值與實驗觀察得到的EC50值,發現IA 模型預測的EC50值與實驗觀察得到的EC50值之間的差異明顯小于CA 模型預測的EC50值與實驗觀察得到的EC50值之間的差異,說明IA 模型的預測能力高于CA模型。 應用CA 模型和IA 模型的前提條件為混合組分具有相似的毒性作用方式[41]和非相似的毒性作用方式[42],且混合體系的聯合毒性作用方式為加和。雖然本研究ZnO NPs 和TiO2NPs 的聯合毒性作用方式隨著混合暴露濃度和暴露時間的變化而變化,主要表現出加和、協同及拮抗作用,但目前可有效預測ENPs協同和拮抗作用的混合毒理模型尚屬空白。相比于CA模型,IA 模型對ZnO NPs 和TiO2NPs聯合毒性的預測能力明顯更高,且IA 模型預測的EC50值與實驗觀察得到的EC50值存在較小的差異。因此,IA 模型可作為預測ENPs聯合毒性的預先防范工具。 (1)在不同的暴露時間,ZnO NPs 對斜生柵藻和蛋白核小球藻的生長抑制毒性均明顯高于TiO2NPs。 (2)ZnO NPs 與 TiO2NPs 對斜生柵藻的聯合毒性作用方式在混合暴露濃度小于1 mg·L?1時表現為加和,而在混合暴露濃度大于1 mg·L?1時表現為拮抗。 (3)二元混合物對蛋白核小球藻在暴露時間為24 h時的聯合毒性作用方式表現為協同,而在48 h和72 h時的聯合毒性作用方式表現為拮抗。 (4)ZnO NPs 和 TiO2NPs 對淡水綠藻的聯合毒性機制為納米顆粒誘導ROS 生成,從而引起藻細胞氧化應激效應。 (5)在不同暴露時間下,獨立作用模型對ZnO NPs 和TiO2NPs 聯合毒性的預測能力強于濃度加和模型。1.6 統計分析
2 結果與討論
2.1 物理化學性質表征
2.2 單一藻毒性
2.3 聯合藻毒性
2.4 聯合藻毒性作用方式及機制
2.5 聯合藻毒性的預測
3 結論

