氧化還原反應知識關聯結構化模型的構建與相關知識網絡的梳理
福建 王書紅
氧化還原反應與路易斯酸堿反應、自由基反應并稱為化學中的三大基本反應,是高考中必考考點之一。《普通高中化學課程標準(2017年版2020年修訂)》(以下簡稱《課程標準》)對氧化還原反應的要求是“認識有化合價變化的反應是氧化還原反應,了解氧化還原反應的本質是電子的轉移,知道常見的氧化劑和還原劑。”近年來關于氧化還原反應的命題也緊扣《課程標準》,以真實的問題情境為載體,考查氧化還原反應的概念、氧化還原反應的強弱規律及計算、氧化還原反應方程式的書寫及配平并同時注重將氧化還原反應的學科內容與國家經濟、社會發展、科學進步、生產生活實際等緊密聯系起來,考查學生綜合應用學科內知識分析和解決真實問題的能力,引導學生關注社會進步和科學發展。
一、建構氧化還原反應知識關聯結構化模型,促進知識向能力素養的轉化
美國著名教育心理學家、認知心理學家布魯納曾說:“人類記憶的首要問題不是存儲而是檢索,而檢索的關鍵在于組織結構。如果知識在頭腦中無條理地堆積,不但檢索提取存在困難,而且很快會被遺忘。”《課程標準》要求通過實驗的事實來了解氧化還原的本質,這就要求在復習中必須設計合理的實驗,利用實驗現象,促使學生深入思考宏觀實驗現象背后隱藏的微觀粒子變化的實質,建構氧化還原反應基本概念的知識結構模型。
1.借助實驗,引領學生建立認識化學反應的新視角

銅絲在空氣中加熱

用氫氣還原氧化銅

將鐵絲插入CuSO4溶液中

向CuSO4溶液中滴加NaOH溶液
【深度思考1】
①在這些反應中,銅元素發生了哪些變化?
②前三個反應與最后一個反應的特征有什么不同,這三個反應的本質是怎樣的?
③含銅元素的物質在這些反應中表現出什么性質?
學生通過做實驗并解決深度思考1中的三個問題,分析上述實驗中銅元素存在形態的變化,建立了可以從有無元素化合價變化的角度來認識化學反應的觀念,也學會了判斷氧化還原反應的方法,即有元素化合價變化的反應就是氧化還原反應,引領學生可以從元素化合價的角度認識化學反應,分析和解決氧化還原反應的實際問題。
2.借助實驗,引導學生綜合利用學科知識,拓寬解決問題的思路和方法
【深度思考2】
①寫出鐵與CuSO4溶液反應的化學方程式并判斷該反應是否屬于氧化還原反應。
②利用圖2所示實驗裝置進行鐵與CuSO4溶液反應的實驗,實驗現象之一是電流表指針發生偏轉。這一實驗現象對你認識鐵與CuSO4溶液反應的實質有什么啟發?

圖2 探究氧化還原反應的實質
問題2中通過電流表指針發生偏轉這一實驗事實,判斷電路中有電流產生,進而得出電路中有電子定向移動的結論。這種通過實驗的方式揭示了氧化還原反應的本質是有電子轉移的方法,相比教師課堂直接給出結論的方法,實驗得出結論的方式學生更容易理解和接受。授人以魚不如授人以漁,學生既得出了氧化還原反應的實質是有電子轉移的結論又學會了綜合利用學科知識解決化學問題的思路和方法。
3.建構氧化還原反應知識關聯結構化模型,梳理知識網絡
借助實驗建立了認識化學反應的新視角并綜合利用學科知識,拓寬了判斷氧化還原反應實質的思路和方法,最后結合高考題梳理出氧化還原反應常考知識關聯結構化模型如圖3所示,在常考考點中需要應用的基本概念原理模型圖如圖4所示。借助氧化還原反應知識結構化模型,梳理知識網絡,幫助學生把零散的知識結構化,形成系統化和類別化的學科知識經驗,達到知識結構化和功能化的目的。
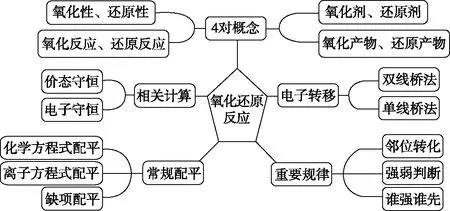
圖3 氧化還原反應高考常考知識關聯結構化模型

圖4 氧化還原反應基本概念關系模型
二、應用結構化模型,分板塊快速突破氧化還原反應在高考中的常見考點
1.氧化還原反應在客觀題中的主要呈現方式及其突破策略
隨著課程改革的推進,化學在高考中成為選考獨立考查科目,和理綜時相比題目數量增加,通過分析新課標試卷和新高考地區的試卷不難發現,氧化還原反應基本概念的理解及應用的試題又重新回歸。以2021年新高考省份化學高考真題為例來分析,在選擇題中氧化還原反應重在考查根據題目給定信息,理解信息并依據氧化還原反應的原理會做判斷并進行必要的計算。具體考查內容主要體現在以下四個方面:
1.1 考查氧化還原反應的基本概念及轉移電子的計算

( )
A.K2H3IO6發生氧化反應
B.KI是還原產物
C.生成12.7 g I2時,轉移0.1 mol電子
D.還原劑與氧化劑的物質的量之比為7∶1
【答案】D
【解析】
A.反應中I元素的化合價降低,發生得電子的反應,發生還原反應,A錯誤;
B.KI中的I-由HI變化而來,化合價沒有發生變化,KI既不是氧化產物也不是還原產物,B錯誤;
C.12.7 g I2的物質的量為0.05 mol,根據反應方程式,每生成4 mol I2轉移7 mol電子,則生成0.05 mol I2時轉移電子的物質的量為0.0875 mol,C錯誤;
D.反應中HI為還原劑,K2H3IO6為氧化劑,在反應中每消耗1 mol K2H3IO6就有7 mol HI失電子,則還原劑與氧化劑的物質的量的比為7∶1,D正確;故答案選D。
【突破策略】解決氧化還原反應知識關聯結構化模型中四對基本概念涉及問題最好的方法是緊扣氧化還原反應的特征和實質,解決模型為:寫方程式→標注有變價的元素的化合價→依據“升還降氧”(元素化合價升高做還原劑,元素化合價降低做氧化劑)在反應物中找出氧化劑、還原劑并標注,然后依據“氧化劑被還原,還原劑被氧化”的規則,在生成物中找出氧化產物和還原產物并標注。
1.2 與離子反應綜合,考查氧化還原方程式的書寫
【例2】(2021·全國乙卷·9)下列過程中的化學反應,相應的離子方程式正確的是
( )

【答案】A
【解析】

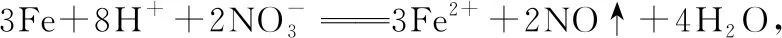


【突破策略】氧化還原反應離子方程式的解決基本模型為:
第一步:首先觀察反應是否符合實際情況(能否反應、反應后生成物形式是否正確、反應順序及量比正確)。
第二步:接著判斷反應物、生成物拆分是否正確。
第三步:考慮是否滿足三大守恒(電荷守恒、質量守恒和得失電子守恒)。若以上三步均滿足則該離子方程式書寫正確。
1.3 與電化學綜合,考查氧化還原反應原理的應用
【例3】(2021·全國乙卷·12)沿海電廠采用海水為冷卻水,但在排水管中生物的附著和滋生會阻礙冷卻水排放并降低冷卻效率,為解決這一問題,通常在管道口設置一對惰性電極(如圖5所示),通入一定的電流。下列敘述錯誤的是
( )

圖5
A.陽極發生將海水中的Cl-氧化生成Cl2的反應
B.管道中可以生成氧化滅殺附著生物的NaClO
C.陰極生成的H2應及時通風稀釋安全地排入大氣
D.陽極表面形成的Mg(OH)2等積垢需要定期清理
【答案】D
【解析】
A.根據分析可知,陽極區海水中的Cl-會優先失去電子生成Cl2,發生氧化反應,A正確;
B.設置的裝置為電解池原理,根據分析知,陽極區生成的Cl2與陰極區生成的OH-在管道中會發生反應生成NaCl、NaClO和H2O,其中NaClO具有強氧化性,可氧化滅殺附著的生物,B正確;
C.因為H2是易燃性氣體,所以陽極區生成的H2需及時通風稀釋,安全地排入大氣,以排除安全隱患,C正確;

【突破策略】氧化還原反應與電化學綜合是高考必考考點之一,解決此類問題的模型為:
第一步:根據題目信息,首先判斷電化學裝置是原電池還是電解池。
第二步:接著判斷發生氧化反應的電極和還原反應的電極。
第三步:若為原電池發生氧化的電極是負極,若為電解池發生氧化反應的電極是陽極。
第四步:根據電極名稱判斷電極反應的正誤以及離子移動方向。
1.4 結合元素化合物綜合考查氧化還原反應在生活、生產中的應用
【例4】(2020·北京市普通高中學業水平等級性考試·2)下列物質的應用中,利用了氧化還原反應的是
( )
A.用石灰乳脫除煙氣中的SO2
B.用明礬[KAl(SO4)2·12H2O]處理污水
C.用鹽酸去除鐵銹(主要成分Fe2O3·xH2O)
D.用“84”消毒液(有效成分NaClO)殺滅細菌
【答案】D
【解析】
A.SO2是酸性氧化物,可與堿反應,用石灰乳脫除煙氣中的SO2時,SO2與氫氧化鈣反應生成亞硫酸鈣或亞硫酸氫鈣,反應過程中無元素的化合價變化,沒有利用氧化還原反應,故A不符合題意;
B.用明礬[KAl(SO4)2·12H2O]溶于水中,電離出的鋁離子發生水解生成氫氧化鋁膠體,利用膠體的吸附性可吸附污水中的固體顆粒物,該過程利用膠體的吸附性,發生的反應沒有發生化合價變化,沒有利用氧化還原反應,故B不符合題意;

D.用“84”消毒液有效成分NaClO,具有強氧化性,能使蛋白質發生變性從而殺死細菌病毒,殺菌消毒的過程利用了氧化還原反應,故D符合題意。
【突破策略】解決氧化還原反應實際應用問題,首先能根據所給信息準確判斷出發生的主要反應,不要求完整的書寫方程式;其次根據主要反應物和生成物中的中心元素判斷出是否發生化合價變化,最后給出結論即可。此類問題綜合性較強,涉及元素化合物知識較多,需要有扎實的基本功。
2.氧化還原反應在主觀題中的主要呈現方式及其突破策略
氧化還原反應在主觀題中的考查主要滲透在流程題、實驗題和化學反應原理綜合試題中,它不僅要求學生能依據題目所給信息判斷能否發生氧化還原反應而且要求學生能夠快速、準確的寫出氧化還原反應的離子、化學方程式或者電極反應方程式,計算轉移電子數、氧化劑和還原劑(或者氧化產物和還原產物)對應的量比關系,最難的當屬在氧化還原滴定中要先判斷反應的順序,再結合滴定操作計算產品產率或者樣品純度。
【例5】(2021·全國甲卷·26節選)碘(紫黑色固體,微溶于水)及其化合物廣泛用于醫藥、染料等方面。回答下列問題:
(1)I2的一種制備方法如圖6所示:

圖6
①加入Fe粉進行轉化反應的離子方程式為________________________________。
②通入Cl2的過程中,若氧化產物只有一種,反應的化學方程式為__________________________;若反應物用量比n(Cl2)/n(FeI2)=1.5時,氧化產物為______________;當n(Cl2)/n(FeI2)>1.5后,單質碘的收率會降低,原因是_________________。
(2)以NaIO3為原料制備I2的方法是:先向NaIO3溶液中加入計量的NaHSO3,生成碘化物;再向混合溶液中加入NaIO3溶液,反應得到I2,上述制備I2的總反應的離子方程式為_________________。




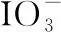
【突破策略】在流程中考查氧化還原反應的關鍵點是抓準兩條線即物質轉化線和操作線,關注非氫非氧元素在轉化過程中的物質變化和化合價變化。第一步先找出氧化劑、還原劑、氧化產物、還原產物;第二步,標化合價利用化合價升降法配平有元素化合價變化的物質的系數;第三步根據溶液的酸堿性補充H+或者OH-完成電荷守恒;最后根據質量守恒判斷是否需要補充水分子,該方法同樣適合電極方程式的書寫。電子就轉移的計算方法和處理客觀題相同。根據配平好的方程式可以快速找出氧化劑、還原劑之間的關系。
【例6】(2020·江蘇卷·18節選)次氯酸鈉溶液和二氯異氰尿酸鈉(C3N3O3Cl2Na)都是常用的殺菌消毒劑。NaClO 可用于制備二氯異氰尿酸鈉。
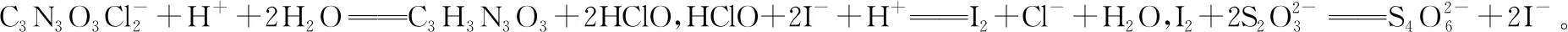

②若在檢測中加入稀硫酸的量過少,將導致樣品的有效氯測定值________(填“偏高”或“偏低”)。

根據物質轉換和電子得失守恒關系:
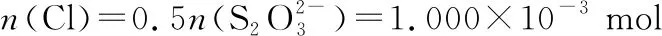
氯元素的質量:
m(Cl)=1.000×10-3mol×35.5 g·mol-1=0.035 50 g
該樣品的有效氯為:
該樣品的有效氯大于60%,故該樣品為優質品 偏低
【突破策略】氧化還原反應滲透在實驗題中,以氧化還原反應滴定的方式呈現,此類問題比較綜合且涉及計算,對絕大多數學生而言是化學中最難的。突破此類問題首先需要理解滴定實驗的基本操作;其次寫出滴定過程中的物質轉化線;最后也是最關鍵的是找標液和待測液之間的關系并計算。若是直接關系,利用化合價升降法直接找關系式即可;若因為存在連續反應是間接關系的依然是先找準關系式等量代換即可。


