非酒精性脂肪性肝炎患者血清CK18和FGF-21水平變化及其臨床意義探討
聞啟富,馬利軍,王曉亮
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)包括非酒精性單純性脂肪肝(non-alcoholic simple fatty liver,NAFL)、非酒精性脂肪性肝炎(non-alcoholic steatohepatitis,NASH)、非酒精性脂肪性肝硬化和肝癌[1-3]。肝活檢屬于侵入性有創檢查,亦有可能導致肝臟出血,難以推廣應用[4-6]。因此,有必要尋找一種簡單、無創的方法來識別NASH,監測病情進展[7]。成纖維細胞生長因子(fibroblast growth factor,FGF)家族是一種編碼具有高度同源性的氨基酸序列的多肽,其大多數成員具有促進有絲分裂的作用,參與細胞生長分化、新生血管形成、傷口愈合和胚胎發育等生理過程,其中FGF-21蛋白在許多動物實驗中被證實能顯著改善糖脂代謝。細胞角蛋白18片段M30(cytokeratin 18 fragment M30,CK18-M30)是肝臟中主要的中間絲蛋白,其水平與肝臟疾病細胞凋亡過程中細胞形態學變化密切相關,而肝細胞凋亡在肝損傷和NASH的發生發展過程中起著重要作用[8-10]。本研究檢測了NASH患者CK18-M30和FGF-21水平,并進一步分析其水平與糖脂代謝的關系,以期指導臨床治療。
1 資料與方法
1.1 研究對象 2018年10月~2020年10月我院收治的NASH患者85例,男49例,女36例;年齡30~60歲,平均年齡為(44.8±6.5)歲。NASH診斷符合《非酒精性脂肪性肝病防治指南(2018年更新版)》[11]的診斷標準,其中合并高脂血癥17例、2型糖尿病9例、高血壓病15例。排除標準:有飲酒習慣(女性大于20 g/d,男性大于40 g/d)或酒精性肝炎、病毒性肝炎、合并甲狀腺功能改變性疾病、合并惡性腫瘤、近2個月內應用過抗病毒治療或其它影響免疫功能的藥物者。另選擇同期來醫院體檢的健康人45例作為對照組,男25例,女20例;年齡28~62歲,平均年齡為(43.9±7.4)歲。兩組性別和年齡比較,差異無統計學意義(P<0.05)。本研究納入的所有受試者簽署知情同意書,本研究經本院醫學倫理委員會審核。
1.2 血清指標檢測 采用ELISA法檢測血清CK18-M30和FGF-21水平(南京建成生物工程研究所試劑,美國Thermo Fisher Scientific公司生產的自動酶標儀);使用AU5800型全自動生化分析儀及其配套試劑盒檢測血生化指標(美國貝克曼庫爾特有限公司),計算穩態模型評價胰島素抵抗指數(HOMA-IR)=[空腹血糖(FBG mmol/L)×胰島素(FINS mmol/L)]/22.5。
1.3 肝組織病理學檢查 使用南京貝登醫療股份有限公司生產的MX-01000305型彩色超聲診斷儀引導下行肝組織病理學檢查。參照指南[11],25%以上的肝細胞脂肪變合并小葉內炎癥和肝細胞氣球樣變性,診斷為NASH,其中脂肪變性≥34%為中重度NASH。
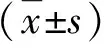
2 結果
2.1 兩組血清CK18-M30、FGF-21和血糖指標比較 NASH患者血清FIN、FPG、HOMA-IR、CK18-M30和FGF-21水平均顯著高于健康人,差異有統計學意義(P<0.05,表1)。

表1 兩組血清指標比較
2.2 兩組脂代謝指標比較 NASH患者血清TC、TG和LDL-C水平均顯著高于健康人,差異有統計學意義(P<0.05,表2)。

表2 兩組脂代謝指標比較
2.3 不同程度NASH血清CK18-M30、FGF-21和血糖指標比較 中重度NASH患者血清FIN、FPG、CK18-M30和FGF-21水平均顯著高于輕度患者,差異有統計學意義(P<0.05,表3)。

表3 不同脂肪變程度NASH血清指標比較
2.4 不同程度NASH脂代謝指標比較 中重度NASH患者血清TC和TG水平均顯著高于輕度患者,差異有統計學意義(P<0.05,表4)。

表4 不同程度NASH脂代謝指標比較
2.5 有與無合并癥的NASH患者血清指標比較 在85例NASH患者中,合并高血脂、糖尿病或/和高血壓35例。有合并癥的NASH患者血清TC、TG、HOMA-IR、CK18-M30和FGF-21水平均顯著高于無合并癥的NASH患者,差異有統計學意義(P<0.05,表5)。

表5 有與無合并癥的NASH患者血清指標比較
3 討論
在過去10年里,人們飲食結構改變引起能量過剩,NAFLD的發病率隨之成倍增長致,使肥胖、高血壓病、2型糖尿病、血脂異常和代謝綜合征患者顯著增加。代謝性因素已超過酒精中毒,成為誘發脂肪肝的首要危險因素[12,13]。如前文所述,NAFL的進展通常非常緩慢。與之不同,NASH患者除肝實質細胞內存在脂滴沉積外,還存在炎性細胞浸潤、肝實質細胞損傷和肝纖維化,在10~15年內,患者病情進展為肝硬化的幾率高達20%[14]。目前,臨床主要通過影像學和血清學檢查對NASH進行定性診斷,其中超聲是最常用的影像學手段,對中度和重度NASH的診斷靈敏度較高,但重復性較差,而CT和核磁共振又因輻射和價格昂貴,不能作為大范圍篩查的手段。因此,針對NASH與NAFL的鑒別和病變判斷,衍生發展出許多診斷模型,如NAFLD 肝脂肪評分、HAIR模型等,各種肝功能指標和體質指數(body mass index,BMI)均是入選頻率較高的傳統變量。
隨著研究的深入,NAFLD的生理病理學機制研究更加豐富,胰島素抵抗被認為是該病發展的關鍵環節,外周胰島素抵抗可促進外周脂肪動員,提高血漿游離脂肪酸濃度。然而,肝臟氧化和游離脂肪酸的利用受到抑制,從而使酯化反應形成的TG增多,而肝臟自身分泌的TG減少,從而導致脂肪在肝細胞內積聚,隨之產生的脂毒性物質將影響肝細胞線粒體功能、內質網功能和氧化應激等過程,最終引起NAFLD[15]。本研究NASH患者血清FIN、FPG、HOMA-IR、TC、TG和LDL-C水平明顯高于健康人。此外,中重度NASH患者體內糖脂代謝指標水平顯著區別于輕度NASH患者,提示NASH患者體內胰島素水平、胰島素抵抗、糖脂代謝均出現異常,且隨著病情進展有紊亂加劇的趨勢,證實上述觀點。
CK18是肝細胞中主要的中間絲蛋白。在細胞凋亡過程中,CK18是半胱天冬酶最重要的底物。經肝臟免疫組化實驗顯示,CK18在所有肝細胞中均高表達,但只有NASH患者的肝組織中有CK18-M30的表達[16,17]。NAFLD患者肝臟脂肪堆積的原因是游離脂肪酸(free fatty acid,FFA)通過門靜脈轉運至肝臟,并轉化為TG,FFA和內質網應激對FGF21表達具有一定的促進作用。動物實驗發現,高水平的FGF21通過內分泌和自分泌途徑對糖脂代謝具有保護作用,可能具有維持體內代謝穩態的代償作用。因此,血清FGF21水平升高被認為是對飲食誘導的肥胖群體對FGF21敏感性降低的代償性反應[18,19]。本研究中,NASH患者血清CK18-M30和FGF-21水平均顯著高于健康人,中重度NASH患者血清CK18-M30和FGF-21水平均顯著高于輕度患者,提示兩者與NASH的發生、病情進展均密切相關,提示兩者有潛力作為NASH鑒別和隨訪的評估指標。本研究發現,中重度NASH患者血清CK18-M30和FGF-21水平均顯著高于輕度患者,有代謝相關合并癥的NASH患者血清TC、TG、HOMA-IR、CK18-M30和FGF-21水平均顯著高于無合并癥患者,考慮是因為代謝相關性疾病降低NASH患者肝臟酶活性,脂肪變性加劇,減緩肝細胞正常代謝速度,堆積的TG增多,引發FGF-21水平升高,隨病情進展,肝細胞凋亡增加,CK18-M30的表達亦升高[20]。

