射頻消融術治療原發性肝癌患者接受胸腺素α1維持治療臨床價值探討*
周 顏,李國平,鄧 俊,楊美蓉,吳曉霞,張 英,朱宏英,陳 衛
射頻消融術(radiofrequency ablation,RFA)對小肝癌的治療療效肯定,已被廣泛應用于臨床[1-3],但治療后仍存在一定的腫瘤復發率。如何降低RFA術后肝癌的復發是近年來研究的熱點。本研究采用經皮超聲引導下RFA治療單個直徑≤5 cm的原發性肝癌(PLC)患者,并在術后給予胸腺素α1維持治療,觀察了術后腫瘤復發和生存情況,現將結果報道如下。
1 資料與方法
1.1 一般資料 2012年7月~2016年6月我院診治的PLC患者75例,男56例,女19例;平均年齡為(54.4±11.3)歲。診斷符合《原發性肝癌診療規范(2017年版)》[4],經臨床和組織病理學明確診斷,巴塞羅那分期(Barcelona Clinic Liver Cancer staging system)為A期。納入患者為既往未行手術或放化療等抗腫瘤治療的初治患者,為肝內單個病灶且腫瘤最大徑≤5 cm,腫瘤分期為Ia期,影像學檢查除外門脈或肝靜脈等血管侵犯,排除肝外淋巴結或器官轉移,有介入手術禁忌或不愿接受手術治療者。所有受試者簽署知情同意書,本研究經我院醫學倫理委員會審核通過。
1.2 RFA術 使用上海邁德醫療科技有限公司生產的邁德S-1500腫瘤射頻治療儀,在B超引導下完成射頻消融術。局部麻醉,將外科電極經皮插入肝癌病灶,行射頻消融。設置消融溫度為90~95℃,消融10 min。術中,給予常規鎮靜、止痛、護肝和對癥處理。
1.3 胸腺素α1治療 在RFA治療后,給予35例患者胸腺素α1(意大利蒙莎Patheon ltalia S.P.A.培森藥廠)1.6 mg皮下注射,1次/d,連續1 w,以后1次/2 d,連續3月。
1.4 隨訪與近期療效評估 在RFA術后1月行增強CT和MRI檢查,評估療效。完全消融(CR)是指原病灶壞死完全,肝內無存活病灶。術后每1~2月復查肝臟B超,每3~4月復查肝臟增強CT或MRI。判斷腫瘤復發的標準是以發現新生肝癌結節、活動性病灶或者肝內外轉移病灶。在治療后隨訪36個月。
1.5 外周血淋巴細胞亞群和血清細胞因子檢測 使用貝克曼庫爾特FC500型流式細胞儀檢測外周血CD3+、CD4+、CD8+和NK細胞百分比;采用ELISA法檢測血清IL-2、IL-4、IL-10和IFN-γ水平(上述試劑均購自上海信帆生物科技有限公司)。
2 結果
2.1 兩組臨床資料比較 兩組性別和年齡(為列出)、是否存在肝硬化、肝功能Child-Pugh分級、腫瘤大小和腫瘤部位比較,差異無統計學意義(P>0.05,表1),具有可比性。
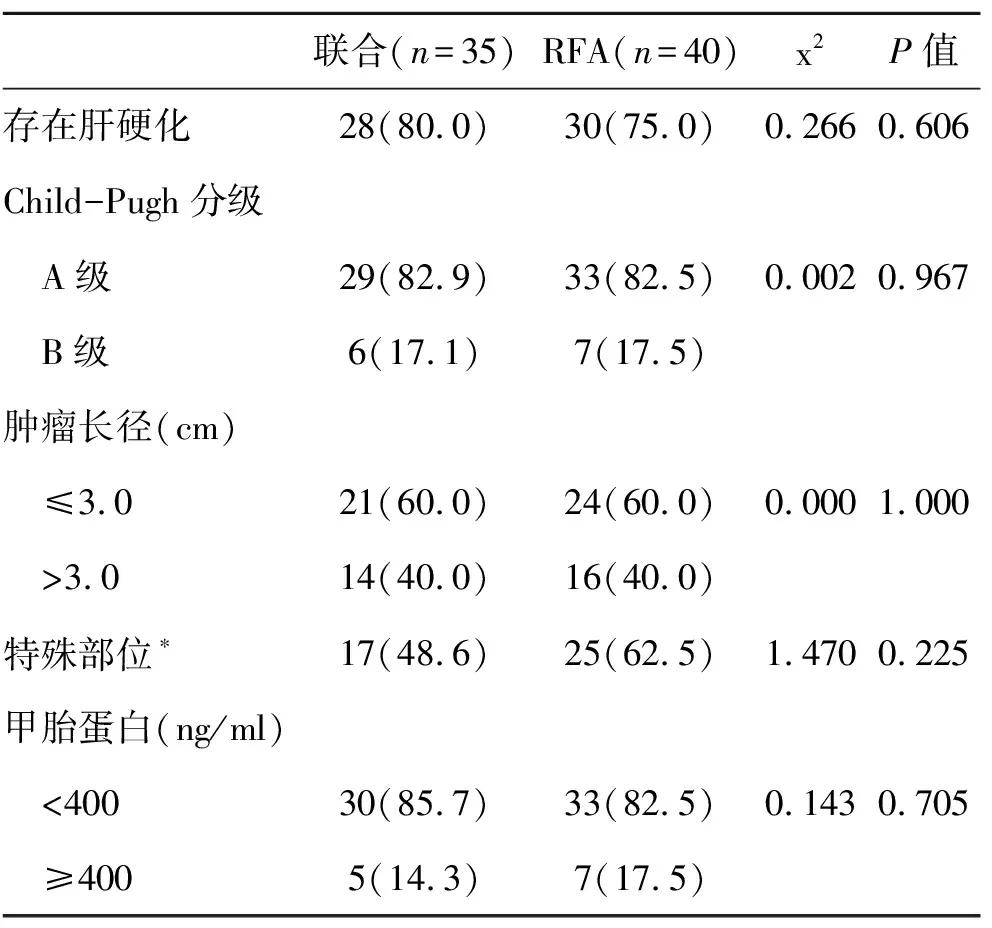
表1 兩組臨床資料【(n)%】比較
2.2 近期療效情況 在聯合組35例患者中,術后4周經增強CT檢查證實28例(80.0%)達到腫瘤完全消融(圖1、圖2),7例(20%)未完全消融。在一個月內完成補救治療,結果6例(17.1%)達到完全消融,另1例經肝動脈化療栓塞術(TACE)治療后達到完全緩解;在RFA治療的40例患者,術后兩周經增強CT或MRI檢查證實33例(82.5%)達到完全消融,7例(17.5%)未完全消融。在一個月內完成補救治療,經再次消融均達到完全緩解。兩組間療效比較無顯著性差異(x2=0.077,P=0.782)。術后,所有患者均未發生出血、感染、胸水等嚴重并發癥。
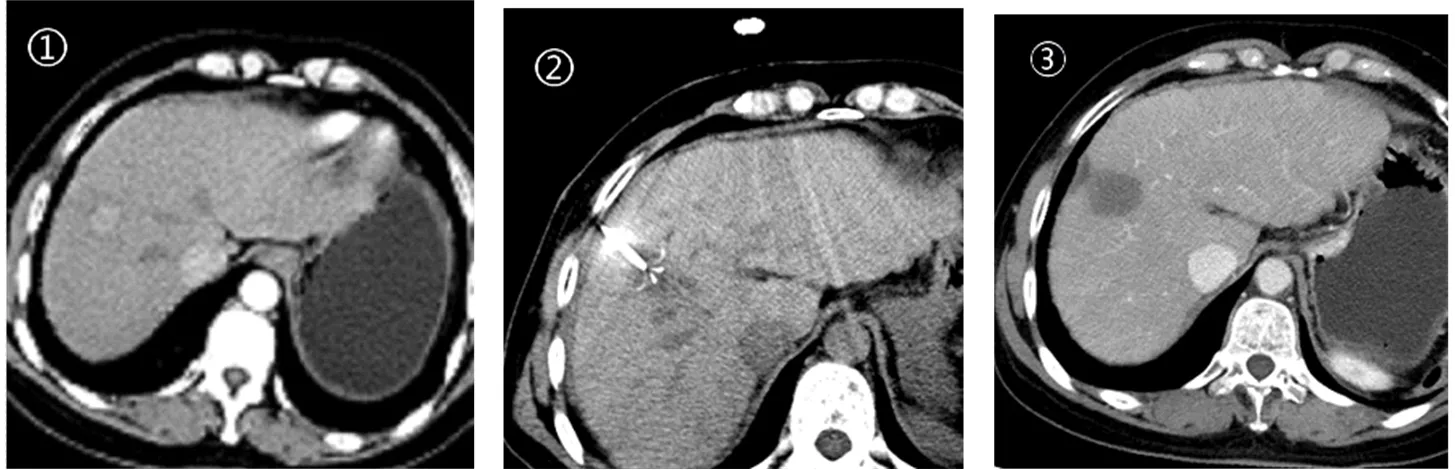
圖1 PLC患者腹部CT表現1:射頻消融前;②射頻術治療中;③術后一月,CT檢查顯示病灶被完全消融
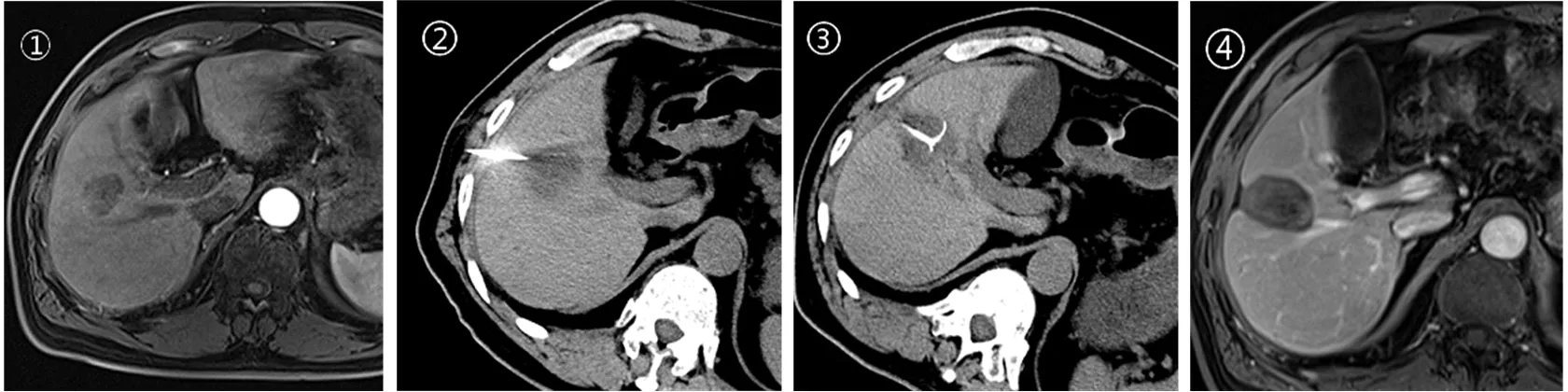
圖2 PLC患者腹部影像學表現①射頻消融前;②肝穿刺檢查;③射頻消融術進行中;④射頻消融術后一個月復查MRI,提示病灶被完全消融
2.3 兩組外周血T細胞亞群和血清細胞因子變化比較 治療前后,兩組外周血T細胞亞群和血清細胞因子水平無顯著性統計學差異(P>0.05,表2);在治療3月末,聯合組血清IL-2和IFN-γ水平顯著高于RFA治療組,差異存在統計學差異(P<0.05,表3)。
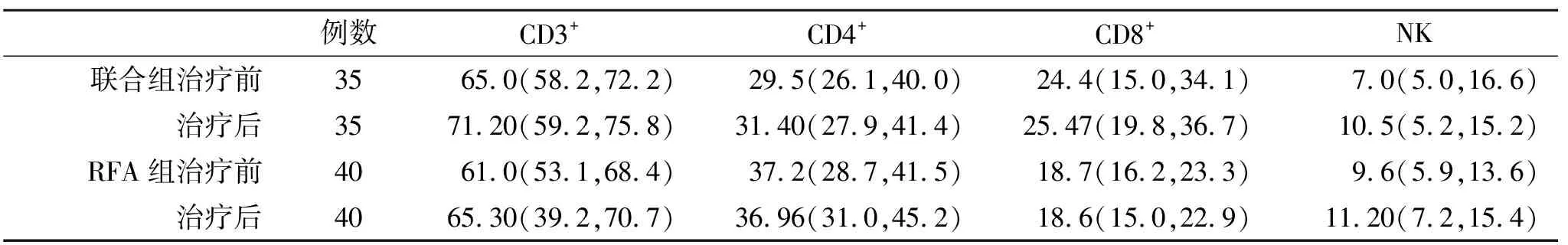
表2 兩組T細胞亞群【%,M(P25,P75)】比較
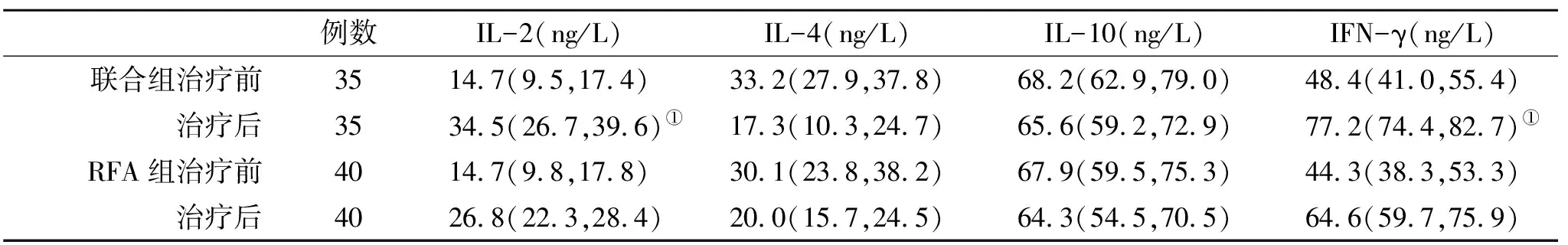
表3 兩組血清細胞因子水平【M(P25,P75)】比較
2.4 兩組預后比較 聯合組中位無復發生存(relapse-Free Survival ,RFS)期為26個月,RFA治療組為23個月。經Kaplan-Meier生存分析提示兩組患者無復發生存率差異無統計學意義(圖3)。聯合組1 a、2 a和3 a無復發生存率分別為62.9%、28.6%和5.7%,而單行RFA治療組分別為55.0%、17.5%(P<0.05)和0.0%,提示在RFA術后應用胸腺素α1治療有一定的效果。多因素分析顯示是否應用胸腺素α1治療、病灶大于3 cm、特殊部位的病灶和治療后是否獲得CR等影響RFA治療后患者的預后(表4)。
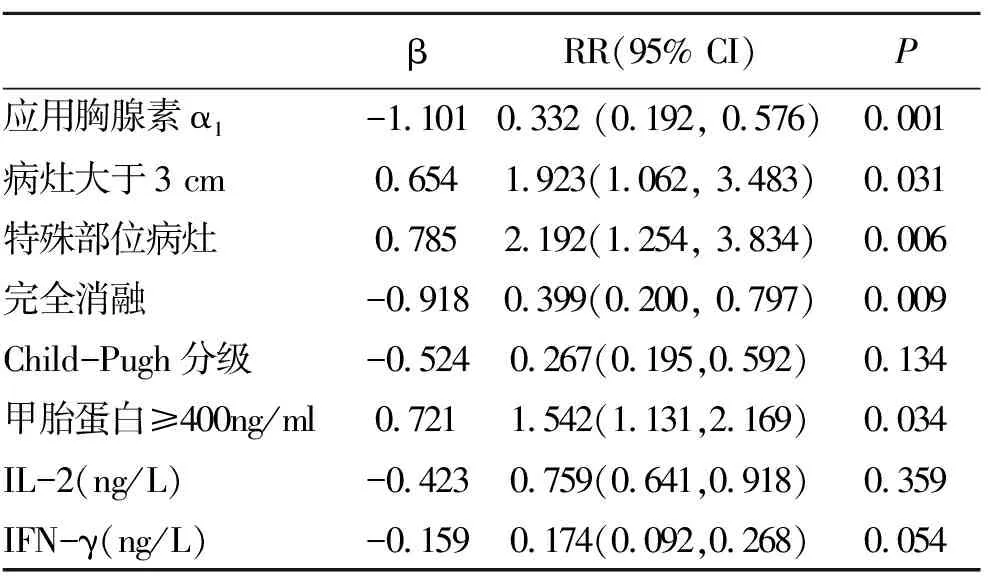
表4 影響RFA治療的原發性肝癌患者預后的多因素COX回歸分析
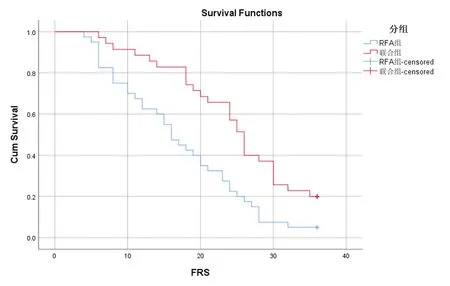
圖3 兩組無復發生存曲線
3 討論
早期肝癌的治療首選外科手術[5],但由于我國肝癌患者大多有慢性肝病或肝硬化基礎,手術切除治療受到限制,局部消融治療已被作為這些患者的一線方案[6]。在超聲引導下經皮穿刺射頻消融治療因其便捷、微創、安全性高、費用低和恢復時間短等優勢得到廣泛應用,但仍存在一定的腫瘤復發率。在影響射頻消融療效的因素中,包括腫瘤大小、位置、數量、肝臟的基礎情況和手術者的經驗等。在如何提高射頻消融的治療效果、降低復發率、延長生存期方面,國內外研究大多主張與其他局部治療手段聯合[7]。研究發現射頻消融術后進行替吉奧節拍化療治療肝癌可以減緩腫瘤進展,延長肝癌患者的無疾病進展時間[8]。
目前,大量研究表明RFA治療除了直接滅活腫瘤以外,還通過多種機制提高機體抗腫瘤免疫能力[9,10],包括腫瘤經消融后免疫抑制被緩解、壞死的腫瘤細胞形成“疫苗”[11,12]和誘導特異性細胞毒性T細胞(CTL)的產生等[13]。RFA的熱效應使腫瘤抗原發生改變,從而增強腫瘤抗原性[14]。產生HSP70等熱休克蛋白,參與腫瘤抗原遞呈,從而激發T淋巴細胞介導的機體細胞免疫反應[15],還可能通過局部炎癥反應導致免疫反應增強[16]。在此基礎上,如何更進一步激發患者抗腫瘤免疫機制以提高療效、降低復發率、延長生存期,還需要研究。胸腺素α1是人工合成的28個氨基酸的多肽,可以促進T淋巴細胞成熟,誘導成熟T細胞分化為各種不同的T細胞亞群,刺激T淋巴細胞分泌不同種類的淋巴因子增加[17,18],比如干擾素和IL-2等,與多種淋巴因子相互協同增強T淋巴細胞的免疫反應。有研究[19,20]發現經手術或介入等局部治療的肝癌患者,在聯合胸腺素α1維持治療能不同程度地提高療效,預防腫瘤復發,延長患者生存期。
在本研究中,聯合組共有35例患者在射頻消融術后應用胸腺素α1,經三個月的治療,結果顯示,兩組近期療效無顯著性差異(x2=0.077,P=0.782)。術前術后兩組T細胞亞群無顯著性統計學差異,而聯合組射頻消融術后血清IL-2和IFN-γ水平顯著高于RFA治療組,差異有統計學意義(P<0.05)。IL-2和IFN-γ作為Th1型細胞因子可刺激NK細胞和CTL細胞活化,并促進腫瘤細胞凋亡,具有正性抗腫瘤免疫作用。在射頻消融治療后給予免疫調節治療可以提高機體抗腫瘤免疫,進一步提升抗腫瘤細胞免疫功能。經隨訪,免疫治療患者1 a、2 a和3 a無復發生存率高于未進行免疫治療者,提示聯合使用胸腺素α1治療通過增強機體的抗腫瘤免疫反應顯著降低了射頻消融術后腫瘤復發率。
射頻消融治療作為早期肝癌患者的有效治療手段已被廣泛應用。本研究結果顯示聯合使用胸腺素α1可以進一步提升機體抗腫瘤免疫功能,從而降低射頻消融術后腫瘤復發率,延長生存期。當然,本組資料僅為小樣本研究,尚有諸多因素可能影響研究結果的可靠性,因此存在較大的局限性,尚需更多更深入的研究觀察。

