通過超高效液相色譜—四極桿-靜電場軌道阱高分辨質譜聯用儀對人尿中42種小肽類禁用物質進行興奮劑檢測
劉赟璽 董天宇 張玉峰 常巍 王占良
國家體育總局反興奮劑中心(北京100029)
在20世紀,人們最初提出的理論認為,蛋白質必須在胃腸道完全消化成游離氨基酸后,才能被機體吸收,后轉運至各個組織參與代謝[1]。然而,在20世紀80年代后,大量的研究表明,介于蛋白質與氨基酸之間的肽類物質,也是蛋白質代謝吸收的一種方式[2]。而隨著對肽類物質的深入研究,人們意識到肽類物質除了具備良好的穩定性、耐受性、被機體吸收利用率高等共同特性以外,特定的肽類物質還具有神經遞質、免疫活性、抗氧化活性等作用[3,4]。而對于運動員來說,部分肽類物質可以刺激機體分泌生長激素,從而影響機體的新陳代謝,促進骨、軟骨、肌肉等的細胞分裂,促進蛋白質合成,促進脂肪分解提供能量,抑制對葡萄糖的利用,減少對葡萄糖的消耗[5]。又因為肽類物質易于購買獲得,所以成為營養學,藥學以及興奮劑濫用的又一熱點。
由此,1989年國際奧林匹克委員會引入新的興奮劑類別“肽類激素及其類似物”[6]。在2021年的世界反興奮劑機構(World Anti-Doping Agency,WADA)的禁用清單[7]中,肽類物質被歸類于S2肽類激素、生長因子、相關物質和模擬物,還有部分屬于S5 利尿劑。而小肽類物質一般是指分子量小于2 kDa 的肽類物質,通常含有2個以上的以肽鍵相連接的氨基酸片段[8],因其在高溫下結構會被破壞,氣相色譜并不適用于小肽的檢測。所以近些年來,采用固相萃取(solid-phase extraction,SPE)純化并通過液相色譜-串聯質譜法(liquid chromatography- tandem mass spectrometry,LCMS/MS)測定生物液體(如尿液)中含有的小肽,已成為藥物檢測領域中常用的方法。然而,該方法樣品預處理用時較長,步驟復雜,所需有機溶劑也較多,還需要使用SPE 柱以及固相萃取裝置,并需要花費大量人力物力。分析儀器的改良,為檢測樣品提供了更高的靈敏度,從而使得一些簡單快速的樣品預處理方法得到更好的應用,如直接進樣方法[9]。
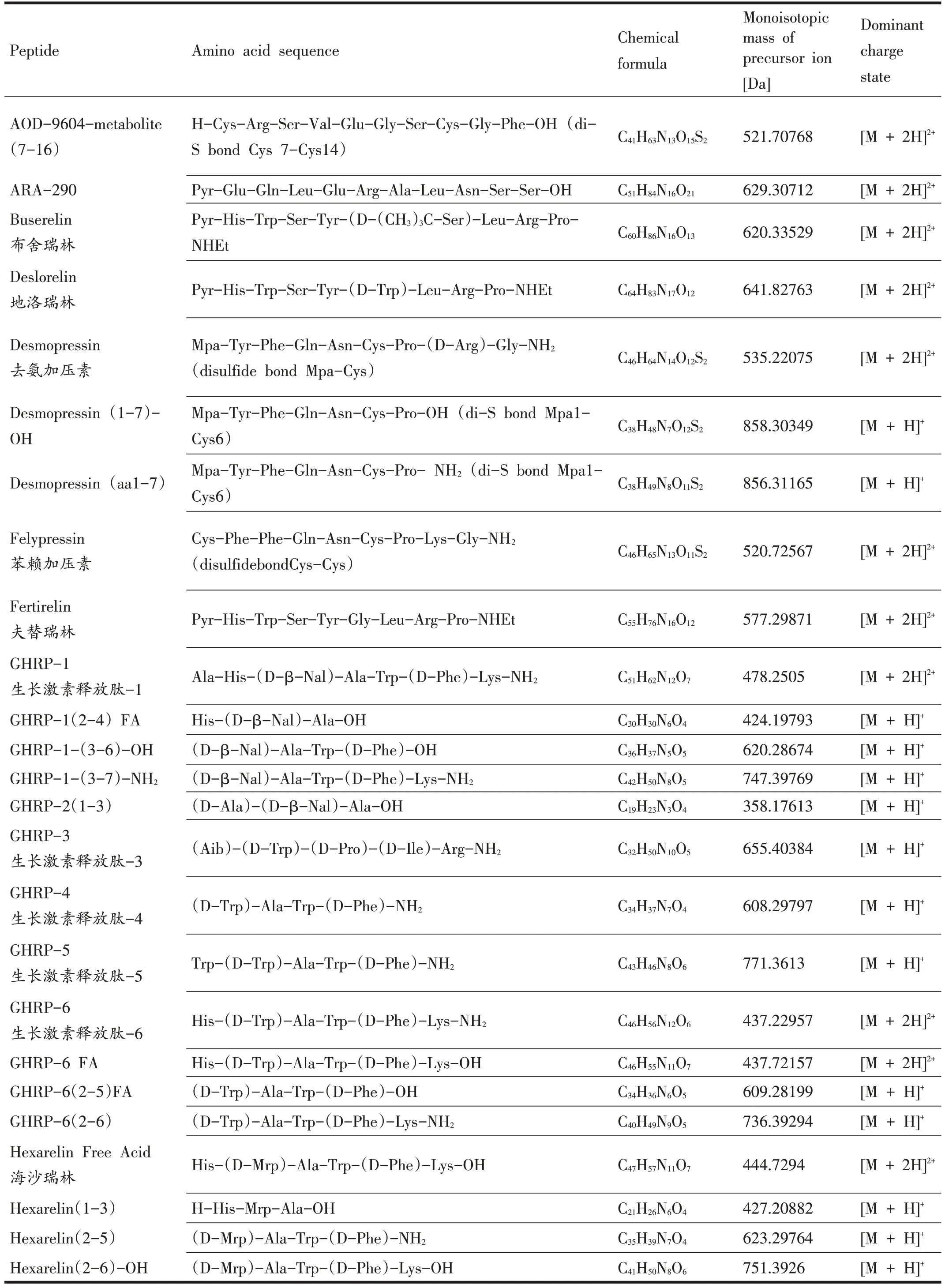
目前,本實驗室采用的分析儀器為超高效液相色譜-Q Exactive Plus 組合型四極桿 Orbitrap 質譜儀(ultra-high performance liquid chromatography-Q exactive plus hybrid quadrupole-orbitrap mass spectrometer,Q Exactive Plus UHPLC/HRMS),其具備高靈敏度、高精確度以及高分辨率,可提高結果的可靠性。本研究的目的是基于使用Q Exactive Plus UHPLC/HRMS 聯用儀,開發和評估一種簡單、快速、高效的樣品預處理及分析方法,并且保留樣品檢測的靈敏度和特異性,滿足WADA 技術文件中所規定的最低要求檢測濃度(minimum required performance levels,MRPL:)2 ng/mL,用于同時檢測人體尿液中不同類別的小肽類禁用物質或代謝物(共42 種),以便涵蓋WADA 禁用清單中生長激素促分泌劑類(growth hormone secretagogues,GHS) 、生長激素釋放肽類(growth hormone-release peptides,GHRP)、促性腺激素釋放因子(Gonadotrophin-releasing factors,GnRHs)、人類生長激素(Human Growth Hormone,hGH)、生長因子以及生長因子調節劑等分類的小肽類禁用物質、片段及代謝物,還包括兩種利尿劑去氨加壓素(Desmopressin)和苯賴加壓素(Felypressin)及其代謝物(表1)。

表1 42種小肽類禁用物質及其氨基酸序列[8,10,11]
(續表1)
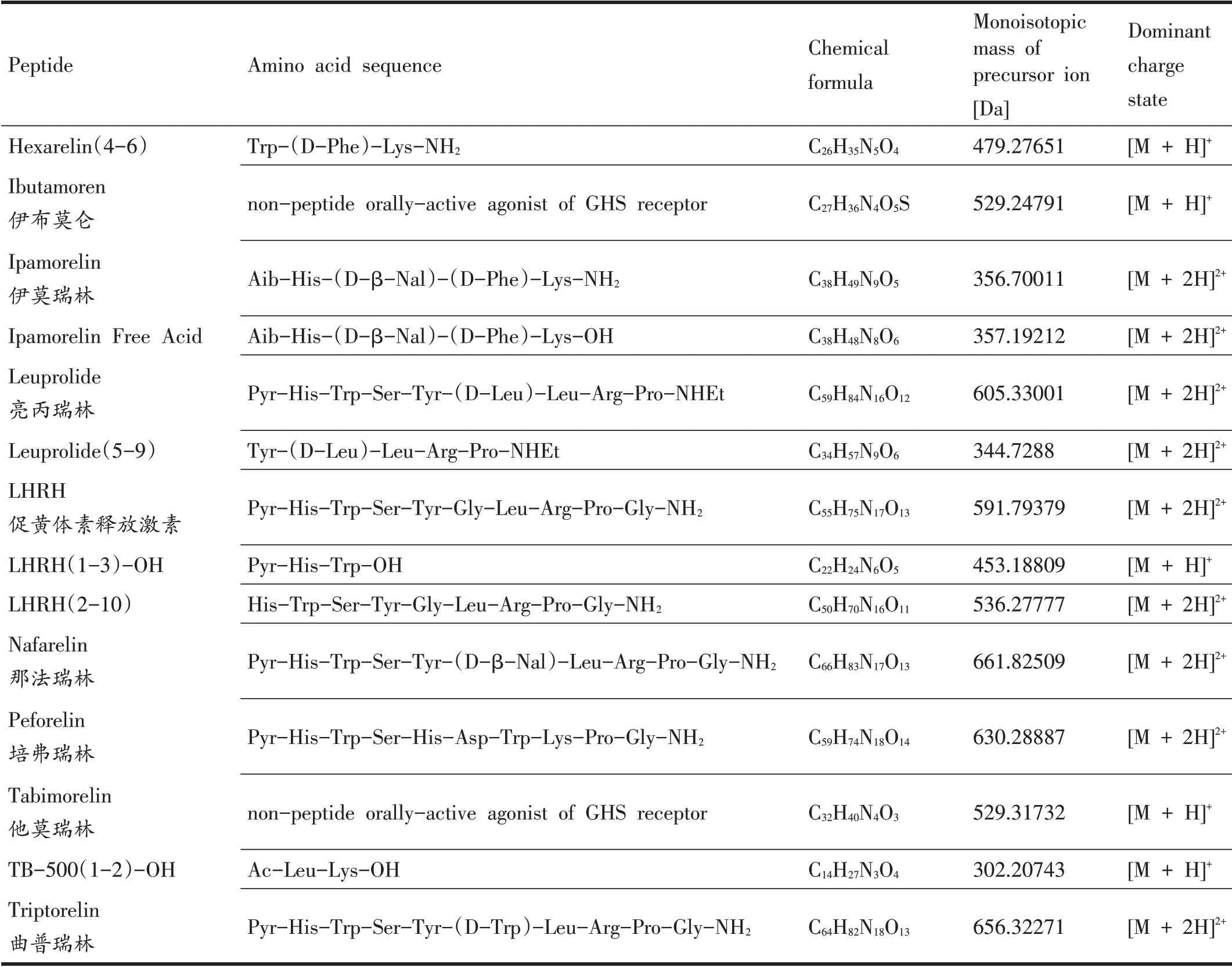
(續表1)
1 實驗部分
1.1 標準品與試劑
標準品GHRP-1、GHRP-4、GHRP-5 來源于美國Abbiotec.LLC.;標準品Alexamorelin(3-6)-OH、AOD-9604-metabolite(7-16)、ARA-290、Desmopressin(1-7)-OH,Desmopressin(aa1-7)、Fertirelin、GHRP-1(2-4)FA、GHRP-1-(3-6)-OH、GHRP-1-(3-7)-NH2、GHRP-2(1-3)、GHRP-6 FA、GHRP-6(2-5)FA、GHRP-6(2-6)、Hexarelin(1-3)、Hexarelin(2-5)、Hexarelin(2-6)-OH、Hexarelin(4-6)、Ipamorelin Free Acid、Leuprolide(5-9)、LHRH(1-3)-OH、LHRH(2-10)、Peforelin、Anamorelin、TB-500(1-2)-OH、Ipamorelin 均來源于澳大利亞Auspep;標準品Alexamorelin、Desmopressin、Leuprolide 來源于德國Merck(Sigma-Aldrich);標準品Buserelin、Deslorelin、Hexarelin Free Acid、LHRH、Nafarelin、Triptorelin 來源于美國US Biological Life Sci.公司;其余標準品以及其來源:Ibutamoren(Key Organics,美國),Tabimorelin(吉爾生化上海有限公司),Felypressin(MedChemExpress,美國),GHRP-6(ProSpec-TanyTechnoGene Ltd.,以色列),GHRP-3(Toronto Research Chemicals,Inc.,加拿大);內標(Deamino-cys1,val4,D-arg8)-Vasopressin(DCVDV)來源于吉爾生化上海有限公司。
一次性耗材:2 mL 低吸附離心管(美國Axygen 公司)和250 μL低吸附內插管(美國Agilent公司)。
所需試劑:乙腈,甲醇,甲酸,甲酸銨(色譜純,美國DIKMA TECHNOLOGY Inc.公司),去離子高純水。
流動相A 的配置:稱取2.52 g HPLC 級別甲酸銨,放入4 L溶劑瓶中,加入4 L去離子高純水,加入2 mL甲酸溶液,充分混勻后,測量其pH值約為3.5,用裝載了0.45 μm Sartorius Stedim過濾膜的溶劑過濾器進行過濾后方可使用。
樣品稀釋溶液的配置:取90 mL上述流動相A,過濾后加入至試劑瓶中,再加入10 mL 甲醇,充分混勻,使得流動相A與甲醇最終體積比約為9∶1。
1.2 內標溶液及標準品溶液制備
取等體積的乙腈和水混合后加入1%甲酸配置成為標準品稀釋溶液。然后,取一定量的小肽固體標準品或內標標準品,加入對應量的1% 甲酸乙腈/水(1∶1)溶液,將其配制成為1 mg/mL的標準儲備溶液,渦旋后,再用標準品稀釋溶液將其逐級稀釋成為不同濃度的儲備液,最后得到1 ng/μL 的標準品溶液或0.5 ng/μL的內標溶液。
1.3 質量控制樣品的制備(QCN,QCP 的制備)
收集不同匿名化的空白尿樣混勻后,取3 份各1.5 mL按照小肽檢測方法前處理后進行分析,確定不含待檢測物質,則該尿液樣本可作為陰性質量控制樣品(quality control negative,QCN)。取檢測過的空白樣品,并加入適當濃度的標準品溶液,即可獲得陽性質量控制樣品(quality control positive,QCP)。
1.4 儀器設備
Ultimate 3000 超高效液相色譜-Q Exactive Plus組合型四極桿Orbitrap 質譜聯用儀(Q Exactive Plus UHPLC/HRMS)(美國Thermo Fisher Scientific 公司)、METTLER PM200 分析天平、Genie Vortex-2 渦旋混合器(美國ScientificIndustries 公司)、高速離心機(美國SCILOGEX 公司)。
1.4.1 色譜條件
液相色譜儀為Ultimate 3000 UHPLC,液相色譜柱為Hypersil GOLD 1.9 μm × 100 mm × 2.1 mm id。使用流動相A為10 mmol/L 甲酸銨溶液和流動相B為甲醇溶液進行梯度洗脫,洗脫程序如表2所示,流動相流速為0.25 ml/min,柱溫為30℃,進樣體積為10 μL,采集時間為14 min。

表2 色譜梯度洗脫程序
1.4.2 質譜條件
采用Q Exactive Plus 組合型四極桿Orbitrap 質譜儀,電噴霧離子源( HESI),以正離子模式掃描;輔助氣溫度(aux gas heater temp)為350℃,流速(aux gas flow rate)為10 arb;鞘氣流速(sheath gas flow rate):40 arb;噴霧電壓(spray voltage):3.5 KeV;離子傳輸管溫度(capillary temp):350℃;采集方式為全掃描(full scan)(resolution:70,000 FWHM;AGC:1e6;max.IT:100 ms;scan range:m/z 80 to 1000)和平行反應監測(parallel reaction monitoring,PRM)(resolution:35,000 FWHM;AGC:5e4;max.IT:100 ms;isolation window:2.0 m/z;nce:40)兩種方式。
1.5 樣品前處理
取1.5 mL 待測樣品至低吸附離心管中,放置至室溫后,與QCN和QCP一起加入20 μL內標溶液(0.5 ng/μL DCVDV),渦旋混勻后,以10000 r/min 離心10 分鐘。將離心后的樣品取150 μL 上清液轉移至進樣瓶中,加入150 μL 樣品稀釋溶液,渦旋混勻后,用Q Exactive Plus UHPLC/HRMS進樣分析。
2 結果
2.1 實驗結果
按上述實驗方法,采用Q-Exactive plus UHPLC/HRMS 液質聯用儀的全掃描(full scan)和平行反應監測(PRM)模式對含有42 種小肽類禁用物質及內標的陽性質量控制樣品(QCP)進行定性分析,得到圖1所示譜圖。如圖1 所示,在1/2 MRPL 下,本方法均可以正確檢出尿樣中的小肽類目標化合物(其信噪比S/N>3),色譜峰峰型良好,譜圖清晰,其峰高及半峰寬均可滿足WADA 的相關技術文件[12]的要求。而陰性質控樣品(QCN)的譜圖在與圖1 對比后,在相同保留時間,目標化合物選擇相同離子碎片,QCN 的窗口中均未出現干擾峰,因此,該方法具備較高的特異性和可靠性。
2.2 方法驗證
該方法驗證程序是基于WADA實驗室國際標準以及相關技術文件等。主要針對定性檢測42 種小肽類禁用物質或其代謝產物(分子量均小于2kDa),表3 所示為采集過程中所使用的42 種小肽物質的主要質譜參數:Full scan 母離子和3 個PRM 掃描的特征離子碎片的質荷比(通過實驗優化,選取3 個干擾較少、豐度比較高的離子作為特征離子)及保留時間。通過對檢出限、假陽性率以及基質效應的考察(如圖1、表3和表4 所示),該方法具有高特異性、高靈敏度、高精確度及較好的穩健度(保留時間較為穩定),且滿足WADA 對小肽類物質MRPL(2 ng/mL)的要求。此方法為直接進樣分析,因此無需考察回收率。

表3 主要質譜參數(Full scan和PRM)及保留時間

圖1 含42種小肽類禁用物質及內標的陽性質量控制樣品(QCP)的UHPLC/HRMS PRM譜圖
2.2.1 檢出限
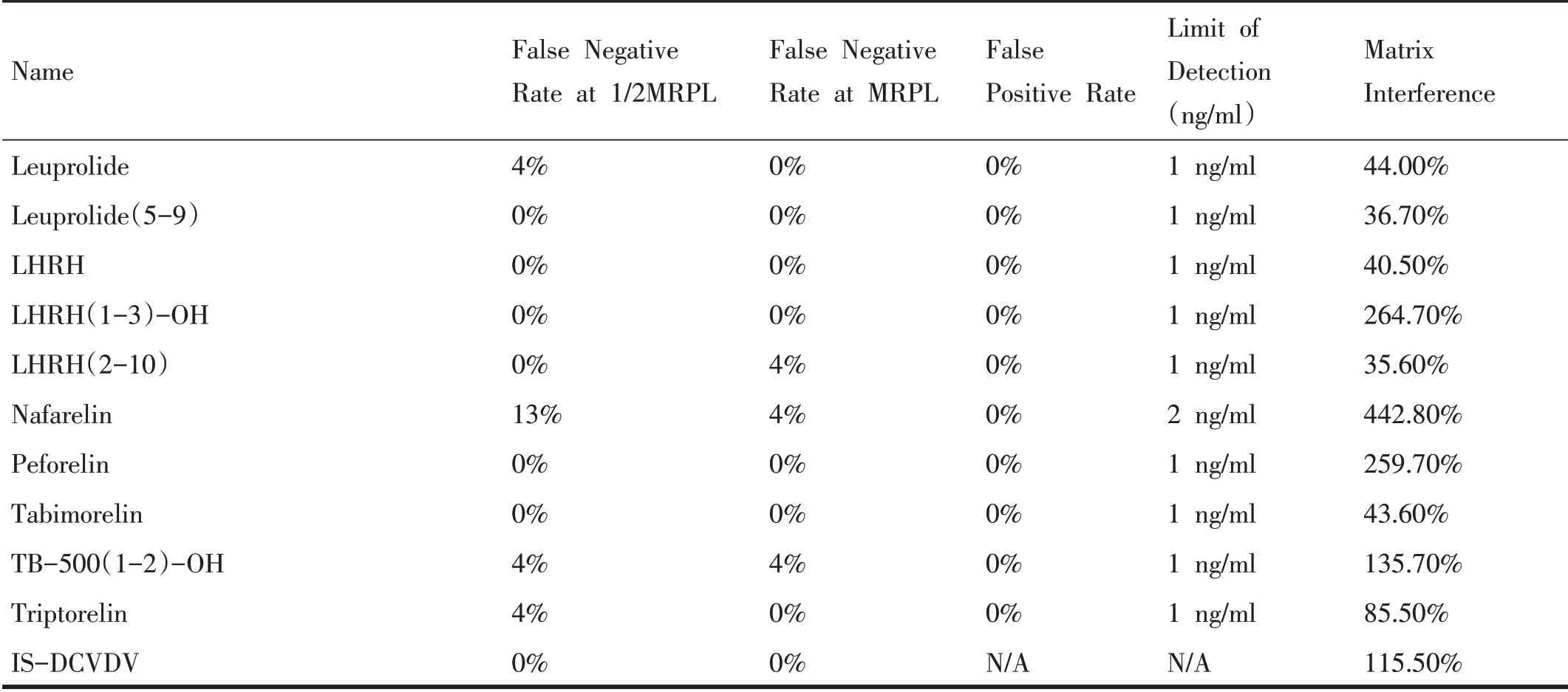
選擇不同性別、比重(1.005~1.030)、pH(5~9)的空白尿樣(不少于10 份),分別取1.5 mL,并加入42 種小肽類禁用物質的標準溶液和內標溶液,濃度均為MRPL 水平,混勻后按上述直接進樣方法進行前處理,分別取150 μL 和50μL 上清液轉移至進樣瓶中,各加入150 μL樣品稀釋溶液,渦旋混勻后,進樣分析,當信噪比S/N>3則認為檢出,與尿樣總數相比,若檢出率大于90%(即假陰性率≤10%),則該濃度水平為該目標化合物的檢出限(limit of detection,LOD)。由表4 可以看出,在MRPL濃度下,42種目標化合物的檢出率均大于90%。而在1/2MRPL 的濃度下,除了Alexamorelin、AOD-9604-metabolite (7-16)、Deslorelin、GHRP-4、Nafarelin 外,其余目標化合物的檢出率也均大于90%。42種小肽類目標化合物檢出限的相關結果見表4。
2.2.2 假陽性率的計算
取不同性別、比重(1.005~1.030)、pH(5~9)的空白尿樣(不少于20 份),加入內標,進行直接進樣方法前處理后,進樣分析。統計每種禁用物質在確定的保留時間的窗口內出現明顯干擾的樣品個數(信噪比S/N>3)與尿樣總數相比,即為假陽性率,相關結果見表4。
2.2.3 基質效應的計算
另取300 μL 樣品稀釋溶液,并加入MRPL 水平的相同禁用物質的標準溶液和內標溶液,混勻后進樣分析。通過對比前處理樣品分析物的峰面積(A)和加在流動相標準溶液中分析物的峰面積(B)來評估基質效應,按以下公式計算:基質效應=(A/內標峰面積)÷(B/內標峰面積)× 100%。相關結果見表4。

表4 42種小肽類目標化合物的假陰性率、假陽性率、檢出限以及基質效應
(續表4)
3 討論
通過上述結果可以看出,直接進樣方法可以保留更多樣品信息,不會因為提取、純化和預處理的過程,造成丟失部分樣品信息,尤其是那些在SPE 提取過程中會出現信息大量損失的目標化合物,如LHRH(1-3)-OH、ARA-290等,這樣可以更好地覆蓋不同的小肽類物質。對于一些目標化合物,保留更多信息使其半峰寬變窄,峰高增大,峰型效果變好,審閱報告時更容易判斷。而且由于直接進樣方法簡單,無需大量的試劑,步驟少,處理方式快速,這樣可以節省人力物力,同時降低了前處理過程中可能引入的誤差。該方法可以快速處理大量樣品,避免樣品積壓導致的長時間存放產生的微生物降解等問題的發生。
然而,由于樣品未經過提取純化的處理,直接稀釋后進樣,樣品中含有更多的雜質,導致譜圖中噪音增大,對有些目標化合物的信噪比影響也隨之增大,致使一些目標化合物在低濃度時,出峰效果不好,干擾較多。同時,未經提取純化的樣品,也會導致基質效應變大,從而對實驗結果產生影響。因此,對于一些小肽類禁用物質,如AOD-9604,GHRP-2 等,本方法在MRPL濃度下尚不足以完成常規檢測。在以后的實驗中,仍需考慮將SPE方法和直接進樣方法的前處理程序相結合,以達到對不同小肽類禁用物質及其代謝物的廣泛覆蓋,提供更高特異性及高效率的初篩檢測方法。另一方面,由于直接進樣方法中尿液樣品中含有大量雜質(如尿蛋白、大肽等),盡管本方法已使用離心后尿液樣品的上清液,但比起純化后的樣品,本方法還是更容易堵塞液相色譜柱。
4 總結
綜上所述,直接進樣的前處理方法,使得樣品前處理的程序變得簡單、高效,同時因為采用了Q Exactive Plus UHPLC/HRMS,所以盡可能多地保留了較高的檢測靈敏度和特異性。本研究對該方法的檢出限、基質效應等都進行了考察。實驗結果表明,該方法的條件易于控制,結果準確,對于本次研究的42 種小肽類禁用物質或其代謝物,均可以完成常規檢測,并能滿足WADA對此類藥品檢測能力的要求。

