RNAi在儲糧害蟲防治應用中的研究現狀及展望
王康旭 陳二虎 唐培安
(南京財經大學食品科學與工程學院;江蘇省現代糧食流通與安全協同創新中心,南京 210023)
以RNA干擾(RNA interference, RNAi)為代表的基因沉默技術是當今生命科學領域最重要的革命性成果之一[1]。通過向生物體內導入靶向目標基因的雙鏈RNA(double-stranded RNA, dsRNA)片段,經過細胞識別和吸收后,在細胞質中dsRNA分子會被 Dicer-2(Dcr2)酶切割成為18~25 bp左右的小干擾RNA(small interfering RNA,siRNA),siRNA能夠招募相關蛋白聚集形成沉默復合體(RISC),并通過siRNA序列互補特性引導 RISC識別靶 mRNA使之降解,從而實現對目標基因的特異性抑制[2]。目前,RNAi技術被廣泛用于功能基因組學、疾病治療等領域[3]。與此同時,RNAi也給現代農業帶來了巨大的發展契機,為作物性狀改良、有害生物防控和糧食儲藏等方面提供了新的研究思路和應用策略。
儲糧害蟲嚴重影響了世界糧食及食品安全。據聯合國糧農組織計算,在發達國家中,因害蟲導致的儲糧損失年均在5%~10%,而在發展中國家中,這一數字則高達30%[4]。而實際上,由于害蟲活動所造成的食品污染、防治成本等因素,使得儲糧害蟲所造成的損害遠高于目前的統計數字。
磷化氫熏蒸是目前應用最為廣泛的儲糧害蟲防控技術,然而,由于在儲糧保護領域長達60余年的單一使用,越來越多的害蟲種群對磷化氫產生了抗藥性,新型害蟲防治技術的開發迫在眉睫[5]。利用RNAi技術,一方面我們可以篩選并抑制跟害蟲抗藥性產生相關的關鍵基因,通過解決抗性問題恢復害蟲對藥劑的敏感性[6];另一方面通過RNAi技術能夠篩選出害蟲防治的靶標基因,以dsRNA作為新型核酸農藥直接應用于害蟲防治。
基于RNAi的害蟲防治技術具有較高的物種專一性,另外,通過選擇不同的靶標基因以及不同的dsRNA片段可以控制抗性害蟲的產生,因此被認為具有重要的生產應用前景[7]。近年來,多篇綜述從其作用機理、效率影響機制等方面對RNAi技術在作物害蟲防治領域的研究情況進行了系統性的總結[7-9]。而本文將首次從儲糧害蟲防控的角度,對RNAi技術的重要進展和應用前景進行概括,期望為未來利用該技術對儲糧害蟲進行生物學研究以及綠色防治提供參考。
1 RNAi在儲糧害蟲中的研究現狀
總的來說,基于RNAi的害蟲防控就是通過設計合適的dsRNA序列,使其特異性地靶向害蟲生長發育過程中的必需基因,在dsRNA進入害蟲細胞后激活RNAi反應,從而抑制靶標基因的表達來降低蟲體的適應性甚至產生死亡。2017年,美國環保署(EPA)批準了第一個基于RNAi的害蟲防治產品,標志著RNAi害蟲防治產品的商品化開端[10]。值得注意的是,儲糧害蟲中的RNAi研究起步較早,尤其是在靶標基因篩選、應用途徑等方面進行了大量的探索,取得了一些重要進展。
1.1 RNAi應用于鞘翅目儲糧害蟲的可行性情況
鞘翅目是儲糧昆蟲中種類最多、數量最大的一類害蟲,該類昆蟲不僅能夠直接取食儲藏的糧油食品,還能通過次級代謝物的分泌對儲糧產生間接的危害,同時多種鞘翅目害蟲已經對傳統的熏蒸方式產生了較高的抗性,因此,開發基于RNAi的新型害蟲防治方法對該類害蟲防控的意義重大[4,11,12]。在儲糧昆蟲中,赤擬谷盜是最早使用RNAi進行研究的對象,Brown等[13]在赤擬谷盜卵期注射致畸基因Deformed的dsRNA,導致胚胎畸形和死亡,并且隨著赤擬谷盜全基因組的測序,該蟲逐漸作為模式昆蟲被廣泛用于RNAi的研究之中。對于該蟲的研究表明,跟發育相關的基因能夠作為潛在的RNAi靶標位點用于害蟲防治。例如,Arakane等[14,15]就發現向赤擬谷盜幼蟲微量注射幾丁質去乙酰化酶基因(ChitinDeacetylase,CDA)或幾丁質合成酶基因(ChitinSynthase,CHS)的dsRNA后,試蟲的幾丁質代謝被干擾,死亡率顯著提高。相較于零星的功能基因鑒定,“iBeetle” 項目則利用dsRNA顯微注射技術在全基因組解析的基礎下對1/3的赤擬谷盜基因(約5000個)進行了大面積的功能分析,對每個候選基因沉默后的表型進行了統計[16],在此基礎上,Ulrich等[17]通過分析抑制后出現致死表型的快慢和死亡試蟲比例對致死基因進行篩選,挑選出了11個防治赤擬谷盜效率最高的RNAi靶標基因(表1),而這些基因在其他物種中的同源基因同樣表現出了極強的致死效應[18]。另外,在赤擬谷盜中的研究還表明,利用RNAi抑制部分細胞色素P450基因的表達能夠使得抗性害蟲恢復對磷化氫等化學藥劑的敏感性,為抗性治理提供了新思路[19,20]。
伴隨著RNAi在赤擬谷盜中的大量應用,該技術在其他鞘翅目儲糧害蟲中的效果也逐漸得到了證實。在玉米象(Sitophiluszeamais)中,Vallier等[21]通過dsRNA注射(200 ng/頭)將肽聚糖識別蛋白(Peptidoglycan Recognition Protein)基因的表達量敲低至對照組的2%,而Huang等[22]利用dsRNA喂食玉米象,抑制了細胞色素P450相關基因的表達,提高了試蟲對松油烯-4-醇的敏感性。在煙草甲中,研究人員通過向初孵幼蟲連續喂食含有靶向致死基因SNF7或26Sprot的dsRNA溶液,20 d后的試蟲死亡率分別為95%和93%[23]。在銹赤扁谷盜(Cryptolestesferrugineus)中,Zhang等[24]分別通過喂食和注射dsRNA的方式,成功抑制了幾丁質合成酶基因CHS2的表達。另外在藥材甲(Stegobiumpaniceum)中,通過注射靶向幾丁質乙酰化基因CDA1的dsRNA,可以影響試蟲的蛻皮現象,進而造成試蟲死亡[25]。

表1 赤擬谷盜RNAi高效致死基因
通過以上研究可以發現,抑制害蟲生理及生長發育中關鍵基因表達,能夠影響害蟲的生長發育情況,從而導致害蟲的死亡,這也表明利用RNAi防治鞘翅目儲糧害蟲的可能性高。
1.2 RNAi應用于其他儲糧害蟲的可行性情況
除了鞘翅目甲蟲外,還有蜚蠊目、嚙目和鱗翅目中的昆蟲同樣對儲糧造成了嚴重危害。其中,研究人員利用蜚蠊目害蟲作了大量RNAi相關工作。Martin等通過向德國小蠊(Blattellagermanica)幼蟲和成蟲注射dsRNA,抑制了核受體基因(RXR/USP)的表達[26],從而大大提高了試蟲死亡率;另一個研究中,研究人員向德國小蠊末齡幼蟲注射靶向蛻皮激素受體基因(ecdysonereceptorisoform-A)的dsRNA,導致試蟲出現了發育遲緩、畸形等現象,最終產生了明顯的防治效果[27];Lin等[28]則向德國小蠊喂食脂質體載體包裹的dsRNA,通過沉默微管蛋白基因(α-tubulin)造成了害蟲死亡。在另一種儲糧中常見的蜚蠊目害蟲美洲大蠊((Periplanetaamericana)中,Wang等[29]利用注射和喂食dsRNA的方式,顯著抑制了美洲大蠊幾丁質酶基因(Chitinase)的表達,抑制效率分別為82%以及47%;另外,我國科學家還利用RNAi技術對美洲大蠊全基因組測序后拼接比對的大量基因數據進行了功能鑒定,對影響該蟲生長發育、免疫等生理現象的重要基因進行了解析,為基于RNAi的防治研究打開了新的思路[30]。
對于鱗翅目儲糧害蟲RNAi研究主要集中在印度谷螟(Plodiainterpunctella)中,Fabrick等[31]通過胚胎注射dsRNA的方式成功抑制了色氨酸加氧酶基因(tryptophanoxygenase)的表達,影響了孵化后幼蟲的眼發育情況;Siaussat等[31]利用dsRNA注射,成功抑制了蛻皮激素(20-hydroxyecdysone)的生成,引起了下游發育相關基因的過量表達;Han等[32]通過dsRNA注射的方式激活了印度谷螟幼蟲體內的RNAi反應,有效沉默了胞內鈣非依賴型磷脂酶A2(Calcium-independent cellular phospholipase A2)基因的表達,從而提高了脂質過氧化水平,進一步分析還發現試蟲的抗細菌免疫能力也受到了顯著的影響。另外,在另一種鱗翅目儲糧害蟲粉斑螟蛾(Cadracautella)中,注射靶向卵黃原蛋白受體基因(vitellogeninreceptor)的dsRNA片段,可以導致成蟲生育力以及幼蟲孵化率的顯著降低,產生了良好的防治效果[31]。
嚙目的書虱類害蟲同樣對糧油食品的安全儲藏造成了嚴重影響,對于其RNAi的研究發現,嗜卷書虱(Liposcelisbostrychophila)體內酯酶(Esterase)家族的部分基因在喂食dsRNA后能夠得到顯著抑制,進一步生測實驗表明,試蟲對馬拉硫磷殺蟲劑的敏感性也得到了明顯的升高,提升了防治效率[33]。
通過以上研究可以發現,目前在儲糧害蟲中,對于鞘翅目和蜚蠊目昆蟲的RNAi相關研究較多,但同時發現,雖然利用RNAi對鱗翅目及書虱類儲糧害蟲進行防治具有可行性,但仍需在靶標基因、應用方式等方面進行系統性探索。
2 影響儲糧害蟲RNAi效率的關鍵因素
RNAi具有極高的序列特異性,因此在具體應用過程中能夠實現對害蟲的專一性防治,近年的研究也表明,利用RNAi對儲糧害蟲進行有效防治的可行性較高,相關理論研究取得了很大的進展。但是,研究結果同樣表明害蟲的RNAi效率還會受到多種因素的影響。以下,將從昆蟲種類與遞送方式選擇、靶標基因與dsRNA分子設計這兩個方面進行重點介紹。
2.1 昆蟲種類與遞送方式影響RNAi效率
注射和喂食體外合成的dsRNA是在儲糧昆蟲學研究中使用最多的兩種遞送方式[6,34]。然而目前的研究結果表明,RNAi效率會隨著昆蟲種類和遞送方式的不同而發生巨大的變化[35]。大部分鱗翅目昆蟲對于dsRNA注射和喂食的敏感性都較低,一般情況下只有進行dsRNA大量注射才能實現靶標基因的顯著抑制[36],作者實驗室的研究結果表明,利用人工飼料混合dsRNA對印度谷螟進行連續性喂食難以產生有效的RNA沉默。然而在德國小蠊和赤擬谷盜中,注射和喂食dsRNA被證明對其不同的靶標基因和生命階段都是行之有效的[26,37]。近年來,研究人員針對昆蟲RNAi種間差異開展了一些研究,發現dsRNA胞外降解、dsRNA細胞吸收和RNAi核心機制差異可能是導致昆蟲RNAi種間效率差異的關鍵原因。
Wang等[29]利用包括美洲大蠊在內的4種不同害蟲進行RNAi效率和降解比較實驗發現,不同昆蟲血淋巴的dsRNA降解能力是影響注射RNAi效率的重要因素,而腸道dsRNA降解能力是影響喂食RNAi效率的重要因素,昆蟲種間的 RNAi效率差異與其體內的dsRNA酶促降解能力密切相關,這種降解能力決定了昆蟲體內靶標組織附近的dsRNA暴露劑量從而影響了RNAi效率。在此基礎上,Peng等[38]對不同種類昆蟲的核酸酶生化特性進行了分析,然后又通過體外異源表達、基因沉默對赤擬谷盜體內的4種dsRNA酶(TCdsRNase)進行了功能鑒定,發現其中的TCdsRNase-1可能具體參與了外源dsRNA在腸道和血淋巴內的降解過程。另外,Guan等[39]發現了一種僅在幾種鱗翅目昆蟲種特異表達的核酸酶基因dsREase,通過功能驗證,發現其能夠快速降解dsRNA,但是目前該酶在鱗翅目儲糧害蟲中的功能尚待解析。
dsRNA只有進入細胞才能發揮出高效的RNA干擾效率。但是,dsRNA進入細胞涉及到多種機制和影響因素,而這些因素的種間差異都會導致RNAi效率的不同。在線蟲中dsRNA的細胞吸收主要是通過跨膜通道蛋白SID-1(Systemic RNAi Defective-1)的運輸[40],而Tomoyasu等[41]發現沉默赤擬谷盜體內SID-1相關基因并不影響RNAi效率,之后,Xiao等[42]發現網格蛋白介導的內吞作用可能具體介導了dsRNA進入赤擬谷盜細胞的過程。但是研究人員發現,胞飲作用、吞噬作用以及SID-1通道蛋白對于其他種類害蟲吸收dsRNA也具有重要的意義[43]。另外,在dsRNA入胞過程中,內體逃逸和載脂蛋白同樣影響了dsRNA的內化效率。因此,研究代表性儲糧害蟲中的dsRNA吸收機制有助于針對性提高RNAi防治效率。
RNAi 核心機制會影響沉默效率。一方面是核心機制的基因元件組成情況影響了RNAi效率,例如在赤擬谷盜中RNAi核心基因Ago2和R2D2各有兩個同源基因,而在一些RNAi效率較低的昆蟲中則只有一個[41];同時,Yoon等[44]在赤擬谷盜中鑒定出了鞘翅目特有的StaufenC基因,該基因參與了赤擬谷盜高效RNAi過程。另一方面,核心基因的表達情況影響了RNAi效率,例如當 dsRNA被注射進入德國小蠊時,關鍵基因Dcr2能夠在6 h內上調 5 倍,而在多數RNAi低效昆蟲中則沒有發現這種現象[8]。這些因素可能是導致昆蟲種間RNAi效率多樣性的原因之一。
2.2 靶標基因與dsRNA分子設計影響RNAi效率
合適的RNAi靶標基因需要具有:1)蛋白產物半衰期較短;2)表達于dsRNA較易到達的體內位置。例如在赤擬谷盜體內,煙堿型乙酰膽堿受體(nicotinic acetylcholine receptors)的穩定期大于 2 周,因此很難通過沉默該基因進行害蟲防治[45];另外,昆蟲體內的中央神經系統和生殖器官有類似于人體內血腦屏障的機制,影響了dsRNA體內分布[35]。
dsRNA 分子長度和靶向序列位置的選擇是設計 RNAi 實驗時需要考慮的兩個重要因素。在dsRNA長度選擇上,研究人員發現RNAi效率同dsRNA長度存在正相關,例如在赤擬谷盜中,Miller等[37]發現69-520 bp的dsRNA都能產生顯著的沉默效果,其中長dsRNA激發的RNAi更明顯;在此基礎上,Wang等[46]發現不同長度dsRNA在赤擬谷盜中產生的RNAi效率遵循以下規律:480 bp≈240 bp>120 bp>60 bp>>21 bp,進一步研究表明赤擬谷盜RNAi核心機制對不同長度dsRNA的親和力沒有明顯差異;21 bp dsRNA在赤擬谷盜中無法發揮RNAi作用的原因是細胞吸收障礙;而導致dsRNA效率出現480 bp ≈ 240 bp>120 bp>60 bp的主要原因,是昆蟲體內核酸酶對不同長度dsRNA的降解能力存在差異。對dsRNA靶向序列位置的研究發現,由同一個目標基因設計的不同位置的dsRNA所產生的基因沉默效果會有一定差異,例如在赤擬谷盜中,dsRNA具有較多的剪切偏好性位點,而在鱗翅目害蟲中具有特定的dsRNA剪切偏好性位點(例如GGU)[47]。所以在RNAi應用中要關注該問題。
3 提高儲糧害蟲RNAi效率的有效方法
提高害蟲 RNAi 敏感性的主要思路在于提高 dsRNA 在昆蟲體內的持續性,增加細胞吸收能力以及核心元件的工作效率。目前主要有轉基因和基因載體兩種方法在昆蟲學領域得到了廣泛應用。在農業害蟲中,基因載體得到了大量的應用,例如He等[48]利用熒光納米載體FNP在亞洲玉米螟(Ostriniafurnacalis)中提高了喂食RNAi效率,Zheng等[49]利用多聚物在大豆蚜(Aphisglycines)中實現了dsRNA觸殺效果等。在儲糧害蟲研究過程中,研究人員發現脂質體、殼聚糖和量子點等基因載體也有助于增加dsRNA在害蟲體內的遞送效率。具體來說,Avila等[50]利用支鏈兩親多肽(BAPC)提高了喂食dsRNA在赤擬谷盜體內的運輸擴散能力,提高了RNAi效率;在德國小蠊中的研究表明,脂質體材料可以保護dsRNA免遭體液中核酸酶降解,從而實現了100%的致死效率[28],另外,Huang 等[51]用脂質體包被dsRNA的方法,發現只需要少量dsRNA就能在德國小蠊體內實現對靶標基因的沉默效果;在鱗翅目儲糧害蟲中,作者以印度谷螟為研究對象發現單獨喂食dsRNA無法產生有效的基因沉默,但是在利用殼聚糖、量子點CQD和脂質體Lipofectamine2000對dsRNA進行包裹后,3種載體都能有效提高靶標基因的RNAi致死效率,其中CQD的增效最好(圖1)。
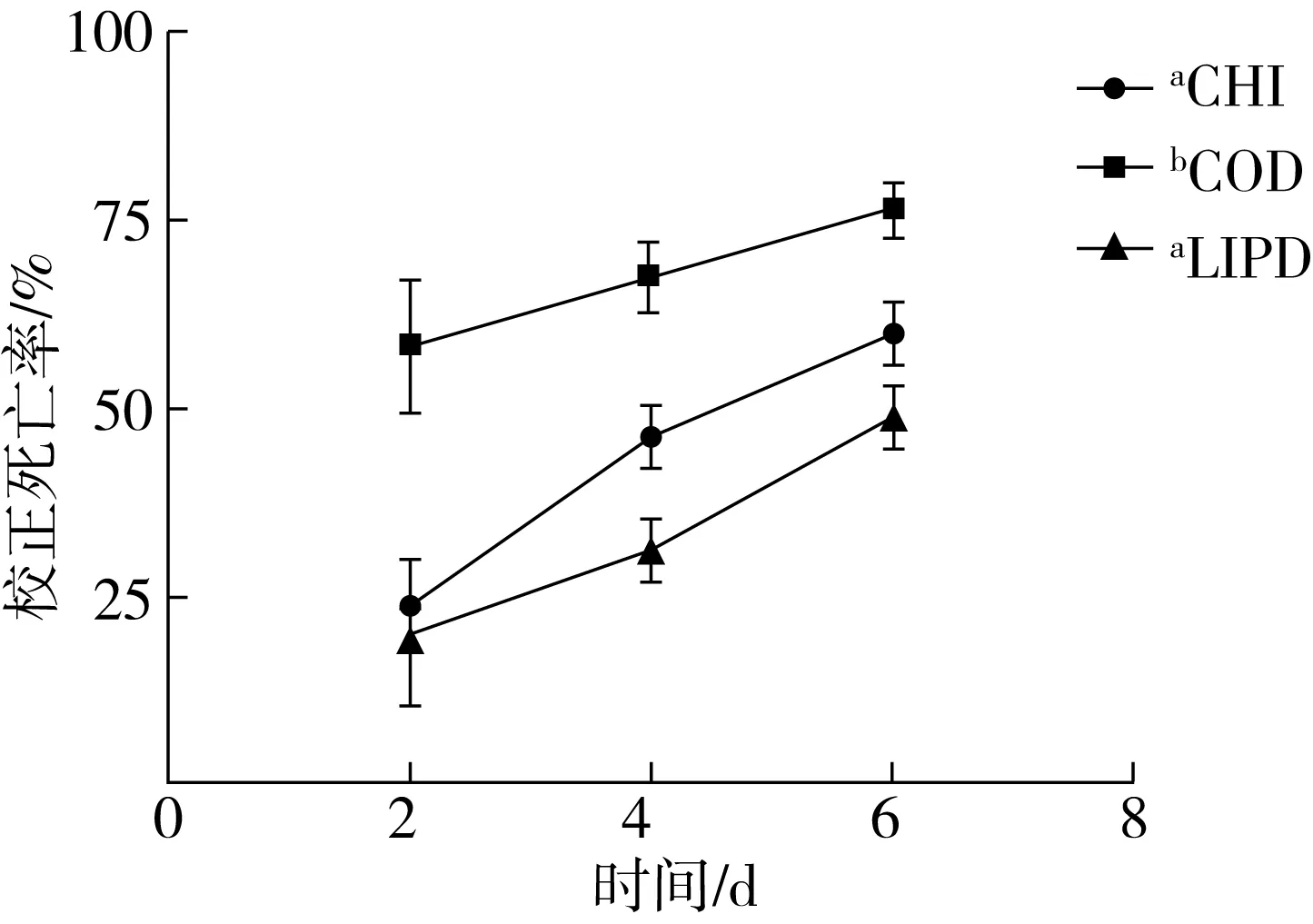
注:以不同載體遞送dsEGFP產生的害蟲死亡率(均小于10%)進行校正分析;CHI:殼聚糖,CQD:量子點CQD,LIPO:脂質體Lipofectamine2000。不同小寫字母表明處理組間存在顯著性差異(P<0.05,Kruskal-Wallis test)。圖1 不同納米載體復合dsG3PDH喂食的印度谷螟的校正死亡率
但是目前,基因載體在害蟲RNAi中的毒力增效機理尚缺乏深入探究。在今后的研究中,一方面需要對更多的載體材料進行測試篩選;另一方面也需要對載體的增效機理進行系統性解讀,助力開發具有靶標特性,高效的dsRNA遞送系統。
4 結論與展望
RNAi具有高效、專一性強等優點,因此被廣泛應用于儲糧害蟲基因功能鑒定及其防治研究中。目前dsRNA注射和飼喂在多種儲糧害蟲中都取得了明顯的沉默效果,為RNAi技術應用于儲糧害蟲防治提供了理論依據。然而,目前該技術在儲糧害蟲防治實踐中還受到RNAi效率的制約,一方面儲糧害蟲種類與dsRNA遞送方式影響了RNAi效率,造成這種現象的原因可能包括:dsRNA胞外降解、dsRNA細胞吸收和RNAi核心機制差異等。另一方面,靶標基因與dsRNA分子設計同樣也會影響基于RNAi的儲糧害蟲防治效率。包括脂質體、量子點和殼聚糖在內的多種基因載體可以通過提高dsRNA在害蟲體液中的半衰期和細胞吸收、擴散效率,從而增強了基因沉默效果。今后的研究中還需要對RNAi靶標基因、效率決定機制及相關增效技術進行更加深入地探索,另外,RNAi應用到儲糧害蟲防控中還需要對其安全性以及dsRNA在糧堆中的穩定性進行系統性評價,從而促進RNAi技術在儲糧害蟲防控中的應用實踐。

