黃連解毒湯抗新型冠狀病毒肺炎的“中藥-成分-靶點”調控網絡研究
吉米麗汗·司馬依,買買提明·努爾買買提,艾尼瓦爾·吾買爾,周文婷*
(1.新疆醫科大學藥學院,烏魯木齊 830011;2.新疆醫科大學維吾爾醫學院,烏魯木齊 830011)
新型冠狀病毒肺炎(COVID-19)具有較高的傳染性和人群易感性,目前全球防控形勢嚴峻,對全球公共衛生事業造成了嚴重威脅。新型冠狀病毒(原名2019-nCoV,現名SARS-CoV-2)主要侵犯呼吸系統,表現為發燒、呼吸困難、乏力和咳嗽等[1]。其與SARS樣冠狀病毒在致病機制和臨床表現等方面有較大的相似性[2]。SARS-CoV-2可與血管緊張素轉化酶Ⅱ(ACE2)結合進入細胞造成感染。SARS-CoV-2進入宿主細胞后,釋放核糖核酸(RNA)與細胞中核糖體集合,翻譯出小核糖核酸病毒的3C蛋白酶(3CLpro)[3-4]。因此ACE2和3CLpro在SARS-CoV-2的致病過程中起關鍵作用。
黃連解毒湯是純中藥制劑,由黃連、黃芩、黃柏和梔子4味中藥組成,具有清熱瀉火解毒功效,主治實熱火毒、三焦熱盛之證。研究表明,黃連解毒湯具有明顯的抗細菌、抗真菌、抗病毒、抗內毒素、抗炎等作用,是治療急性感染性疾病的有效藥物[5-7],現已錄入《關于印發新型冠狀病毒感染的肺炎診療方案(試行第六版)》中。本研究基于ADME參數和Lipinski規則對黃連解毒湯的活性成分進行進一步篩選,將其活性成分作為匹配庫,以3CLpro和ACE2作為分子對接的受體,采用AutoDock分子進行分子對接,并通過在線軟件對活性成分及其靶點進行基因功能及信號通路分析,為黃連解毒湯治療COVID-19的作用及機制提供參考。
1 資料與方法
1.1數據庫及分析軟件
1.1.1數據庫 中藥系統藥理學數據庫(TCMSP)(http://lsp.nwu.edu.cn/tcmsp.php),中藥綜合數據庫(TCMID)(http://bionet.ncpid.org/),中藥分子機制的生物信息學分析數據庫(BATMAN-TCM)(http://bionet.ncpsb.org/batman-tcm/),蛋白質(Uniprot)數據庫(https://www.uniprot.org/),富集分析數據庫(DAVID6.8)(https://david.ncifcrf.gov/),PubMed數據庫(https://www.ncbi.nlm.nih.gov),蛋白結構數據庫(PDB)(https://www.rcsb.org)。
1.1.2分析軟件 Cytoscape3.7.1軟件(https://cytoscape.org),Schrodinger軟件(https://www.schrodinger.com),Chemdraw16.0軟件(https://www.chemdraw.com.cn),PyMol軟件(https://pymol.org/),Autodock Vina1.2軟件(http://vina.scripps.edu/index.html)。
1.2基于ADME和“Lipinski 規則”評估 黃連解毒湯的4味草藥通過TCMSP、TCMID和BATMAN-TCM數據庫進行成分的獲取。本研究利用“Lipinski規則”,即相對分子質量(MW)、脂水分配系數(AlogP)、氫鍵供體數(Hdon)、氫鍵受體數(Hacc)和旋轉鍵(RBN)篩選其活性成分[8-9]。實踐表明,“Lipinski 規則”在使用上有局限性,因此5項原則現已簡化為3規則和4規則。本文以AlogP<5、Hdon<5和Hacc<10為標準進行篩選。為了確保黃連解毒湯成分鑒定的準確性和相關性,本研究納入了西北農林科技大學系統藥理學實驗室(陜西楊凌)的篩選標準[10],即藥物口服生物利用度(OB)≥30和類藥性(DL)≥0.18。DL具有良好物理化學性質及生物學特性,DL越大,成藥性就越高[11]。對于通過口服途徑給藥的藥物,OB是衡量藥物進入人體循環系統有效性的重要指標[12]。最后通過Chemical Book數據庫對上述成分以mol格式統一保存,在PyMol軟件以pdb格式保存。并通過AutoDock Tools 1.5.6程序以pdbqt格式保存,作為對接配體。
1.33CLpro受體的前處理及分子對接 采用AutoTools把2019-nCoV-Mpro(PDB ID:6LU7)和ACE2(PDBID:1R42)晶體結構蛋白以pdbqt為文件保存(添加蛋白的四字代碼),使用Autodock Vina軟件對配體與受體進行對接。最后取優勢構象進行分析,并用Schrodinger作圖。
1.4活性成分對應靶點的預測及篩選 通過TCMSP數據庫篩選能與2個受體具有較好結合能的活性成分對應的靶點。并將黃連解毒湯的4味中藥、成分和對應的靶點通過Cytoscape 3.7.1軟件構建“中藥-活性成分-潛在靶點”網絡圖。
1.5GO基因功能和KEGG通路分析 黃連解毒湯活性成分作用靶點通過DAVID 6.8數據庫進行基因功能和信號通路富集分析。
2 結果
2.1活性成分篩選結果 黃連解毒湯的4味中藥通過TCMSP、TCMID和BATMAN-TCM數據庫共收集到532個成分,其中黃連54個、黃芩149個、黃柏140個和梔子189個,見表1。并將成分通過以AlogP<5、Hdon<5、Hacc<10、OB≥30和DL≥0.18為標準篩選得到53個活性成分,見表2。
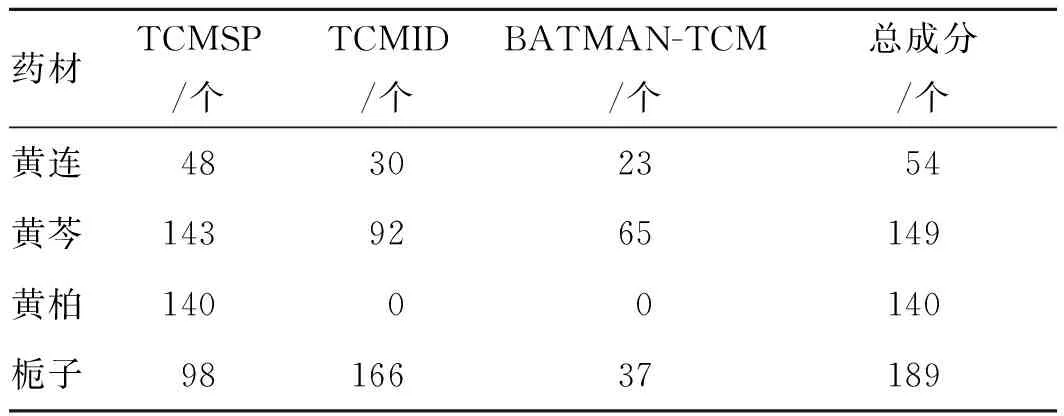
表1 黃連解毒湯4味中藥的總成分
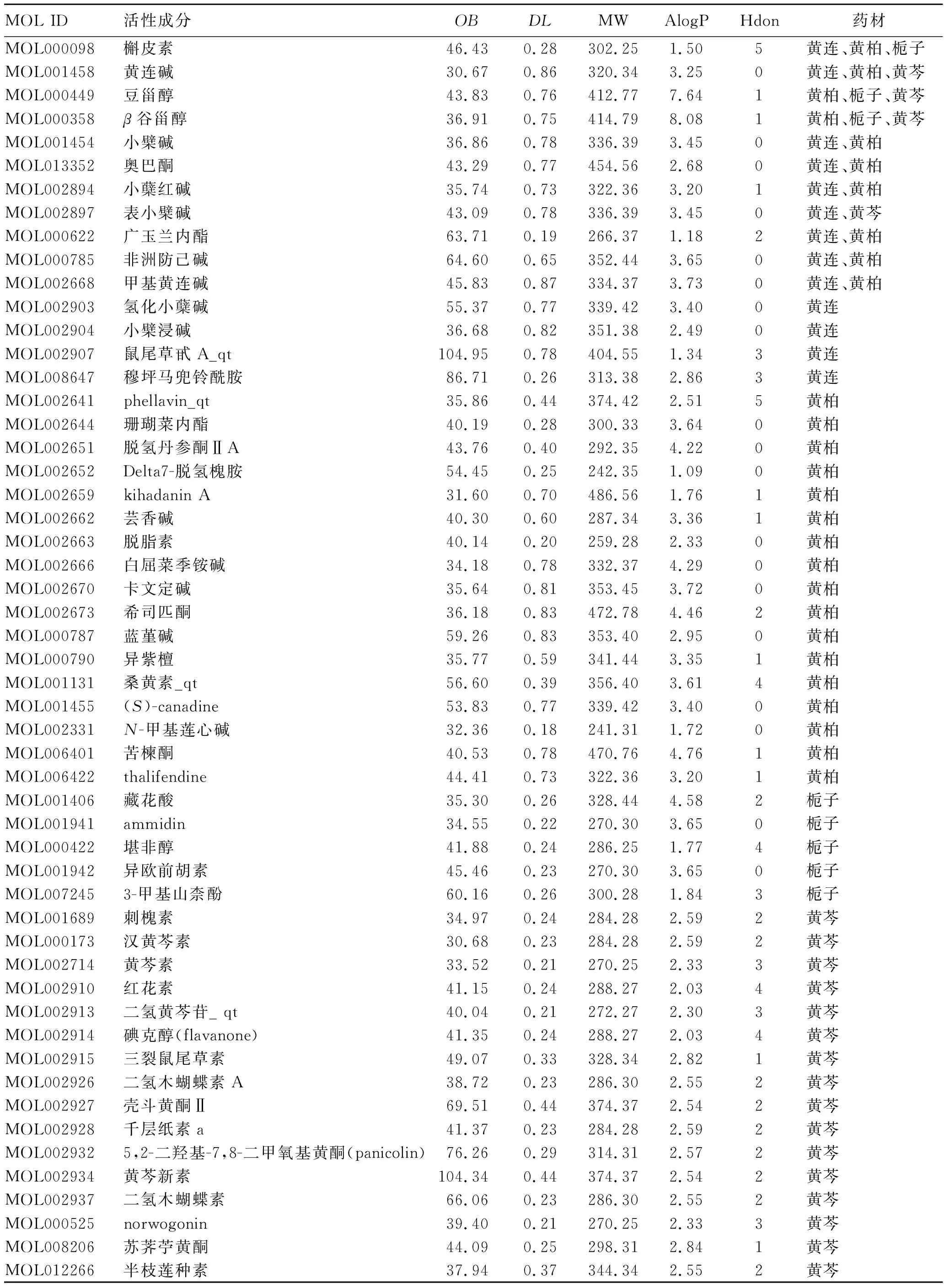
表2 黃連解毒湯活性成分的ADME篩選
2.2分子對接分析結果 一般認為配體與受體結合的構象穩定時,能量越低,發生作用的可能性就越大[13]。根據蛋白復合物中配體的坐標以及蛋白活性口袋進行設置,配體設置為柔性,受體設置為剛性,見圖1。黃連解毒湯的53個活性成分通過預處理后,只保留了45個成分。為了提高篩選標準,將45個活性成分的最優結合能與目前臨床推薦化學藥物,即洛匹那韋、利托那韋和瑞德西韋等藥物進行對比。45個活性成分與3CLpro進行對接,結果表明,瑞德西韋的最優結合能(-4.9 kcal·mol-1)在3個臨床推薦化學藥物中最低,于是收集最優結合能小于該藥物的30個活性成分。
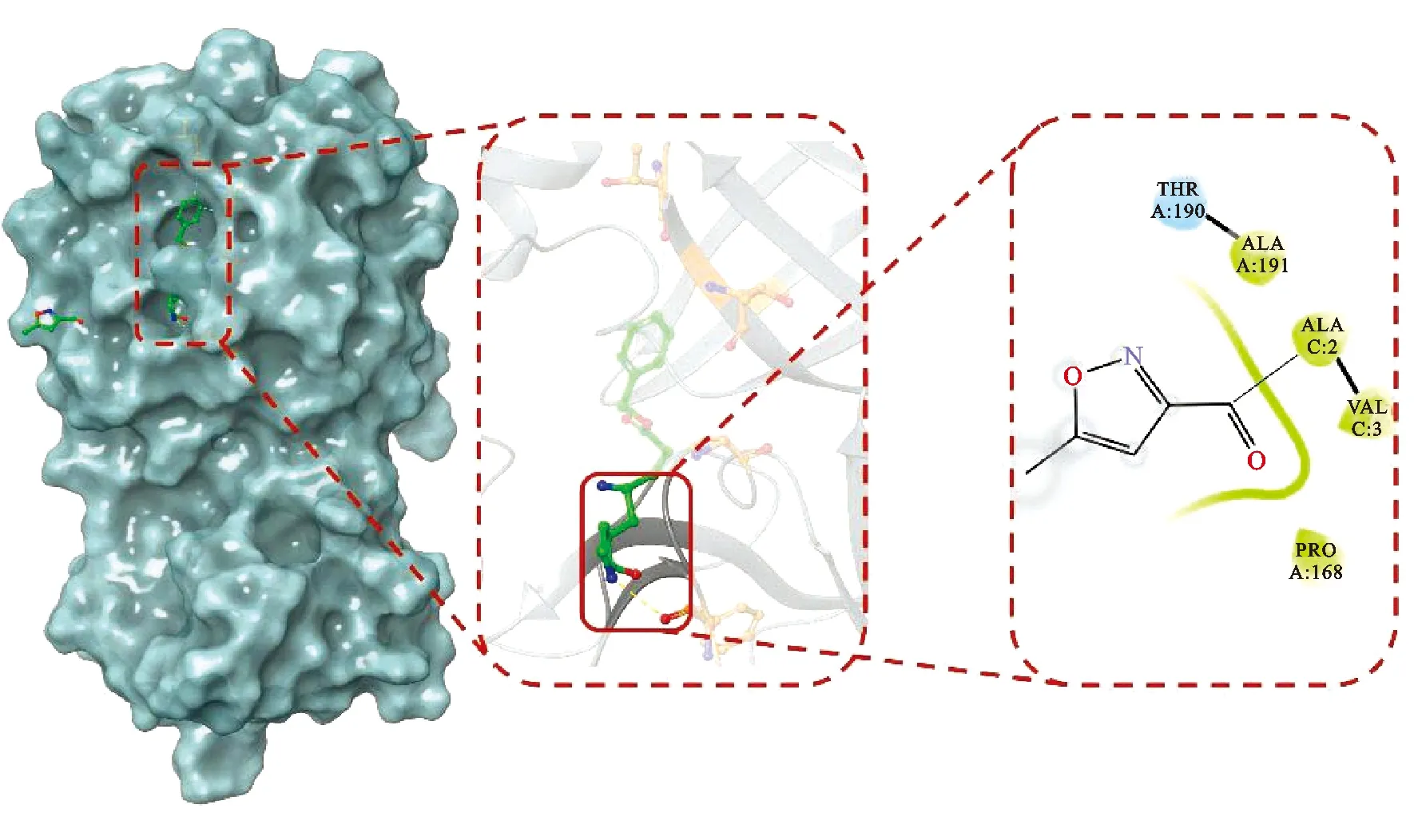
圖1 3CLpro與原配體的三維結構圖
通過分子對接證明黃連解毒湯的主要活性成分是否與ACE2結合。為了提高篩選標準,將45個活性成分與ACE2的最優結合能與TCMSP數據庫中以“Angiotensin-converting enzyme 2”為關鍵詞篩選得到的中藥成分葛根素結合能進行對比。結果表明,葛根素的最優結合能為-3.8 kcal·mol-1,于是收集最優結合能小于該成分的11個活性成分。45個活性成分中,3CLpro和ACE2與11個活性成分結合能均較高,見表3。由表3可知,氫鍵和π-π相互作用對配體與受體的識別和穩定性起著關鍵作用。
2.3活性成分對應的作用靶點的預測及篩選結果 11個主要活性成分運用TCMSP數據庫篩選其對應的203個靶點,刪除重復靶點后,得到101個靶點。見表3。11個活性成分中穆坪馬兜鈴酰胺和黃柏酮從TCMSP數據庫中未查到其作用靶點,為了避免收載標準和算法不同的問題,刪去這2個成分,見圖2。由圖2可知,黃連解毒湯的4味中藥、9個活性成分和101個作用靶點之間的關系,該多維網絡由116個節點和213個邊緣組成。HB(藍色四角形)、C(黃色八角形)和T(紅色圓形)之間的邊緣代表相互作用。節點的大小與度數成正比。節點的度(Degree)越大則其參與的生物功能越多,其生物學重要性越強[14]。該網絡中,每個活性成分平均與3.95個靶點相互作用,每個靶點平均與2.2個活性成分相互作用,因此黃連解毒湯中存在1個活性成分與多靶點作用,同時也存在不同活性成分共同作用于同1靶點的現象,這體現了中藥多成分與多靶點之間共同作用的機制。由圖2可知,PIK3CG(Degree=7)、Akt1(Degree=7)、PTGS1(Degree=6)和PTGS2(Degree=5)等靶點在多維網絡中占據重要地位。
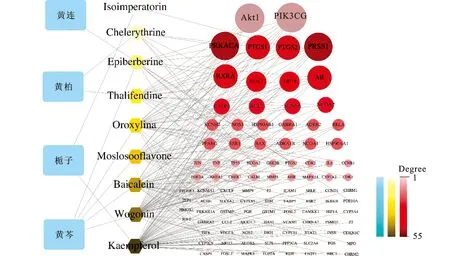
圖2 中藥-活性成分-潛在靶點網絡
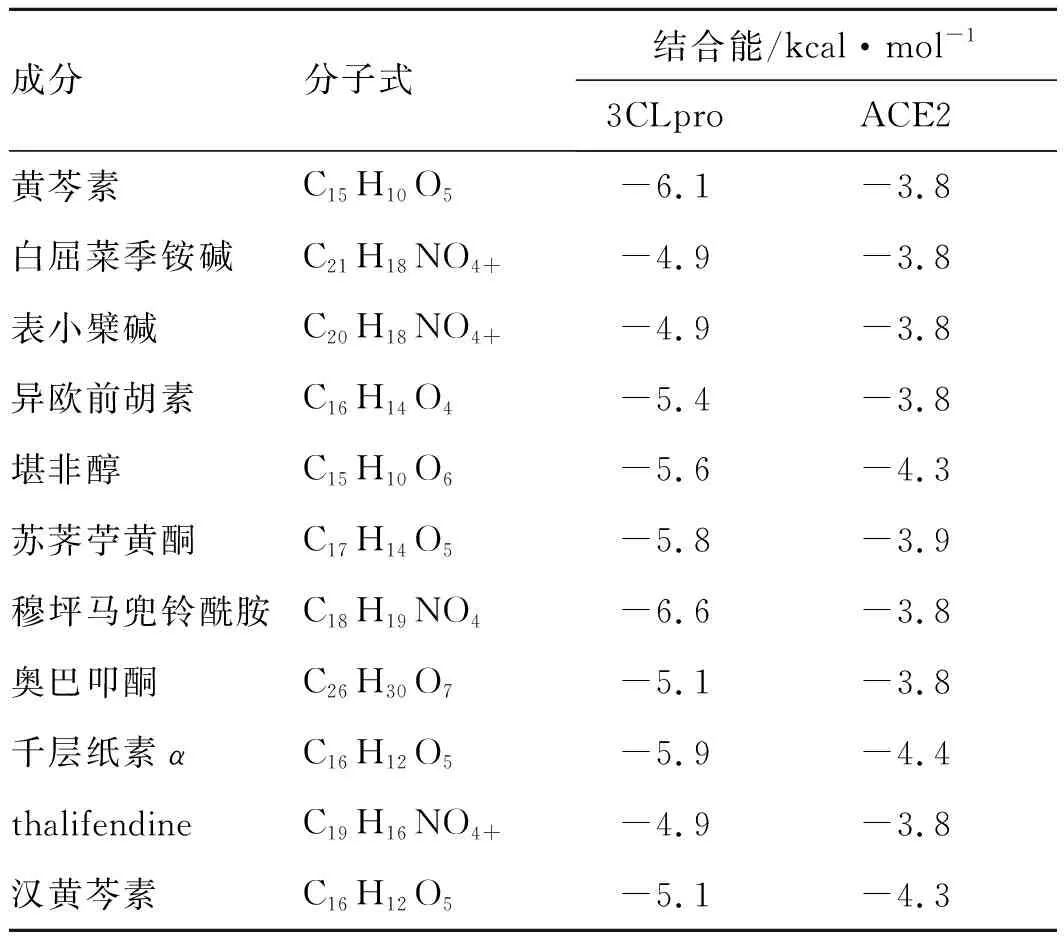
表3 黃連解毒湯活性成分與3CLpro和ACE2的分子對接結果
2.4GO基因功能和KEGG通路分析結果 將101個作用靶點通過DAVID 6.8數據庫進行基因生物學過程和信號通路富集分析,以系統地解釋黃連解毒湯抗COVID-19的作用。結果顯示,作用靶點涉及651條目生物過程(BP)、144條目分子功能(MF)、71條目細胞組分[15](CC)以及130條KEGG信號通路,見表4。錯誤發現率(FDR)在富集分析中越小,代表富集顯著程度越高,以FDR≤0.01為篩選標準,結果見表4和表5。KEGG信號通路主要包括腫瘤壞死因子(TNF)信號通路、缺氧誘導因子(HIF-1)信號通路、Toll樣受體信號通路、PI3K-Akt 信號通路、p53信號通路、T細胞受體信號通路、細胞凋亡、血管內皮生長因子(VEGF)信號通路、絲裂原活化蛋白激酶(MAPK)信號通路、B細胞受體信號通路、核因子κB(NF-κB)信號通路、核苷酸結合寡聚體結構域蛋白(NOD)樣受體信號通路11條與人體識別病原體相關的信號通路,并有產生炎性免疫反應有關的信號通路,HTLV-Ⅰ感染和A型流感等病原微生物相關的信號通路以及小細胞肺癌和非小細胞肺癌信號通路等。信號通路在富集分析中越大,表示富集顯著程度越高。

表4 黃連解毒湯有效成分的GO基因功能分析
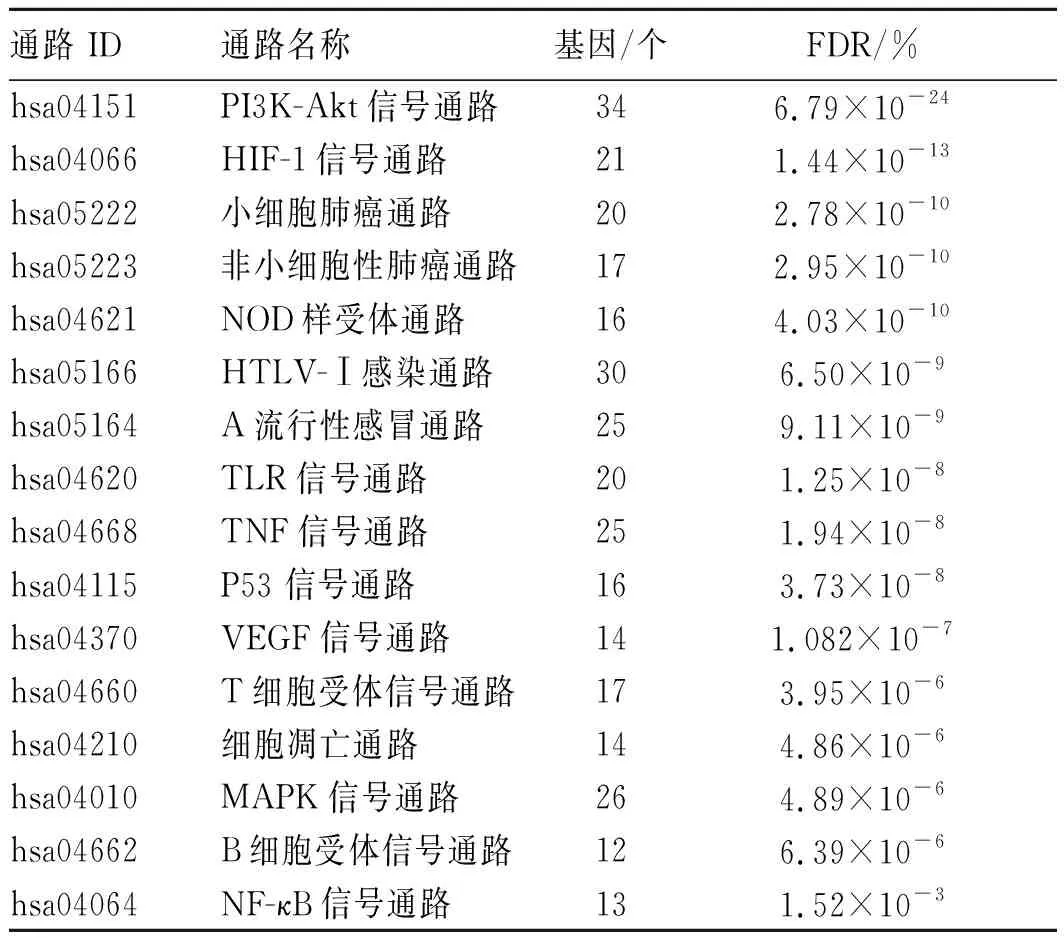
表5 黃連解毒湯中前16個顯著富集的KEGG通路(FDR≤0.01)
3 討論
中醫認為COVID-19屬于“濕毒疫”范疇,源于感受“濕毒之邪”致病。在中醫“辨證施治”理論指導下,中藥在“濕毒疫”的運用中具有獨特的優勢[16]。本文運用中藥網絡藥理學方法,在黃連解毒湯活性成分ADME和Lipinski規則的基礎上,結合各種中藥的法定質量控制指標,篩選、整合、分析并建立可靠的成分庫。以COVID-19為疾病模型,構建相應的中藥藥理網絡。研究報道,在對我國各地區中醫藥診療方案進行分析中,黃連解毒湯應用頻次為9次[17];近20年抗病毒中藥文獻研究結果顯示,黃芩和黃連2味中藥使用頻次排名前6,且黃連解毒湯被推薦用于治療邪熱壅肺型疾病[18]。
本文以瑞德西韋的結合能≤-4.9 kcal·mol-1作為標準,篩選出與2019-nCoV-Mpro具有較好的結合活性的成分有30個,來自黃柏、黃芩、黃連和梔子的各有12、11、6、6個(其中包含重復的成分)。以葛根素的結合能≤-3.8 kcal·mol-1作為篩選標準得到11個活性成分。其中的黃芩素、表小檗堿、千層紙黃素A、漢黃芩素和薺苧黃酮來自黃芩,白屈菜紅堿、黃柏酮、thalifendine來自黃柏,表小檗堿、穆坪馬兜鈴酰胺、黃柏酮來自黃連,異歐前胡素和山柰酚來自梔子。這11個活性成分與2019-nCoV-Mpro具有較好的結合活性。但其是否直接作用于3CLpro,從而阻斷病毒增殖,是否直接作用于宿主細胞,提高機體免疫力,阻斷病毒侵襲,需要進一步研究。
KEGG結果表明,與病毒最為相關的PI3K-Akt信號通路、與病毒天然免疫應答相關的信號通路Toll樣受體信號通路及與肺部最為相關的小細胞肺癌和非小細胞肺癌均涉及PIK3CG和Akt1,且在HB-C-T網絡中Degree均最大,表示其生物學重要性越強。此外,以上主要信號通路中PI3K-Akt 信號通路在富集分析中FDR最小,表示富集顯著程度最高。近期研究報道[19],PI3K抑制劑對A型流感病毒感染誘導病毒性肺炎小鼠肺組織中一氧化氮(NO)生成和炎癥反應具有抑制作用。對活性成分而言,黃連解毒湯主要活性成分山柰酚和黃芩素均作用于PIK3CG和Akt1。黃芩素通過抑制PI3K/Akt/NF-κB信號通路逆轉人肺癌細胞A549耐順鉑株細胞的上皮間質轉化(EMT)以及抑制抗凋亡蛋白表達[20]。此外,山柰酚通過減輕氧化應激以及顯著降低支氣管肺泡灌洗液中腫瘤壞死因子-α(TNF-α)、白細胞介素-6 (IL-6)和白細胞介素-1β(IL-1β)等炎癥因子,抑制NF-κB信號通路,從而對病毒誘導的急性肺損傷小鼠產生保護作用[21]。進一步推測,黃連解毒湯活性成分是否作用于PIK3CG和Akt1,減輕氧化應激和炎癥作用,從而起到輔助治療COVID-19的作用。缺氧信號是人類腫瘤病毒編碼的毒蛋白可篡改的宿主細胞,可分為缺氧微環境應激和缺氧誘導因子(HIF)信號,兩者在致病過程中相輔相成、密不可分[22]。研究報道,千層紙黃素A抑制非小細胞肺癌的侵襲和遷移[23]。并且在低氧微環境下,HIF-1α表達增高具有促進小細胞肺癌的增殖及血管生成的潛能[24],而千層紙黃素A通過抑制HIF-1α可以預防疾病[25]。千層紙黃素A是否調控腫瘤病毒介導的缺氧信號,從而治療小細胞肺癌和非小細胞肺癌的作用需要進一步研究。此外,除了以上主要活性成分以外的其他活性成分研究報道較少,需要進一步研究。鑒于網絡藥理學和分子對接的限制性,需要開展實驗研究,為黃連解毒湯抗COVID-19的作用以及后期的藥物開發提供理論和實驗依據。

