黃曲霉功能基因組學研究
王 鵬, 張穎超, 管軼男, 孔 青*, 郁東興
(1.中國海洋大學 食品科學與工程學院,山東 青島 266003;2.青島蔚藍生物股份有限公司,山東 青島 266101;3.青島尚好科技有限公司,山東 青島 266700)
黃曲霉是一種常見的腐生菌真菌和條件致病菌,多見于發霉的糧食、糧制品及其他霉腐的有機物上。黃曲霉產生的黃曲霉毒素是毒性極強的劇毒物質,具有明顯的“三致”作用,對人和動物肝臟組織具有嚴重的破壞性,黃曲霉及黃曲霉毒素對多個國家和地區造成了無法估量的經濟損失[1]。黃曲霉是僅次于煙曲霉的第二大致病菌,可在免疫抑制的患者中引起侵襲性曲霉病[2]。黃曲霉基因組中存在豐富的次級代謝產物基因簇,具備產生許多有益的次級代謝產物的能力。預計將有56個次級代謝產物生物合成基因簇位于黃曲霉基因組中,其中27個基因簇包含至少一種聚酮化合物合酶(PKS),而26個簇包含至少一種非核糖體肽合成酶(NRPS)[3-4]。在絲狀真菌中,源自NRPS的天然產物包括抗生素、霉菌毒素、鐵載體和生物堿[5]等。這些次級代謝產物的功能有待進一步探討。米曲霉是一種常見的工業菌株,在傳統發酵工業中已經被廣泛使用了1 000多年。米曲霉發酵技術已經成熟,其安全性已獲得美國食品藥品監督管理局(FDA)的認可[6]。Payne等[7]研究表明,黃曲霉和米曲霉之間具有源自同一生態型的序列高度相似性,由此推測米曲霉是由黃曲霉馴化而來。此外,黃曲霉具有生產纖維素酶和生物乙醇的潛力[8]。目前,大多數研究中,常用的黃曲霉菌株的全基因組測序已經完成。選擇標記是分子生物學中必不可少的組成部分,由于黃曲霉可用的選擇標記較少、情況復雜,因此,黃曲霉的功能基因組學研究仍受到諸多限制。本文描述了包括黃曲霉選擇標記和遺傳轉化方法等方面的最新研究進展。此外,還討論了黃曲霉功能基因組學的應用前景及改善黃曲霉功能基因組學研究策略的潛在技術。
1 黃曲霉的功能基因組學策略
1.1 黃曲霉次生代謝生物合成基因簇(BGCs)的預測
真菌是具有生物活性化合物的天然產物的重要來源之一,并應用于從農業到醫學等的各個領域。絲狀真菌的一些次生代謝物(SM)如抗生素(青霉素和頭孢菌素)、抗真菌藥物(灰黃霉素)和降低膽固醇的藥物(洛伐他汀),在食品、醫療、農業和其他領域均得到了廣泛應用[9]。次生代謝物由低分子量物質構成,通常由大型多模塊PKS和NRPS或異戊二烯基轉移酶和二甲基烯丙基色氨酸合酶組成[5]。Khaldi等[10]設計和開發了基于Web軟件的SMURF(www.jcvi.org/smurf/),根據基因組背景和范圍系統預測次生代謝物基因簇。SMURF依靠隱馬爾可夫模型(HMM)檢測真菌基因組中的骨架基因,從而可以準確地恢復所有基因簇并預測其他潛在基因簇。最近,Blin等[11]設計了次生代謝生物合成基因簇快速識別工具antiSMASH(已更新為antiSMASH 5.0),以便更好地應用于次生代謝生物合成基因簇挖掘。PRISM3是一種預測非核糖體肽以及I型和II型聚酮化合物化學結構的工具,在預測次生代謝生物合成基因簇方面具有很大作用[12]。基于SMURF的分析表明,黃曲霉基因組至少包含70個編碼酶的基因,這些酶催化多種次級代謝物生物合成途徑的第一步[10]。值得注意的是,次生代謝生物合成基因簇的預測并不完全準確,如存在低估或高估次生代謝生物合成基因簇中的基因功能。因此,要準確了解與次生代謝生物合成基因簇真正關聯的基因,只能通過基因敲除來驗證。
1.2 黃曲霉基因研究方法
1.2.1 篩選標記 篩選標記是黃曲霉功能基因研究的關鍵問題之一。有效的篩選標記可極大提高基因操作效率。目前,黃曲霉的篩選標記主要分為兩類:耐藥標記和營養缺陷型標記(表1)。Seip等[13]利用β-微管蛋白基因作為篩選標記基因,發現陽性轉化子對苯并咪唑具有抗性。Ramesh等[14]利用潮霉素抗性基因(hph)作為篩選標記基因對黃曲霉絲氨酸蛋白酶基因(sep)進行敲除。Chang等[15]利用米曲霉中的巰乙胺抗性基因(ptr)作為篩選標記基因,構建了Ku70缺陷型黃曲霉菌株。同時,黃曲霉對博來霉素敏感,ble作為穩定的轉化標記物的基因,可使黃曲霉產生博來霉素抗性[16]。最近,Tao等[17]開發了一種新的羧甲基纖維素作為篩選標記的轉化系統,轉化子可以有效地整合到黃曲霉基因組中。但曲霉屬真菌本身具有極強的抗生素抗性;同時,抗生素抗性標記在實際生產中存在安全隱患,微生物中耐藥基因的基因流動會增加病原微生物的耐藥性,并對環境和人類健康構成嚴重威脅。

表1 黃曲霉的篩選標記
粗糙脈孢菌(Neurosporacrassa)中的Pyr-4是用于黃曲霉轉化的最常見篩選標記基因之一[18]。Chang等[15]利用寄生曲霉(Aspergillusparasitica)的pyrG基因構建一種營養缺陷型黃曲霉尿嘧啶菌株,用于基因敲除研究。pyrG基因編碼的5′-單磷酸胞苷脫羧酶是真菌尿嘧啶生物合成的關鍵酶,當補充尿苷或尿嘧啶時,pyrG突變體才能夠將乳清酸核苷轉化為尿嘧啶,以維持真菌正常生長[6]。niaD基因編碼的NADPH依賴性硝酸鹽還原酶,可將硝酸鹽還原為亞硝酸鹽,而niaD突變體無法在以硝酸鹽為唯一氮源的培養基上生長[19]。與其他曲霉屬真菌相比,黃曲霉中營養缺陷型篩選標記的種類較少。Fiedller等[20]利用hisB基因作為篩選標記基因,構建了用于黑曲霉基因靶向研究的組氨酸營養缺陷型菌株,在其他類似的病原性絲狀真菌如黃曲霉應用中極具開發潛力。Lenouvel等[21]利用argB基因(編碼鳥氨酸轉氨甲酰酶)的缺失,在黑曲霉中構建了一株精氨酸營養缺陷型菌株,并將其應用于黑曲霉轉化研究。sC基因編碼的ATP 硫酸鹽酶可催化無機硫酸鹽的ATP激活,sC突變體不能利用硫酸鹽作為硫的來源。sC作為篩選標記基因已成功地應用于各種曲霉中,例如構巢曲霉、煙曲霉、黑曲霉、米曲霉[22]等。目前,黃曲霉營養缺陷型篩選標記基因開發較少,hisB、argB和sC等篩選標記基因在黃曲霉遺傳學研究中極具發展前景。因此,開發豐富多樣的篩選標記基因對于黃曲霉基因組學的研究至關重要,也將很大程度上提高黃曲霉的轉化效率。
1.2.2 黃曲霉轉化策略 高效的轉化策略是黃曲霉遺傳學研究的基礎。目前,黃曲霉的轉化策略主要分為原生質體介導的轉化(PMT)和根瘤農桿菌介導的轉化(AMT)兩種。其中,PEG介導的原生質體轉化方法是黃曲霉遺傳學研究中最常用的轉化方法。利用多種細胞壁裂解酶,從真菌細胞中制備原生質體仍然是制備真菌感受態細胞的最常見方法。黃曲霉的PMT方法具有以下步驟[15](圖1):①將10個營養缺陷型菌株孢子(ΔpyrG)接種到100 mL的Czepak-Dox肉湯(含酪蛋白0.5%、硫酸銨10 mmol/L、尿嘧啶0.2%和葡萄糖1%)中,30 ℃、150 r/min恒溫生化培養振蕩器中培養11~12 h,100 μm尼龍細胞濾器收集菌絲體[8]。②將收集的菌絲體放入新鮮制備的酶解液中,50~70 r/min、30 ℃水解2~3 h。在酶解過程中,觀察原生質體的狀態以確保原生質體的質量。酶解液主要有以下兩種:哈茨木霉、裂解酶和細胞壁消化酶,以含有0.55 mol/L KCl、0.05 mol/L檸檬酸溶液(pH 5.8)為溶劑;崩潰酶、β-葡萄糖苷酶、裂解酶,以含有1.2 mol/L NaCl、10 mmol/L NaPO3溶液(pH 7.0)為溶劑。③將收集的原生質體用0.6 mol/L KCl、50 mmol/L CaCl2和10 mmol/L Tris-HCl,pH 8.0的溶液洗滌2次,然后加入新鮮配制的50%PEG-4000溶液(10 mmol/L CaCl2、10 mmol/L Tris pH 7.5、0.6 mol/L KCl)。④將每種轉化混合物添加到100~130 mL預熱的再生/選擇培養基(Czapek-box中加入0.6 mol/L KCl和10 mmol/L硫酸銨)中。
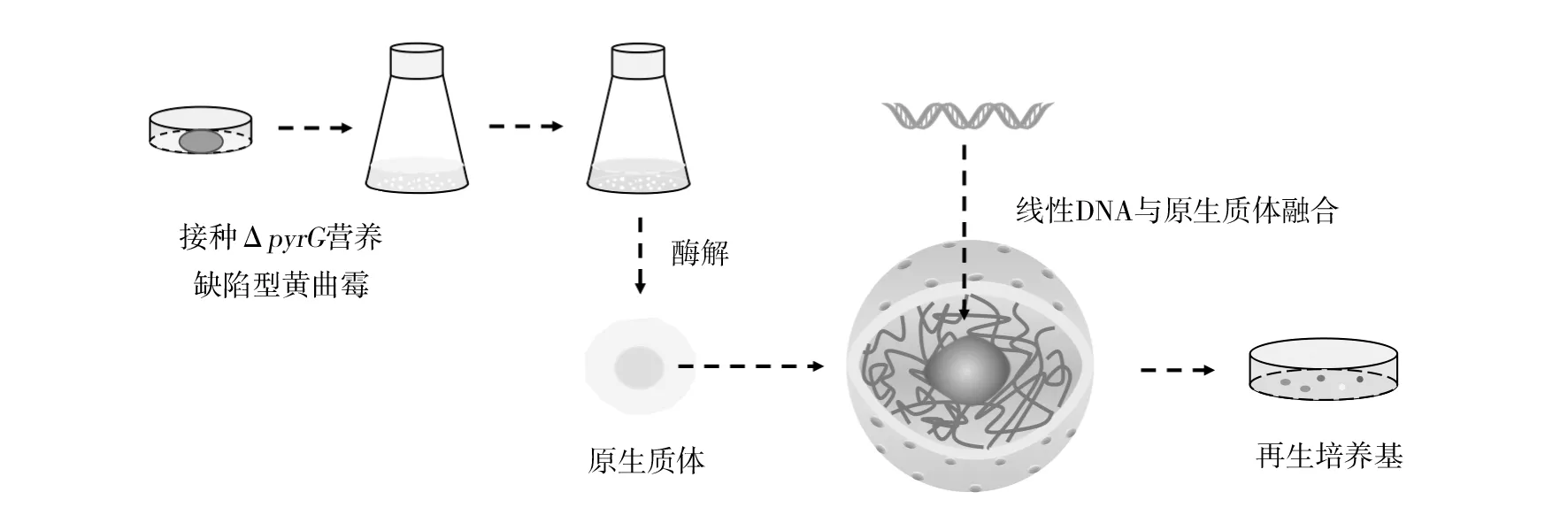
圖1 黃曲霉原生質體介導的轉化(PMT)流程圖
根瘤農桿菌是一種植物性病原體,可通過IV型分泌系統將Ti質粒上的一部分T-DNA(8個左右的基因在植物細胞內表達)轉移到宿主中,從而誘導宿主產生冠狀膽囊腫瘤[23]。若將T-DNA轉移到酵母和絲狀真菌中,根瘤農桿菌必須具有完整的毒力系統。用于轉化的DNA與DNA結合蛋白VirD2和VirE2一起作為單鏈DNA分子轉運到宿主[24]。與原生質體介導的轉化相比,根瘤農桿菌介導的轉化是一種更有效的基因靶向方法,不需要制備可轉化的原生質體。通常使用乙酰丁香酮作為誘導劑激活細胞表面的VirA和VirG蛋白,這些蛋白可以將其T-DNA隨機轉移至受體基因組中的隨機位點[25]。黃曲霉的根瘤農桿菌介導的轉化方法具有以下步驟(圖2):①通過電穿孔將載體引入AGL-1感受態細胞;②將黃曲霉孢子懸浮液和誘導的根瘤農桿菌懸浮液的混合物涂布在Co-IM培養基上(IM用5 mmol/L葡萄糖代替10 mmol/L葡萄糖,加1.8%(w/v)瓊脂)[26];③將硝酸纖維素膜轉移到含有抗生素的選擇培養基中。目前,報道的轉化黃曲霉的方法僅有PMT和AMT兩種。PMT和AMT方法的優缺點如表2所示。在其他絲狀真菌中,除了這兩種常規的方法外,還有兩種常用的轉化方法電穿孔轉化法(ET)和基因槍轉化法(BT)。每種方法獨具優勢且被應用相應研究中,適當的轉化方法,可以顯著提高基因工程的成功率。
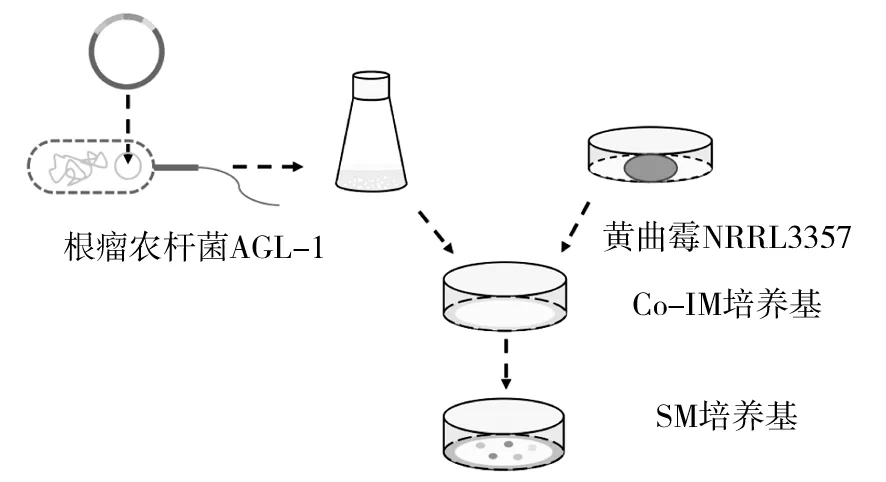
圖2 根瘤農桿菌介導的黃曲霉轉化(AMT)流程圖

表2 黃曲霉兩種常用轉化方法的機制和優劣勢
2 提高黃曲霉基因操作效率的策略
2.1 缺陷型菌株非同源末端連接(NHEJ)的基因工程研究
當外源DNA作為目標基因整合到受體染色體時,會涉及到DNA雙鏈斷裂(DSB),而DNA雙鏈斷裂會導致細胞死亡或多種遺傳變化的損害,可通過非同源末端連接途徑和同源重組(HR)進行修復[27]。基于同源重組的基因敲除是真菌遺傳學研究中最常用的方法,但大多數絲狀真菌的同源重組頻率較低(<5%)。因此,在絲狀真菌中,需要通過NHEJ途徑來增加HR途徑以實現高效的基因靶向技術。
NHEJ過程由DNA依賴性蛋白激酶催化亞基(DNA-PKcs)、Ku70-Ku80異二聚體和DNA連接酶IV-Xrcc4復合體介導[28]。在真核細胞中,Ku70-Ku80異二聚體識別斷裂的DNA雙鏈,形成橋接復合體并集合其他在NHEJ途徑中起到至關重要作用的NHEJ蛋白[29]。目前,通過敲除ku70/ku80基因的基因靶向技術已成功地應用于包括黑曲霉、米曲霉、醬油曲霉和黃曲霉在內的許多曲霉屬物種[15,30-31]。在紅曲霉M7中,通過敲除ku70和ku80,基因置換的頻率從15%分別增加到42.2%和61.5%[29]。在黑曲霉中,ku70和ku80雙缺陷突變體的基因靶向頻率增加到100%[30]。在指狀青霉中,ku70的敲除極大地增加了同源重組的發生頻率,但同時發現Δku70菌株的生長和分生孢子的發育也受到影響。因此,Δku70/ku80被用作基因靶向技術的受體菌株,必須確認ku70/ku80等基因對分生孢子產生以及菌體生長發育功能無影響[32]。
目前,在黃曲霉中用于遺傳學研究的受體菌株主要是TJES19.1(Δku70,pyrG-)和CA14(Δku70,pyrG-)[15]。為了提高基因靶向技術的成功率,應盡可能消除NHEJ途徑。ligD基因編碼DNA連接酶IV,參與NHEJ途徑的最后一步。在米曲霉中,ligD敲除菌株的基因靶向頻率高達100%,在青曲霉中,通過破壞ligD,目標基因替換的頻率從低于2%增加到85%[34]。在黃曲霉中,可以分別或同時建立Δku70、Δku80和ΔligD菌株,以測試所構建菌株的靶基因置換頻率,從而進一步提高基因組學研究的成功率。
2.2 使用Cre-loxP重組系統拯救標記基因
在絲狀真菌中,由于篩選標記種類較少,其實用性受到限制,而標記拯救方法的出現可以實現連續基因敲除,從而使基因操作更加方便。噬菌體P1 Cre-loxP重組系統包含重組酶(Cre),重組酶可特異性識別34 bp的靶DNA序列(loxP)并催化它們之間發生重組[35]。其原理如圖3所示。首先,構建具有上下游同源臂,篩選標記基因(M)和loxP位點的載體;然后將具有loxP位點的載體通過同源重組與目標基因組置換;最后,Cre重組酶消化loxP位點,以切除整個消化區域,包括位于loxP側翼的目標基因,并重組原始目標基因組。
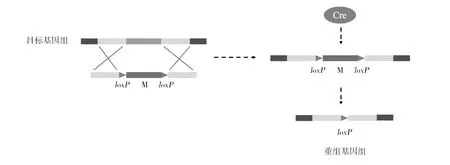
圖3 Cre-loxP重組原理
通過使用Cre-loxP重組系統,能夠比較容易地在米曲霉中構建ΔligD標記基因拯救菌株,從而提高了同源重組效率[36]。但是,由于在標記物拯救過程中,Cre重組酶介導的切除在基因組上留下了loxP位點,因此使用Cre-loxP系統進行的幾輪基因敲除或整合導致許多loxP位點在基因組上積累。為了避免由剩余的loxP位點引起的相鄰基因座同源重組而發生染色體DNA區域的不必要切除,在米曲霉中,成功地構建了具有自滅標記回收盒的質粒載體[37]。Cre-loxP重組系統同時已成功用于黑曲霉中,可以在有效的細胞工廠中敲除和/或插入多個基因結構,從而用于草酸和蘋果酸的生產[38]。在黃曲霉中,可以通過Cre-loxP重組系統,快速構建連續的基因敲除菌株,可用于研究多個基因對真菌生長發育功能的相互作用,也可用于快速構建NHEJ途徑缺陷的基因研究受體菌株。
2.3 利用CRISPR-Cas9系統開發基因組編輯方法
CRISPR(Clustered Regularly Interspaced Short Palindromic Repeats)是成簇的、規律間隔的短回文重復序列,是生物體(存在于大多數細菌和所有古細菌)為應對病毒和質粒不斷攻擊而演化來的獲得性免疫防御機制[39]。Cas9蛋白是一種雙鏈DNA核酸酶,能在介導RNA引導下對靶位點進行切割。CRISPR-Cas系統主要有3種類型,其中II型系統的發現,使RNA介導的基因編輯技術成為簡單、方便、快速的功能基因組學研究工具。
CRISPA-Cas9系統僅需要Cas9核酸酶即可破壞與由crRNA-tracrRNA(反式激活crRNA)雜交體組成的雙介導RNA所匹配的DNA[40]。crRNA-tracrRNA被設計為具有兩個關鍵特征的單介導RNA(sgRNA):5′端的序列通過Watson-Crick堿基配對原則確定DNA靶位點,3′端(雙鏈RNA)是Cas9的結合端(圖4)[41]。sgRNA原始間隔區序列的核苷酸(包含20個堿基配對識別的靶位點)可以使RNA介導的Cas9核酸酶準確地定位到靶向DNA序列,通過改變sgRNA的前20個核苷酸以對應目標DNA的核苷酸序列,且Cas9核酸酶活性可以針對任何帶有N20-NGG形式的DNA序列[42]。Cas9核酸酶對靶位點進行切割后,目標基因座通常經歷兩次主要的DNA損傷修復(圖4):通過NHEJ途徑的易錯修復或高保真的同源介導的雙鏈DNA修復(HDR)。在沒有修復模板的情況下,DNA雙鏈斷裂通過NHEJ過程重新連接以實現突變形式的基因敲除。HDR通過外源加入修復模板,并使用它在目標位置產生精確的修復。
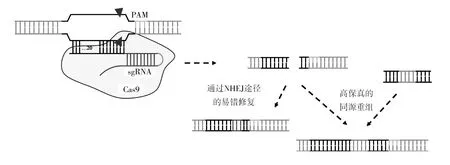
圖4 CRISPR-Cas9介導的基因敲除
目前,CRISPR-Cas9系統已被用于許多曲霉屬的遺傳學研究中。在煙曲霉中,CRISPR-Cas9系統已成功用于靶向聚酮化合物合酶基因(pksP)的敲除。Cas9核酸酶本身表達對煙曲霉的生長或毒力無影響,因此CRISPR系統可用于煙曲霉相關的發病機制研究[43]。在黑曲霉中,使用CRISPR-Cas9系統產生營養缺陷型受體菌株并整合基因組,整合效率提高到100%[44]。在米曲霉中,使用CRISPR-Cas9系統開發基因組編輯方法。這項技術為廣泛使用的工業菌株米曲霉的基因工程改造提供便利性[45]。由于使用固定真菌啟動子表達在不同真菌中實際效果存在差異,Cas9和sgRNA基因在不同物種中的表達可能不同。如果Cas9和sgRNA基因表達受限,則RNA定向誘變可能無效。在真核生物中,尋找和優化用于sgRNA表達的合適啟動子是一項主要的技術挑戰。在體內表達gRNA的最常見方法是使用兩個位于gRNA兩側的核酶序列,即5′末端錘頭(HH)和3′末端丁型肝炎病毒(HDV)序列。在黑曲霉中,使用U6啟動子建立了一個簡單的CRISPR-Cas9系統。sgRNA的轉錄由兩個異源(PhU6和PyU6)和一個內源性U6啟動子驅動。雖然簡化了黑曲霉的遺傳操作,但基因編輯效率僅為15%~36%[46]。真核生物中高度保守和有效表達的5S rRNA基因可用作sgRNA啟動子。在米曲霉中,通過構建包含基于AMA1帶有抗性標記ptrA的自主復制質粒,改進了CRISPR-Cas9方法。由于該質粒帶有抗藥性標記,供體DNA進行有效的基因編輯無需插入任何選擇標記,因此可以重復進行基因工程研究[47]。CRISPR-Cas9系統在曲霉中顯示出強大的應用潛力,極大地提高了基因編輯的便利性。在黃曲霉中尚未報道CRISPR-Cas9系統,但其極具潛在應用價值。CRISPR-Cas9系統無毒,無需標記即可連續進行基因編輯。在研究黃曲霉與植物之間的相互作用時,具有很大的優勢。
2.4 RNA干擾(RNAi)技術
RNA干擾(RNAi)是一種保守的真核基因調控機制,該機制使用小的非編碼RNA(sRNA)介導轉錄后/轉錄基因沉默。在已鑒定的sRNA中,RNAi主要分為三類:小干擾RNA(siRNA),microRNA(miRNA)和PIWI相互作用RNA(piRNA)[48]。RNAi最初被描述為一種宿主防御機制,通過產生源自這些外源序列的小干擾RNA或短發夾RNA(shRNA),可以保護基因組免受侵入性核酸(例如病毒和轉座子)的侵害[49]。RNAi也是在真核生物中誘導基因沉默或敲低的獨特技術。sRNA由依賴性Dicer酶或非依賴性生物途徑產生,并整合到效應蛋白Argonaute(AGO)家族中,通過與靶RNA堿基配對來指導特異性序列的基因沉默[50]。
真核生物中的RNAi由RNAse III酶(Dicer)引發,該酶將長雙鏈RNA(dsRNA)切割成siRNA,并且siRNA與AGO和其他蛋白質結合形成RNA誘導的沉默復合物(RISC)。然后,siRNA/RISC復合物結合靶mRNA的互補序列,從而阻止靶轉錄本的翻譯[49]。RNAi與CRISPR-Cas9系統具有明顯的相似性,例如,兩者均使用靶標特異性sRNA。表3顯示了RNAi和CRISPR-Cas9技術的比較。

表3 RNAi和CRISPR-Cas9技術的比較
基于RNAi技術的宿主誘導基因沉默(HIGS)是研究真菌與宿主之間相互作用的重要手段之一。真菌sRNA與宿主RNAi機制相互作用,從而下調宿主的防御基因并增強致病性[51]。宿主誘導的基因沉默在發展對霉菌毒素具有抗性的農作物中具有潛力。例如,用目標aflR基因778 bp的RNAi構建體轉化玉米基因組序列。該構建體在宿主植物中產生初級siRNA。當植物被黃曲霉菌感染時,初級siRNA進入真菌并切割互補的aflRmRNA序列,從而阻礙aflR基因的表達并導致黃曲霉毒素生物合成的下調[52]。在玉米種子中,通過構建α-淀粉酶基因RNAi構建體,抑制了黃曲霉α-淀粉酶(amy1)基因的表達,減少了黃曲霉對宿主的感染,從而導致黃曲霉毒素產量降低[53]。由于具有沉默特性的RNA可以從植物宿主轉移到各種入侵病原體, RNAi在研究預防黃曲霉毒素污染方面具有巨大潛力。
3 黃曲霉功能基因組學的潛在應用
3.1 黃曲霉基因組學用于闡明主要真菌毒素的合成途徑和調控
隨著基因組測序技術的飛速進步,越來越多的黃曲霉菌株完成全基因組測序,其中完成基因組測序最早的是黃曲霉菌株NRRL3357。Faustinelli等[54]報道了8種黃曲霉菌株的基因組序列,其中3種是不產黃曲霉毒素菌株。不產黃曲霉毒素菌株被用作減少黃曲霉毒素污染,是一種用來防治黃曲霉毒素污染的重要生物學策略。Weaver等[55]報道了3株被用于黃曲霉毒素的生物防治的黃曲霉菌株(NRRL21882、AF36和K49)的全基因組序列。Weaver等[56]還報道了從田間土壤和玉米中分離的20株具有地理參考價值菌株的全基因組序列。Chang等[57]報道了黃曲霉菌株CA14的基因組,一株被廣泛用于黃曲霉基因功能研究的菌株。黃曲霉基因組的大小約為36.5~38.8 Mb。序列數據保存在GenBank數據庫中(http://www.ncbi.nlm.nih.gov/)。
3.1.1 通過功能基因組學研究黃曲霉毒素的生物合成 黃曲霉基因組編碼超過13,000個功能基因,生物信息學分析表明,這些酶由多種基因編碼。通過對黃曲霉表達的序列標簽(EST)進行大規模測序,確定了與黃曲霉毒素生物合成、信號轉導、總體調控、真菌致病性和應激反應相關的基因[58]。目前,黃曲霉毒素的生物合成基因簇是研究最為廣泛的次級代謝途徑之一(圖5)。調控基因aflR編碼AflR蛋白以促進黃曲霉毒素的合成。當aflR過表達時,黃曲霉毒素合成中的基因轉錄被上調,黃曲霉毒素的產生量增加[59]。alfS基因與aflR相互作用并促進黃曲霉毒素的生物合成。
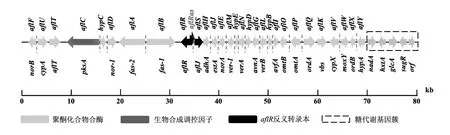
圖5 黃曲霉中的黃曲霉毒素途徑基因簇
黃曲霉毒素的生物合成不僅受黃曲霉毒素合成基因簇上基因的影響,還受到多種因素的影響。laeA是黃曲霉二級代謝的全局調控因子。敲除laeA后,黃曲霉的疏水性喪失,黃曲霉毒素和其他次生代謝受到顯著影響[60]。同時,laeA、VelB和VeA形成異源三聚體天鵝絨復合體,將光響應的發育調控與次級代謝的控制聯系起來[61]。研究表明,分解代謝抑制基因creA調節黃曲霉毒素的形態,定殖和黃曲霉毒素的合成[62]。黃曲霉毒素的生物合成也受到外界環境因素的影響。與37 ℃相比,黃曲霉毒素合成簇基因aflR和aflS在28 ℃顯著上調,促進黃曲霉毒素的產生[63]。溫度和水活度的相互作用還可以通過調節黃曲霉毒素合成簇基因的轉錄來調節黃曲霉毒素的合成。與液體培養基相比,固體培養基中黃曲霉通過G蛋白信號傳導途徑、氨基酸代謝、菌核發育和氧化應激等途徑蛋白的表達,從而促進黃曲霉毒素的生物合成[64]。
3.1.2 通過功能基因組學研究環匹阿尼酸(CPA)生物合成 環匹阿尼酸(CPA)是由青霉和曲霉真菌的二次代謝產生的吲哚-四甲酸霉菌毒素,可通過抑制肌漿網中鈣依賴性ATP酶來增加肌肉收縮[65]。由于曲霉產生的CPA含量低,很少報道發生CPA真菌毒素事件,但黃曲霉毒素中毒可能會使CPA的作用變得更加復雜化[66]。CPA具有五環吲哚四羧酸支架,該支架由色氨酸、乙酰輔酶A、丙二酰輔酶A和焦磷酸二甲基烯丙基焦磷酸酯分子通過三種酶(CpaS、CpaD和CpaO)的連續作用而組成[67]。在黃曲霉中,CpaS催化了CPA生物合成中的第一個穩定中間體,即環乙酰乙酰基L-色氨酸(cAATrp)。cAATrp通過dmaT編碼的環乙酰乙酰基乙酰甲基苯甲基二甲基烯丙基轉移酶(CpaD)轉化為β-CPA。maoA編碼單胺氧化酶(CpaO)催化了α-CPA生物合成的最后一步[68]。通過敲除與CPA產生相關基因簇基因(maoA、dmaT、pks-nrps和ctfR1,發現除ctfR1敲除菌株外,所有類型的敲除菌株均喪失了產生CPA的能力[69]。在黃曲霉ΔveA突變體中,黃曲霉震顫毒素被完全阻斷,CPA的產量同時大大降低[70]。laeA是真菌次級代謝途徑的調節因子,其在煙曲霉中的過表達增加了CPA的產生[71]。CPA 還受到非生物因素(如溫度和水活度)的影響。在25 ℃條件下,黃曲霉的CPA產量最高,CPA作為侵染農作物的有毒污染物的重要性被黃曲霉毒素污染帶來的擔憂所掩蓋。需要更多的研究來闡明低水平的CPA對人類和動物健康的影響。
3.2 利用功能基因組學研究黃曲霉與植物的相互作用
真菌生長和黃曲霉毒素污染是宿主、真菌和環境之間相互作用的結果。花生作為最具重要商業價值的農作物之一,一直飽受黃曲霉毒素污染的嚴重困擾。RNA-seq是一種使用深度測序技術進行轉錄組學分析的方法,改變了人們對真核轉錄組范圍和復雜性的認識。通過RNA-seq進行的初步分析可以表明蛋白質組學或代謝組學等其他組學技術的適用性或實用性[72]。在通過RNA-seq研究黃曲霉菌和花生(S和R基因型)之間的相互作用時,發現與R基因型花生相比,S基因型花生的黃曲霉毒素含量增加,差異表達基因(DEG)與菌絲體生長和穿透、分生孢子形成和發育有關[73]。在玉米和黃曲霉的相互作用中,涉及與囊泡、內核體和糖代謝基因相互作用的中心樞紐基因Ubi4與pH調節劑PalF和氮調節劑AreA的相互作用[74]。通過RNA-seq研究微生物對體外種子定殖(IVSC)的抗性,了解宿主與病原體之間的相互作用。通過RNA-seq鑒定與宿主-病原體相互干擾和標記有關的基因;通過基因工程(例如RNAi)培育抗性品種;通過多組學方法(如代謝組學、基因組學、轉錄組學和蛋白質組學)研究病原真菌的相互作用,獲得前后的鑒定、分離和描述真菌毒素產生的能力;通過多組學方法,可以更準確地發現影響真菌發育、毒素產生以及真菌與植物相互作用的關鍵因素。找到相關基因后,可以通過本文中提及的基因編輯技術敲低或敲除相關基因來進行準確驗證。
目前,大多數關于真菌與農作物之間相互作用的研究都停留在實驗室階段。基于實驗室的理論研究可以被視為具有指導價值的理想模型。受多因素影響,大多數實驗還旨在單個產毒素黃曲霉菌株的研究及其與宿主的相互作用。然而,田間真實的情況是復雜多樣的,黃曲霉毒素的污染與多種真菌或細菌相關。通過功能基因組學研究黃曲霉不同菌株的相互作用以及黃曲霉與其他曲霉菌甚至其他病原菌的相互作用是未來的發展趨勢。
4 展 望
近年來,功能基因組學研究迅速崛起,在真菌生長發育、挖掘真菌次級代謝產物以及研究包括黃曲霉毒素在內的真菌毒素等方面得到了廣泛應用。然而,黃曲霉功能基因組學受到其細胞壁難以破除、耐藥性高、選擇標記少、缺陷型菌株構建費力耗時等因素的影響而發展緩慢。目前,在黃曲霉中,主要通過構建NHEJ缺陷型菌株來提高菌株的同源重組效率,從而提高其基因編輯的效率。但這種構建方式,不能解決選擇標記少等問題,不利于連續的遺傳學研究。正是由于缺乏選擇標記,使得大多黃曲霉研究停留在單個基因的研究。而Cre-loxP重組系統具有可以刪除選擇標記的特征,可以連續構建多基因敲除菌株。同時,CRISPR-Cas9等基因編輯技術的出現,積極推動了功能基因組學的發展。目前,CRISPR-Cas9被廣泛應用于米曲霉、黑曲霉、煙曲霉等曲霉屬菌株構建中,在黃曲霉菌株中還未見相關報道。同時,功能基因組學在研究真菌與其他病原微生物的互作方面具有良好的發展前景。通過多組學方法,可以更準確地尋找影響真菌發育、毒素產生以及真菌與植物相互作用的相關基因。而影響真菌發育、毒素產生以及真菌在植物中的定殖往往并不是由單一基因調控的。找到這些相關基因后,可以通過本文中提及的基因編輯技術敲低或敲除相關基因來進行準確驗證。同時,通過這些基因編輯技術可以更好地研究完整的代謝通路,為黃曲霉的遺傳學研究提供參考。

