從“一顆結石的前世今生”看“沉淀溶解平衡”
吳瓊

摘要:沉淀溶解平衡既是水溶液中的離子平衡理論的進一步延續,又是化學平衡理論的概括和整合。以“一顆結石的前世今生”作為故事主線,按照“結石是如何形成的”“結石體系是怎么樣的”“產生結石該怎么辦”“如何預防結石”四部曲,詳述了4個核心探究:沉淀的生成、建立、移動及Ksp的應用。
關鍵詞:難溶電解質;沉淀溶解平衡;探究性教學
文章編號:1008-0546(2021)04-0058-03 中圖分類號:G632.41 文獻標識碼:B
doi:10.3969/j.issn.1008-0546.2021.04.015
一、背景介紹
“沉淀溶解平衡”是人教版選修4《化學反應原理》第三章第四節的內容[1]。在前概念上,學生初中學習了飽和溶液、溶解度等知識,高中從化學平衡的視角學習了弱電解質的電離、水的電離、鹽類的水解等現象,這些為學生學習沉淀溶解平衡奠定了知識及方法層面的基礎。但筆者在教學中發現,學生對物質的沉淀與溶解認識有所缺陷。具體表現為:①認為沉淀的生成是一個單向反應,無法建立沉淀溶解平衡的可逆反應模型。②認為難溶等于不溶,忽視沉淀在水中的微量溶解[2]。③新課程雖然在化學平衡中引入化學平衡常數,但在此章節中很少涉及Ksp教學,學生無法從定量上精細構建思維,縱觀2020年全國高考,Ⅰ卷T26開始沉淀和溶解pH、Ⅲ卷T27開始和沉淀完全時的pH均圍繞Ksp的考查。④難以真正將化學知識運用于生活,并能用化學知識和思維方法解決問題。
本教學設計的核心探究屬于模型建構和解釋型探究,旨在培養學生系統、整體、精細的思維,提高學生解決實際問題的能力。本節課的教學設計秉承“知識問題化、問題情境化、情境生活化”的設計理念,用“一顆結石的前世今生”的真實生活情境,將“難溶電解質的溶解平衡的概念建構及應用”等核心探究有效串聯。在教學過程中,通過實驗探究和理論結合的方式,讓學生體會到化學知識的價值。
二、教學過程
環節一:結石是如何形成的?
【資料】已經知道腎結石有32種成分,最常見的成分為草酸鈣(CaC2O4),占71%~84%,其他成分的結石如磷酸銨鎂、尿酸鹽、磷酸鈣以及朓胺酸(一種氨基酸)等。腎結石很少有單純一種晶體組成,大多有兩種或兩種以上,而以一種為主體。
【問題1】你如何設計一個實驗來模擬結石(CaC2O4)的形成過程?
【生1】利用可溶性的鈣鹽和草酸鹽反應。
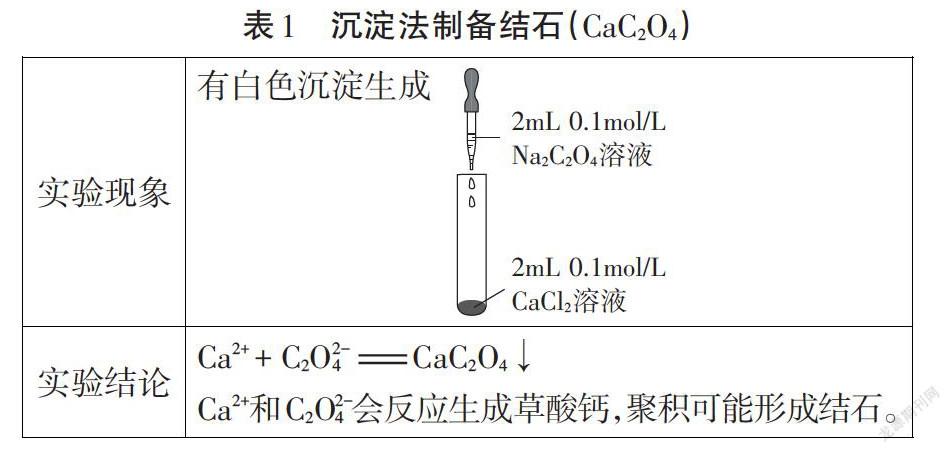
【實驗探究1】模擬結石(CaC2O4)的形成過程(表1)。
探究活動的功能價值:沉淀的生成環節,從化學的視角,走進一顆結石的前世今生。選擇生活中的情境素材,激發學生強烈的探究欲望,引導學生在真實問題情境中感受化學與生活的密切關系,將知識與生活貫穿一體。此標題也激發了學生強烈的好奇心和求知欲,使學生迅速進入探究學習狀態。
環節二:結石體系是怎么樣的?
【問題1】在以上所得的結石體系(CaC2O4懸濁液)中,我們投入的是等濃度等體積的Ca2+和C2O42-,按化學計量數,它們應恰好完全反應。上層清液中是否還有Ca2+和C2O42-?如何設計簡單的實驗來證明?
學生活動:設計探究實驗,小組討論,小組代表發言。
【生1】利用C2O42-的還原性,可選用KMnO4溶液檢驗C2O42-;利用沉淀法,可選用Na2CO3溶液檢驗Ca2+。
【實驗探究2】結石體系上層清液中Ca2+和C2O42-檢驗(表2)。
【生2】方案1中酸性高錳酸鉀溶液褪色,證明上層清液中存在C2O42-,而方案2中無明顯現象,證明上層清液中一定不存在Ca2+。
【追問1】我們的結石體系投入的是等濃度等體積的Ca2+和C2O42-,從定量的角度,二者應同時存在。
【生3】方案2中無明顯現象有可能是Ca2+濃度太小了,肉眼看不到沉淀。
【追問2】我給大家提供一種Ca2+的靈敏檢驗試劑——鈣試劑,無Ca2+時顯藍色,有Ca2+時顯酒紅色,請同學們利用鈣試劑完成上層清液的補充實驗。
實驗結果證明:結石(CaC2O4懸濁液)體系中上層清液存在Ca2+和C2O42-。
【問題2】上層清液中同時存在Ca2+和C2O42-,這說明了什么?這個過程是如何建立的?
【生1】說明Ca2+和C2O42-沒有完全轉化為沉淀,這個沉淀反應不能進行到底,也是一個可逆反應。正向和逆向反應同時進行,正反應是生成沉淀的反應,逆反應是沉淀溶解電離成離子的過程。
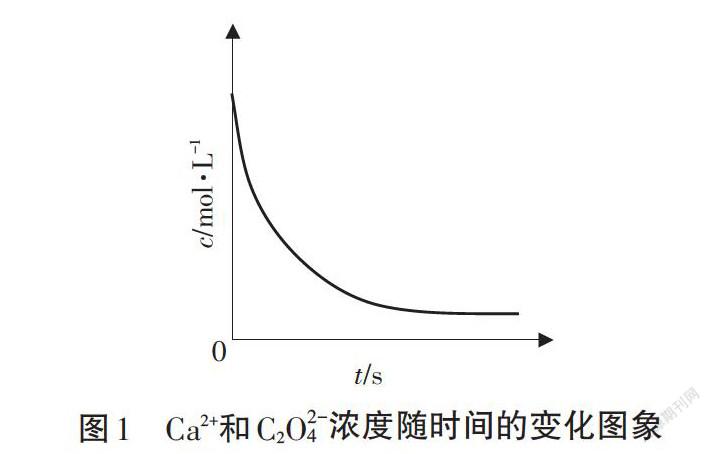
學生活動:請用v-t圖(v沉淀和v溶解隨時間的變化)和c-t圖(Ca2+和C2O42-濃度隨時間的變化)表示這個平衡的建立過程。
【動畫演示】CaC2O4的沉淀溶解微觀過程。
教師總結:對于結石體系,Ca2+、、C2O42-、CaC2O4共存,溶液中存在兩個過程,在水分子的作用下,少量Ca2+和C2O42-脫離CaC2O4表面溶入水中,另一方面,溶液中Ca2+和C2O42-受CaC2O4表面陰陽離子的吸引回到固體表面析出沉淀。當沉淀和溶解的速率相等時,就建立了一個平衡,叫沉淀的溶解平衡。
【思考】如何表達沉淀的這種平衡關系?
用溶解平衡方程式:CaC2O4(s)Ca2+(aq)+C2O42-(aq)
【問題3】Ca2+和C2O42-濃度隨時間的變化圖象(圖1)能否更完善?
Q1:能不能定量表示?
Q2:哪些點可以定量標注?
Q3:起點和終點濃度分別是多少?
Q4:終點Ca2+和C2O42-濃度大小由什么決定?
Q5:如何計算出Ca2+或O2O42-濃度?
【生1】起點離子濃度均為0.1mol/L ,終點有濃度但未知。
【生2】由于二者溶液混合導致體積變化,起點濃度應是0.05mol/L。
【生3】定量上應符合Ksp(CaC2O4)=c(Ca2+)·c(C2O42-),由此計算終點時Ca2+或C2O42-濃度。
教師總結:(1)CaC2O4難溶并非為不溶,當沉淀速率等于溶解速率時,即為沉淀溶解平衡。
(2)沉淀溶解平衡也是化學平衡的一種,符合化學平衡的一切特征,因此我們可以從Ksp的視角,定量的判斷與沉淀的生成和溶解有關的問題。
探究活動的功能價值:沉淀溶解平衡的建立環節,突破以往以教師為主導的單一講定義、講特征,由真實情境提出探究性問題:如何檢驗沉淀完全,即檢驗上清中的Ca2+和O2O42-?兩種離子的檢驗搭載了復分解反應和氧化還原反應兩種常見思維。在學生實驗的過程中,通過猜想假設、分析論證、類比推理的方式主動構建沉淀溶解平衡模型,實現了學生自主探究,教師輔助引導,將課堂真正還給學生。另一方面,通過對數據的分析與處理,使學生的認知從定性上升到定量,培養了學生在陌生情境中解決問題的能力。
環節三:產生結石該怎么辦?
【問題1】我們已經知道結石(CaC2O4)難溶于水,溶解度很小,但存在沉淀溶解平衡:CaC2O4(s)Ca2+(aq)+C2O42-(aq),那么,有哪些外界條件會影響這個平衡?已知:H2C2O4是一種弱酸。學生活動:設計實驗,提出方案,完成表格3。
【生1】通入HCl,平衡正移,c(C2O4-)減小,c(Ca2+)增大
【生2】加水,平衡正移,c(Ca2+)、c(C2O42-)均減小
【生3】加CaCl2,平衡逆移,c(Ca2+)增大,c(C2O42-)減小
【生4】加Na2C2O4,平衡逆移,c(C2O42-)增大,c(Ca2+)減小
【生5】加熱,平衡正移,c(Ca2+)、c(C2O42-)均增大
【討論】從平衡移動的角度,以上哪些條件改變有利于腎結石的治療?
【生6】多喝熱水!喝水時,c(Ca2+)、c(C2O42-)均減小,Qc 教師總結:結合平衡移動原理,改變溫度、濃度、壓強這三個條件之一,就能影響化學平衡。溶液體系不考慮壓強,大多數溶解為吸熱過程,再結合濃度的考慮,減小沉淀溶解平衡中相應的離子濃度,沉淀就會溶解。 探究活動的功能價值:溶解平衡的移動環節,借助探究實驗提高了學生設計實驗的能力,通過培養學生發散、聯想、靈活的思維,促進核心知識的應用。 環節四:平時如何預防結石? 【問題1】預防結石的關鍵是什么? 【生】預防腎結石,關鍵是Qc 教師總結:飲食的建議:(1)多喝水!多喝水!多喝水! (2)不要過度補鈣 (3)不要過量食用含草酸(鹽)的食物:一方面,與鈣結合形成草酸鈣,阻礙了鈣的吸收,導致缺鈣;另一方面,增加尿液中草酸的含量,易形成草酸鈣,導致結石。 探究活動的功能價值:溶度積常數的應用環節,回歸生活真實情境,希望學生的思考、求證從課堂延續到生活。從教學意義上說,沉淀溶解平衡無論對于化學知識本體,還是化工生產及人們的生活實際都有重要意義。 三、總結與反思 1.雙線平行,讓學生成為課堂的主人 本節課通過知識問題化、問題情境化、情境生活化,實現了實驗探究、問題探究雙線平行,利用學生的認知沖突,定性和定量相結合,實現核心知識到知識應用的轉化,培養學生的精細思維,提升學生的思維品質。 從化學的視角來研究結石問題,把“一顆結石的前世今生”主題研究的過程和涉及的化學知識聯系起來(表4)。 2.對于核心探究環節,應精準設置關健問題 在建構沉淀溶解平衡概念時,從學生的知識生長點出發,提出問題:如何檢驗上層清液中是否還有Ca2+和C2O42-?該問題的提出非常關鍵,從宏觀現象到微觀離子,引導學生在實驗探究中建立起沉淀溶解平衡。在c-t圖中,能不能定量表示?哪些點可以定量標注?如何標注?層層遞進,以促使學生進行生成性和多輪次思考,促進高級思維的發展。 3.知識、能力、觀念之間的邏輯關系 許多學生從畢業走人社會不一定從事化學有關的工作,但中學化學教育對他們仍有重要意義。畢華林教授認為:化學基本觀念的形成既不可能憑空產生,也不能通過大量記憶知識形成,需要學生在主動探究中不斷反思、概括、提煉而成[3]。因此,化學基本觀念的形成影響著學生處理實際問題的價值取向和行為方式,具有超越知識的持久價值和廣泛的遷移作用。 參考文獻 [1]宋心琦.普通高中課程標準實驗教科書·化學反應原理(選修)[M].北京:人民教育出版社,2007 [2]東起云.促進化學觀念建構的“難溶電解質的溶解平衡”教學設計[J].教學儀器與實驗,2013,29(7):8-11 [3]畢華林,盧巍.化學基本觀念的內涵及教學價值[J].中學化學教學參考,2011(6):3-6

