生成性問題在高中化學教學中的應用研究
呂艷

摘要:問題是思維的源泉,更是思維的動力。目前,教師對“問題”與“問題鏈”的設計研究較多,而對課堂教學中“生成性問題”的研究則尚嫌不足。結合教學實踐,從“精心預設”“捕捉意外”和“善待錯誤”等例談高中化學課堂教學中的“生成性問題”。
關鍵詞:生成性問題;預設;意外;錯誤
文章編號:1008-0546(2021)06-0029-03 中圖分類號:G632.41 文獻標識碼:B
doi:10.3969/j.issn.1008-0546.2021.06.008
相信每位老師都聽過這樣的公開課:執教者根據教學內容精心預設了一系列有機聯系的問題,安排好設疑的層次和梯度,不斷提出問題,造成懸念,學生依次回答老師所提的問題。整個教學過程氣氛活躍,學生的參與度高,知識的傳遞和預期的目標也得以達成。但整節課學生沒有提出一個問題,好像沒有一點疑問,這合理嗎?
課堂教學是師生互動的過程,學生是活生生的個體,他們的許多想法、思維常常與教師有所不同,因此,自然而然就會產生許多生成性的問題。之所以沒有問題,究其原因是學生在順著教師的設計和思路演義“教案劇”,從這個意義上說,整個教學過程就變成了教師的“獨角戲”。
化學新課程的核心理念是以發展學生化學學科核心素養為主旨,“發展”是一個動態的生成過程。這就要求化學課堂要以人為本,把學生從傳統的“認知體”提升到“生命體”的高度,賦予課堂更多的生成性。只有有了“生成性問題”,才能構建思維的“問題鏈”,課堂教學才會充滿活力,才能讓“獨角戲”轉化為“交響樂”。
一、什么是“生成性問題”?
“生成性問題”是指真實的課堂教學情境中通過師生互動,在共同思考與發展中產生的超出預設的新問題。它既可以是學生根據所學知識或生活經驗,對課堂學習內容提出的拓展式問題;也可以是由課堂內外的突發事件引發偶發式問題。
例如,在“鈉的化學性質”教學中,學生完成鈉與水反應的實驗并得出結論后,教師提出:在金屬活動性順序表中,排在氫前面的金屬能和鹽酸反應生成氫氣,那么金屬鈉和鹽酸反應的情況如何?預設目的是讓學生認識鈉與稀鹽酸反應比與水反應劇烈,鈉塊燃燒。學生討論并用實驗驗證之后,預設的價值得以體現。此時學生提出:為什么鈉與鹽酸反應會比與水反應劇烈?這就是拓展式問題。學生在對比水和鹽酸溶液的成份后得出:反應的劇烈程度和氫離子濃度有關。正當老師準備進行下一教學任務時,一位學生突然問:老師,如果鹽酸的濃度越大,是不是反應越劇烈?問題一提出,就有同學小聲嘀咕:“當然了,這還用問嘛。”此時,我意識到,恐怕大部分學生都應該是這樣認識的,我問“同學們都是這樣認為的嗎?”果然,肯定的回答幾乎是異口同聲。這就是偶發式問題。學生實驗:將一小塊金屬鈉投入裝有濃鹽酸的小燒杯中,觀察現象:鈉粒四處游動,漸漸變緩,燒杯內有白色沉淀出現,鈉粒沒有出現燃燒現象。學生感到十分困惑,實驗現象與預測的不一致,激發起學生探究知識的強烈愿望。師生共同討論知:生成的白色沉淀是NaCl,NaCl的生成阻礙了Na與H2O的反應,濃鹽酸揮發出來的HCl氣體阻礙了Na與O2的接觸,故不能燃燒。
課堂中有拓展式問題,說明學生思維活躍,學生的主體地位得以顯現,是一種有意義的主動學習;在此基礎上,如果又有了偶發式問題,就能提高學生的學習積極性,主動思考,是一種有生命活力的學習。
二、如何開發利用“生成性問題”?
1.精心預設
“凡事預則立,不預則廢。”這里的“預”,就是預設。課堂預設是教學活動的起點和指南,它為師生確定了課堂活動的目標、內容以及實現目標的行動路徑,可以使教學過程有序進行。只有課前多角度精心預設,才會有“無心插柳柳成蔭”的精彩生成。
在鐵及化合物的性質教學時,教材[1]對“為什么向FeSO4溶液中滴入NaOH溶液時,生成的白色沉淀會迅速轉變為灰綠色,最終轉變為紅褐色?”的解釋是:“白色的Fe(OH)2被空氣里的氧氣氧化成紅褐色的Fe(OH)3。”事實上,實驗過程中的白色沉淀往往夾雜著灰綠色,幾乎分辨不出,很難觀察到理想的實驗現象。要求學生以此推理出上述解釋,缺乏證據支撐。為此預設如下:
(1)討論:如何來制取氫氧化亞鐵?(用FeSO4溶液和NaOH溶液反應制得)
(2)實驗:向一支潔凈的試管中先加入一定量的FeSO4溶液,再滴入幾滴NaOH溶液,觀察現象。(無白色絮狀沉淀生成)
(3)質疑:為什么不能觀察到白色沉淀?(Fe(OH)2與O2接觸被O2氧化,也有可能是溶液中可能有少量的Fe3+直接生成了Fe(OH)3所致)
(4)探究:要想觀察到明顯的白色沉淀,需要創造什么條件?(無Fe3+的環境;無O2的環境)
(5)再探究:可以采取哪些措施以達到上述條件?(排除溶液中的Fe3+可以加鐵粉;驅逐溶液中的溶解氧可以加熱煮沸;避免與空氣接觸可以將膠頭滴管伸入試管內、油封、試劑瓶裝滿等)
預設以上問題在于讓學生找出不易觀察到白色沉淀的原因和解決的方法。此時及時提出:能否設計一個簡單實驗,能較長時間觀察到白色沉淀的生成?并把這個問題作為一個探究性課題留給學生以生成更多的問題。
學生的探究結果讓我又喜又驚。喜的是這是夢寐以求的課程問題,能夠在學生的互動中形成;驚的是有些內容是連教師也沒有想到的,列舉兩例,與同行共賞:
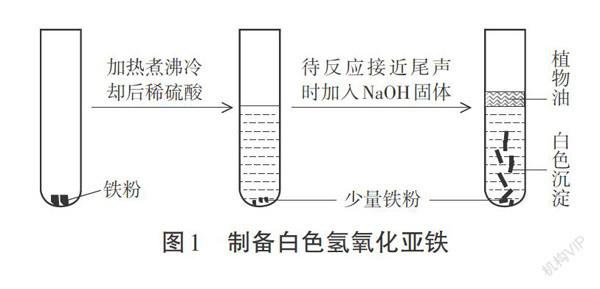
其一:在試管中加入一定量的還原鐵粉,快速加入煮沸并冷卻至常溫的稀硫酸(使鐵粉過量);待只有少量氣泡冒出時,向其中滴入幾滴植物油(隔絕空氣),然后向試管中放入片狀的NaOH固體(圖1所示)。
其二:取2g未變質的FCSO4晶體,加入煮沸過的蒸餾水,振蕩使其溶解,用醫用針筒吸取約10mL溶液后,再吸取約10mL的NaOH溶液,觀察現象。當觀察到白色沉淀一段時間后,吸入空氣,即可觀察到白色沉淀先轉變為灰綠色,后轉變為紅褐色。
甚至有的同學提出用攝子夾取一小塊金屬鈉,迅速插入到盛有新配制FeSO4溶液的試管中下部。也能觀察到溶液中產生氣泡的同時有白色絮狀沉淀生成等。
預設只是預設“問題”生成的可能性,而不是必然性,如果是明確一定會產生什么樣的問題或答案,那就不是生成了。預設能夠生成更多新問題的關鍵是創設更加開放的問題情境和活動情境,促使學生多角度思考、多層面理解,從而產生比較多的“新問題”。
2.捕捉意外
著名教育家蘇霍姆林斯基說:“教育的技巧并不在于能預見課堂的所有細節,而是根據當時的具體情況巧妙地在學生不知不覺中做出相應的變化。”化學教學過程不應該只是知識的單項傳授,而應該是一個師生互動,素養生成的過程。老師不可能也不應該事先安排好課堂上的所有內容,也無需擔心非預設生成會讓自己在課堂上完成不了既定的教學任務,更不能在學生出現疑問時,打斷學生提問或敷衍了事。因為這會使我們失去課堂中最具生命力的教學資源。
在執教“鈉的化學性質”公開課時,我設計了一組微型的學生實驗,其中有“將一小塊金屬Na投入到CuSO4溶液中,觀察現象”的實驗,目的是讓學生認識到該反應的實質是Na與H2O先反應,生成的堿再與CUSO4反應。本應該看到鈉在CUSO4液面上浮、游、熔、響,溶液中有藍色絮狀沉淀生成。但學生在做該實驗時出現了異常情況:在燒杯中除了藍色沉淀外,還有黑色物質出現。由于是學生實驗,大多數學生都出現了這種情況,引起了學生們的議論。我意識到可能是同學切鈉塊時切大了一點所導致的。這是開發生成問題的好機會,我并沒有急著說出原因,而是把問題拋給了學生:
(1)討論:黑色的固體物質可能是什么?(煤油沒有擦干凈燃燒時產生了炭黑,或是氧化銅)
(2)探究:如何證明黑色固體是氧化銅還是炭黑?(實驗:向燒杯中加一定量稀鹽酸,充分攪拌。黑色固體消失,溶液變為藍色)
(3)再探究:氧化銅是如何產生的?
將學生再次送入探究新知的討論中。經過討論達成共識:鈉與水反應放出的熱量積累,使部分Cu(OH)2分解,產生CuO。
(4)為什么有的同學實驗中沒有黑色固體生成,而有的同學的實驗中有黑色固體呢?(鈉塊小,放出的熱量少,且能及時散失,就不能將Cu(OH)2分解。鈉塊大,放出的熱量多,且不能及時散失,熱量的積累使溶液的溫度升高。)
問題的解決,使學生臉上露出了滿足、喜悅的神情。就在我準備進行下一教學內容時,一位同學問道:“難道鈉就真的不能置換出硫酸銅中的銅嗎?那為什么書上說金屬鈉能從欽等金屬氯化物中置換出金屬單質?”全班同學刷地靜下來看著我。事出意外,怎么辦?若是繼續按著學生的思路探究,預設的教學任務肯定是不能完成了,何況這個問題讓學生自己探究是很難完成的,但若找個借口搪塞過去,又怎么能解決學生心中的疑惑?稍加思索后,我說:“你的疑問很好,說明你是一個善于思考的學生,你能告訴我Na置換出TiCl4時條件是什么嗎?”
學生:700~800℃
教師:在這個溫度下鈉是什么狀態?
學生:液態,因為鈉的熔點只有97.8℃。
演示實驗:在一塊凹形瓷片放黃豆粒大小的一塊Na,取一藥匙無水CuSO4粉末將Na塊覆蓋(為了安全,可用坩堝蓋子把粉末蓋好)。當加熱1~2min之后,反應會爆炸式進行,瞬間放出的熱會使瓷片破裂,生成光亮的紫紅色Cu凝附在瓷片上非常醒目[2]。
學生討論:從反應進行的劇烈程度和生成如此光亮純潔的Cu,可以初步判定除發生2Na+CuSO4=Na2SO4+Cu之外,很難還有其他什么反應發生。
教師:在學習中,常常容易把反應物相同,但條件不同的反應混為一談,這是很值得注意的,因為化學反應條件是影響化學反應產物的重要因素。我們在以后的學習中要注意反應發生的條件,不能以偏蓋全。
教學雖沒有按照預設的路線前進,教學任務沒有完成,但課堂活起來了,精彩生成了,得到了聽課老師和專家的好評。
3.善待錯誤
葉瀾教授在“重建課堂教學過程觀”一文中提到:“學生在課堂活動中的狀態,包括他們的學習興趣、注意力、合作能力、發表的意見和觀點、提出的問題與爭論乃至錯誤的回答等,都是教學過程中的生成性資源。”行為主義心理學家也認為:“人是在不斷嘗試錯誤中進行學習的。”課堂上,由于學生在知識建構過程中會受到一些條件的制約從而產生認識上的偏差和負遷移,導致錯誤也是在所難免的,甚至教師出錯也是可能的。對于課堂中的錯誤,教師要是能根據實際情況靈活選擇、整合,以錯切入,引發沖突,就能將錯誤轉化鮮活的生成性問題。
例如我在“水溶液中的離子平衡”復習課上,提出:在制得的氫氧化鎂沉淀中,加入濃的氯化銨溶液,沉淀完全溶解,你能用有關理論解釋上述事實嗎?
學生甲:由于NH4+水解顯酸性,H+與OH-結合使平衡向右移動,故Mg(OH)2沉淀溶解。
學生乙:由于NH4+水解顯酸性,而Mg(OH)2易溶于酸中,發生Mg(OH)2+2H+=Mg2++2H2O反應使Mg(OH)2沉淀溶解。
學生們展開了激烈的討論,但都無法說服對方。事實上,此處問題的癥結不是H+與OH-的結合,也不是Mg(OH)2溶解于酸中,而是NH4+與OH-結合成NH3·H2O而使OH-濃度減少,Mg(OH)2沉淀溶解。面對學生的錯誤,我沒有馬上下結論,而是提出:在濃的NH4Cl溶液中NH4+和H+的濃度大嗎?
學生丙:鹽類的水解是微弱的,只有很小部分水解,所以NH4+濃度很大,而H+濃度很小。
老師:同學們能否從矛盾的兩個方面來考慮這個問題?
學生甲:看來我剛才的回答是有問題的。NH4Cl水解是微弱的,產生的c(H+)很小,溶液c(OH-)也很小,它們之間反應很有限,是矛盾的次要方面;而原溶液中c(NH4+)很大,加入Mg(OH)2后,電離產生的是OH-與NH4+結合成NH3·H2O,而使c(OH-)減少,平衡溶解,這才是矛盾的主要方面。
老師:回答得很好!同學們,能否將NH4Cl晶體換成另一種可溶性晶體?”(提供醋酸和氨水的電離常數)
同學丁:向濃的CH3COONH4溶液中加入少量Mg(OH)2固體,振蕩,若固體溶解則丙結論正確。
老師:為什么?
同學丁:根據醋酸和氨水的電離常數,在相同條件下它們的電離程度基本相同,CH3COONH4溶于水后,溶液應該呈中性。
這個問題是由學生的錯誤答案引起的,經過教師的及時引導,理清楚了化學概念中的關鍵問題。因此善待錯誤,借題發揮,就能將學生的錯誤轉化為動態生成的教學資源,進而構建生態課堂,促進學生學科素養提升。
生成性問題往往能創造出許多未曾預約的精彩。隨著新課程的實施,關注生成性問題,必將成為化學教師的一種共識。而且生成性問題本身就是最好的教學資源,教研(備課)組應針對教師教學中的實際問題和學生學習中的疑難問題開展研究,形成有特色的教學素材、案例和課件供全體教師分享,在分享中完善,不斷提高教學質量和水平[3]。
參考文獻
[1]宋心琦.普通高中課程標準實驗教科書化學1(必修).第三版[M].北京:人民教育出版社,2009:60
[2]劉懷樂.鈉與硫酸銅反應的實證分析[J].化學教育,2008(2):63
[3]中華人民共和國教育部.普通高中化學課程標準(2017年版)[S].北京:人民教育出版社,2018:88

