白洋淀草型淀區沉水植物暴發期浮游植物群落特征
劉 陽,李志斐,張曉可,劉學光,謝 駿,王廣軍,張軍旺
( 1.中國水產科學研究院 珠江水產研究所,農業農村部熱帶亞熱帶水產資源利用與養殖重點實驗室,廣東 廣州 510380; 2.上海海洋大學,水產科學國家級實驗教學示范中心,上海 201306; 3.廣東省水產養殖污染修復生態工程研究中心,廣東 廣州 510380; 4.安慶師范大學,水生生物保護與水生態修復安徽省高校工程技術研究中心,安徽 安慶 246133; 5.遼寧省現代農業生產基地建設工程中心,遼寧 沈陽 110003 )
白洋淀是我國華北地區最大的內陸淺水湖泊,由140多個相對獨立的淀泊組成,在維護生物多樣性和區域生態安全方面發揮著重要作用[1]。近幾十年來,受人為干擾的影響,白洋淀不同淀泊水域生態環境呈現較高的時空異質性。根據營養水平以及水生植被覆蓋度的不同,可將這些淀泊初步劃分為藻型淀區、草藻過度型淀區和草型淀區[2]。目前,藻型淀區和草藻過度型淀區數量占比較大,而草型淀區較少,已有的白洋淀研究也主要集中在藻型淀區和草藻過度型淀區[2-3]。
浮游植物作為水生態系統的初級生產者,生長周期短、對周邊環境變化敏感,其種類組成、優勢種類、豐度和生物量均對水生態系統環境變化有重要的指示作用[8]。國內外學者圍繞浮游植物群落與環境因子的響應關系、利用浮游植物進行水體生物學評價等方面做了一些研究[6,9]。雖然對沉水植物與藻類相互關系也開展過相關研究,但關于沉水植物暴發期浮游植物的群落結構卻鮮見報道。因此,筆者選擇草型淀區鰣淀作為研究區域,通過對沉水植物暴發期浮游植物的野外調查,了解草型淀區沉水植物暴發期浮游植物的群落結構及主要影響因素,對比分析沉水植物暴發期與非暴發期浮游植物群落特征的差異,評價草型淀區鰣淀沉水植物暴發期水體的健康狀況,旨在為白洋淀草型淀區的治理及保護提供理論依據。
1 材料與方法
1.1 采樣點概況
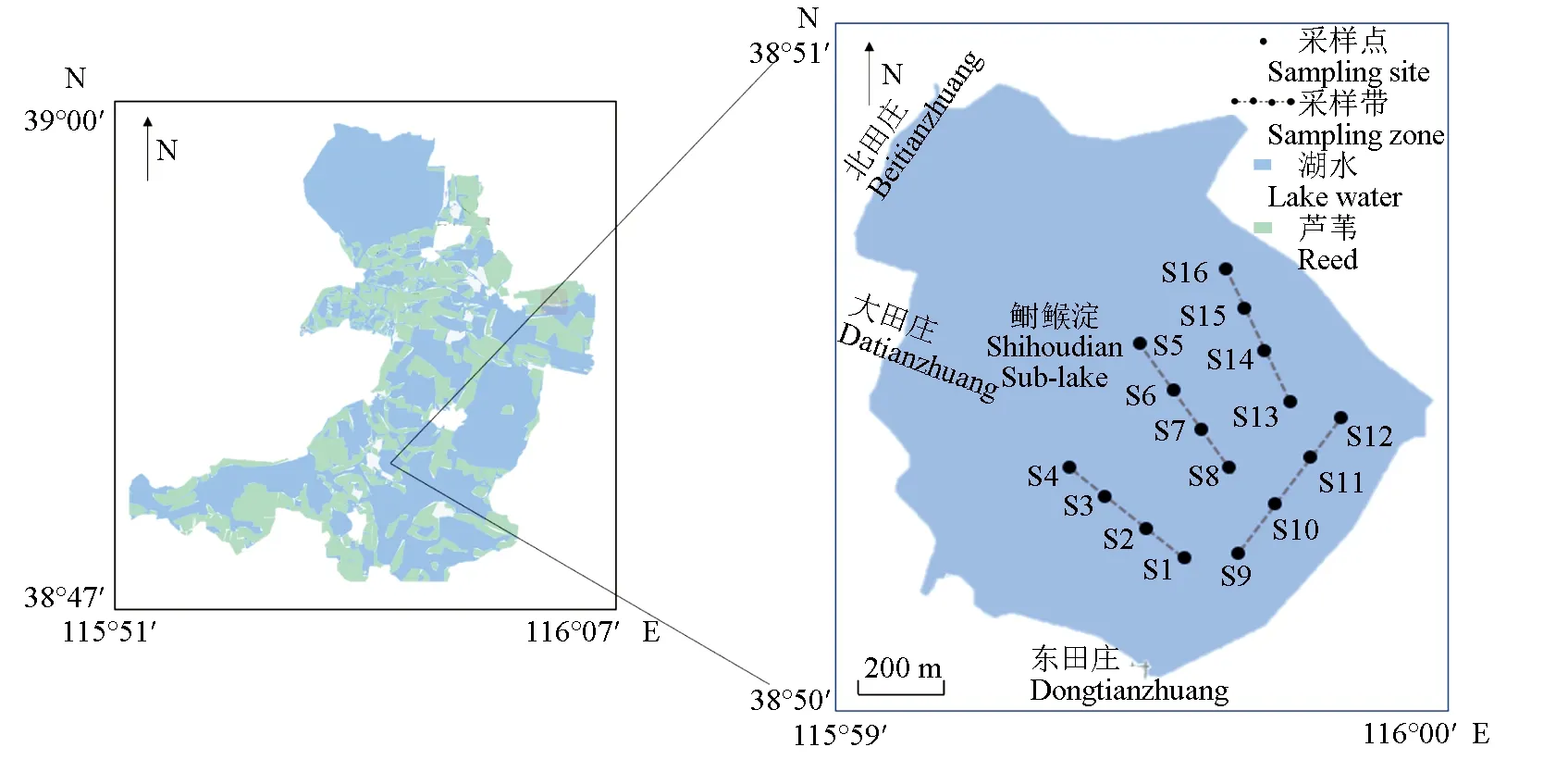
圖1 鰣淀浮游植物采樣點分布Fig.1 Distribution of phytoplankton sampling sites in Shihoudian Sub-lake
1.2 樣品采集與鑒定
浮游植物的定性采集使用25號浮游生物網,撈取后立即加5%福爾馬林固定,帶回實驗室后進行鑒定。浮游植物定量采集使用5 L有機玻璃采集器,由于研究水域水深較淺,各采樣點均在水面以下50 cm采水,再用塑料瓶取1 L水樣,加10 mL魯哥氏液固定,靜置48 h以后抽濾濃縮至30 mL。浮游植物的鑒定和計數參考文獻[12-13]。采樣的同時,另取一部分水樣帶回實驗室,測定總氮和總磷等水質指標。使用便攜式多參數水質分析儀(YSI Professional Plus,美國)測定溫度、溶解氧、電導率、總溶解固體和pH等指標;用透明度盤測定透明度;用測深錘測定水深。每個采樣點植被蓋度采用航拍法測算,首先以采樣點為中心劃定5 m×5 m的區域,利用航拍得到單個采樣點的平面圖,將平面圖均分為100個小方格,統計有植被的方格數量,計算得出蓋度。
1.3 浮游植物群落結構計算方法
采用香農—維納多樣性指數(H′)[14]以及浮游植物優勢度(Y)參數,分析鰣淀浮游植物群落特征,將Y≥0.02的藻類設為優勢種[15]。各參數計算如下:
H′=-∑Pilog2Pi
Y=ni/N×fi。
式中,Pi為第i種生物占總樣品數量的個體比例,ni為i種的個體數,N為所有種類總個體數,fi為第i種生物出現頻率。
香農—維納多樣性指數的評價標準為:H′≥4.0為清潔,3.0≤H′<4.0為輕污染,2.0≤H′<3.0為β中污型,1.0≤H′<2.0為α中污型,H′<1.0為重污染[9]。
1.4 數據分析
為消除極值影響并使數據滿足正態分布,在進行統計分析前,環境因子(除pH)和浮游植物豐度經過lg (x+1)數據轉化[16-17]。采用SPSS 23.0軟件對蓋度和浮游植物種類數、豐度、生物量進行皮爾森相關性分析,采用Canoco 5.0軟件對影響優勢種空間分布的主要環境因子進行分析。首先進行除趨勢對應分析(DCA)得出第1軸長度,若第1軸長度大于4則進行典范對應分析,處于3~4則典范對應分析和冗余分析均可,小于3采用冗余分析[18]。采用前選和蒙特卡羅檢驗來排除貢獻較小的環境因子。采用Excel 2019和Origin 9.0軟件制作相關的表格和柱狀圖。
2 結果與分析
2.1 理化參數分析
表1 夏季鰣淀水質理化參數
Tab.1 Physicochemical parameters in the water in Shihoudian Sub-lake in summer

表1 夏季鰣淀水質理化參數
理化參數Physicochemical parameter溫度/℃Temperature溶解氧質量濃度/mg·L-1Concentration of dissolved oxygen電導率/μS·cm-1Conductivity溶解性固體總量/mg·L-1Total dissolved solidpH平均值±標準差Mean±standard deviation30.03±0.349.02±1.631526.88±117.13995.31±76.249.45±0.25理化參數Physicochemical parameter透明度/mTransparency總氮質量濃度/mg·L-1Concentration of total nitrogen總磷質量濃度/mg·L-1Concentration of total phosphorus水深/mWater depth平均值±標準差Mean±standard deviation1.41±0.091.32±0.170.04±0.022.41±0.08
2.2 沉水植物蓋度
所有采樣點沉水植物蓋度的平均值為71.63%。S1號采樣點沉水植物蓋度最低,為46.30%。S16號采樣點沉水植物蓋度最高,為84.30%(圖2),皮爾森分析結果表明,沉水植物蓋度與浮游植物種類數、密度、生物量均無顯著相關性。
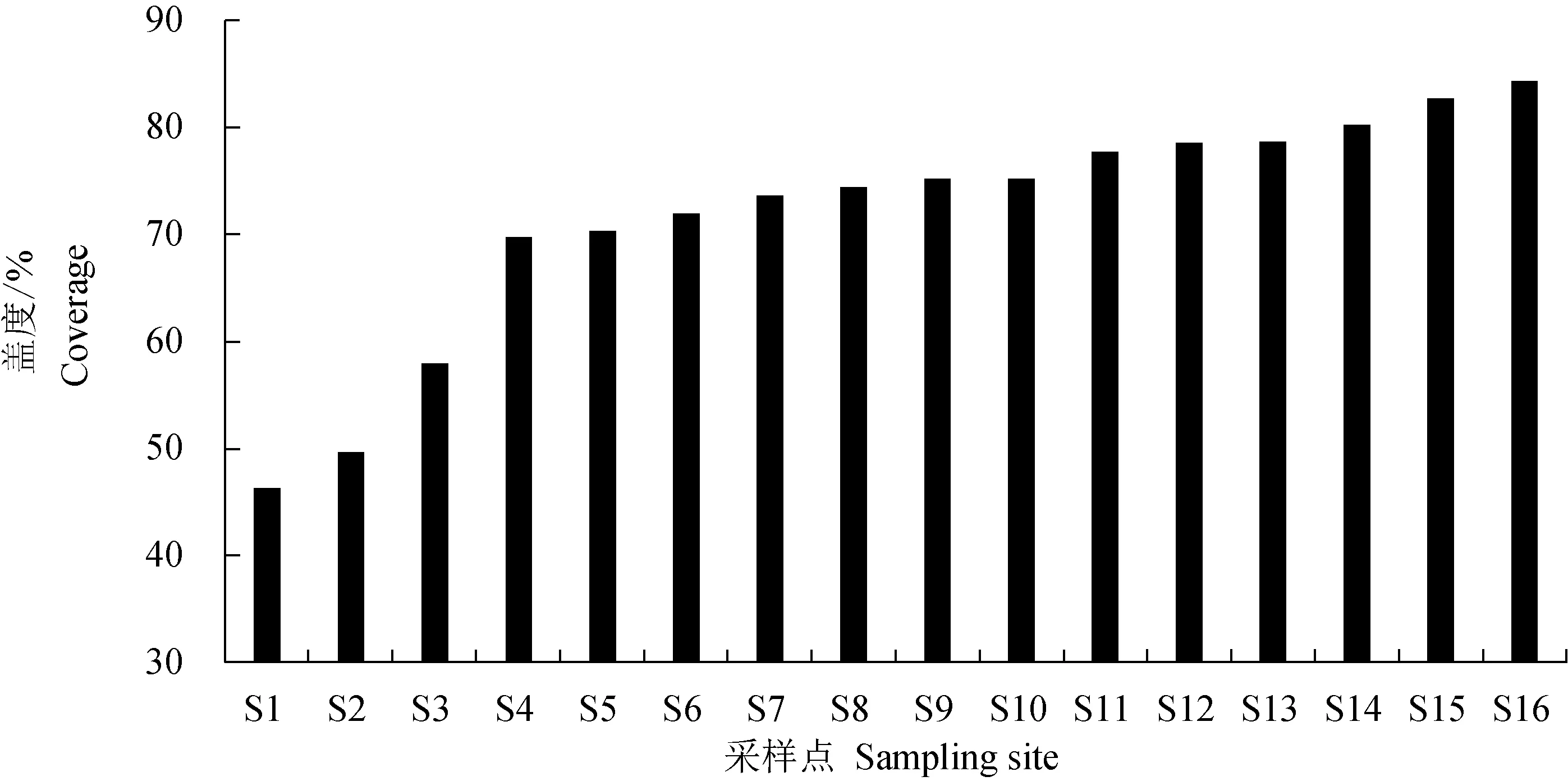
圖2 鰣淀夏季不同采樣點沉水植物蓋度Fig.2 Coverage of submerged macrophytes at different sampling sites in Shihoudian Sub-lake
2.3 浮游植物群落結構
2.3.1 浮游植物種類組成

圖3 鰣淀夏季不同采樣點浮游植物種類數Fig.3 Species number of phytoplankton at different sampling sites in Shihoudian Sub-lake
2.3.2 優勢種
浮游植物優勢種共計4門24種,以藍藻門和綠藻門為主要優勢類群,優勢度變化為0.02~0.66(表2)。小環藻(Cyclotellasp.)、澤絲藻(Limnothrixsp.),中華尖頭藻(Raphidiopsissinensia),綠藻門的色球藻(Chroococcussp.)在16個采樣點出現的頻率大于85%;尖針桿藻(Synedraacus)、阿氏項圈藻(Anabaenopsisarnoldii)、魚腥藻(Anabaenasp.)、偽魚腥藻(Pseudanabaenasp.)、轉板藻(Mougeotiasp.)、蹄形藻(Kirchneriellasp.)、扁盤柵藻(Scenedesmusplatydiscus)和維斯藻(Westellabotryoides)在16個采樣點出現的頻率小于15%。
表2 鰣淀各采樣點浮游植物主要物種的優勢度
Tab.2 Dominance of the main species of phytoplankton at different sampling sites in Shihoudian Sub-lake
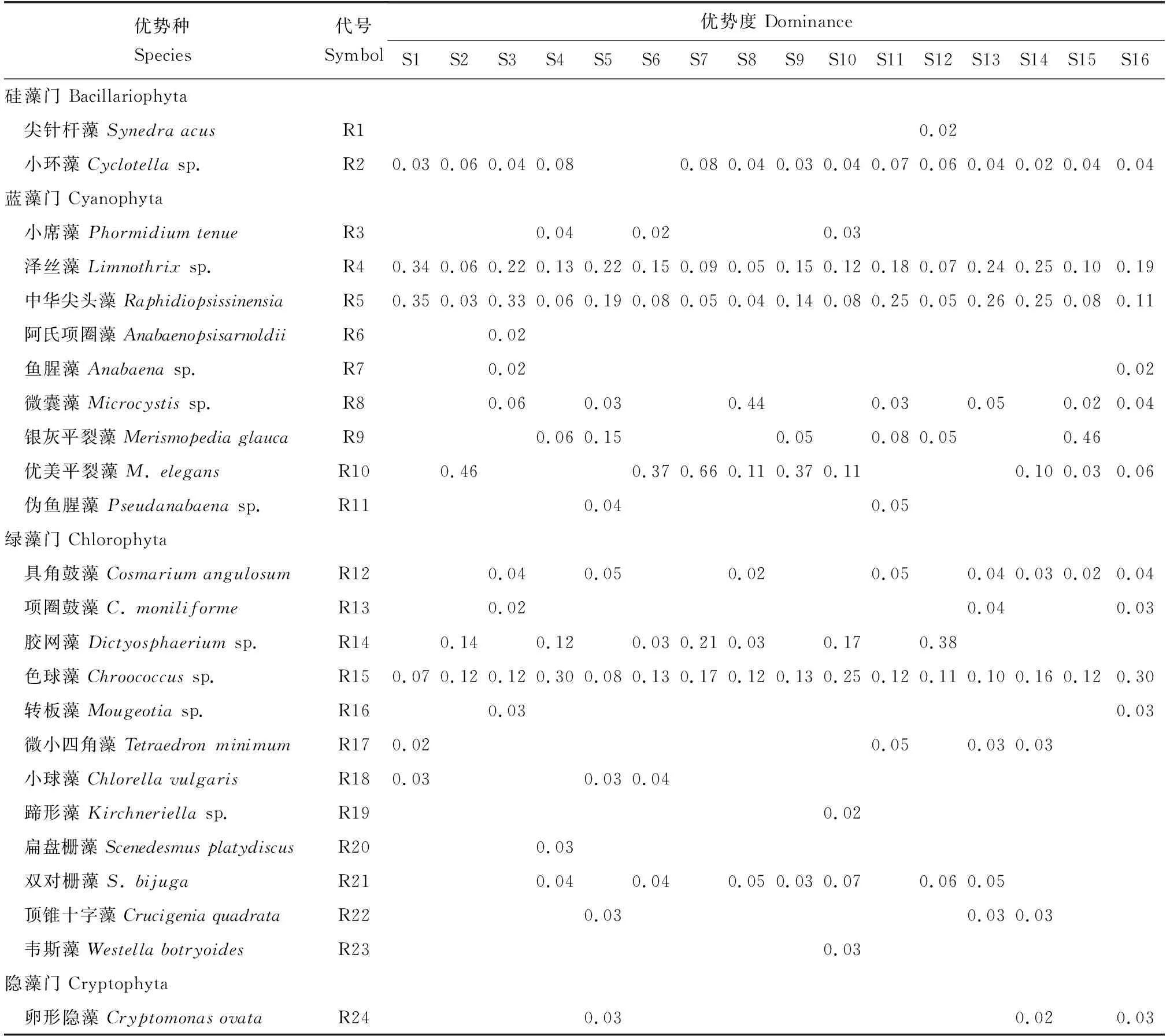
表2 鰣淀各采樣點浮游植物主要物種的優勢度
優勢種Species代號Symbol優勢度 DominanceS1S2S3S4S5S6S7S8S9S10S11S12S13S14S15S16硅藻門 Bacillariophyta尖針桿藻 Synedra acusR10.02小環藻 Cyclotella sp.R20.030.060.040.080.080.040.030.040.070.060.040.020.040.04藍藻門 Cyanophyta小席藻 Phormidium tenueR30.040.020.03澤絲藻 Limnothrix sp.R40.340.060.220.130.220.150.090.050.150.120.180.070.240.250.100.19中華尖頭藻 RaphidiopsissinensiaR50.350.030.330.060.190.080.050.040.140.080.250.050.260.250.080.11阿氏項圈藻 AnabaenopsisarnoldiiR60.02魚腥藻 Anabaena sp.R70.020.02微囊藻 Microcystis sp.R80.060.030.440.030.050.020.04銀灰平裂藻 Merismopedia glaucaR90.060.150.050.080.050.46優美平裂藻 M. elegansR100.460.370.660.110.370.110.100.030.06偽魚腥藻 Pseudanabaena sp.R110.040.05綠藻門 Chlorophyta具角鼓藻 Cosmarium angulosumR120.040.050.020.050.040.030.020.04項圈鼓藻 C. moniliformeR130.020.040.03膠網藻 Dictyosphaerium sp.R140.140.120.030.210.030.170.38色球藻 Chroococcus sp.R150.070.120.120.300.080.130.170.120.130.250.120.110.100.160.120.30轉板藻 Mougeotia sp.R160.030.03微小四角藻 Tetraedron minimumR170.020.050.030.03小球藻 Chlorella vulgarisR180.030.030.04蹄形藻 Kirchneriella sp.R190.02扁盤柵藻 Scenedesmus platydiscusR200.03雙對柵藻 S. bijugaR210.040.040.050.030.070.060.05頂錐十字藻 Crucigenia quadrataR220.030.030.03韋斯藻 Westella botryoidesR230.03隱藻門 Cryptophyta卵形隱藻 Cryptomonas ovataR240.030.020.03
注:空白單元格代表Y<0.02.
Note: The blank cell represents Y<0.02.
2.3.3 浮游植物豐度與生物量
浮游植物在各采樣點的豐度變化為5.68×106~17.24×106個/L,以S15號采樣點最高,S1號采樣點最低,平均值為9.13×106個/L。各采樣點豐度組成以藍藻門和綠藻門為主,平均分別占采樣點總豐度的57.67%和35.32%,最高分別占采樣點總豐度的73.66%和65.17%;硅藻門、隱藻門和甲藻門豐度均較低。浮游植物生物量變化為1.42~8.71 mg/L,以S12號樣點最高,S1號樣點最低,平均值為4.61 mg/L。各采樣點生物量均以綠藻門的貢獻最大,平均占采樣點總生物量的73.70%,S12號樣點貢獻率達到83.10%。其他各門所占比例相對較小(圖4)。

圖4 鰣淀不同采樣點浮游植物的豐度與生物量Fig.4 Abundance and biomass of phytoplankton at different sampling sites in Shihoudian Sub-lake
2.4 浮游植物與環境因子的關系
除趨勢對應分析結果顯示,排序軸第1軸長度為1.1,因此采用冗余分析進行優勢種與環境因子的相關性分析。經過前選和蒙特卡羅檢驗,透明度、總溶解固體、電導率和pH為影響白洋淀草型淀區沉水植物暴發期浮游植物空間分布最主要的環境因子(圖5)。前兩軸的特征值分別為0.21和0.11,蒙特卡羅檢驗分析表明,排序軸特征值具有顯著性。第1軸和第2軸分別解釋了20.77%和10.64%的物種環境變量。其中總溶解固體、電導率和pH主要貢獻于第1軸,透明度主要貢獻于第2軸。
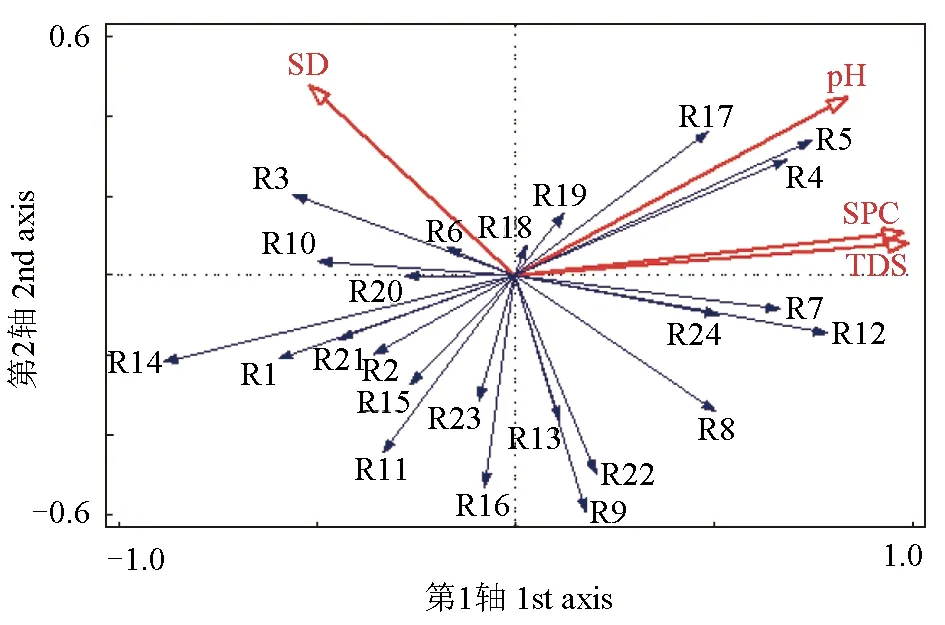
圖5 浮游植物優勢種與環境因子的冗余分析排序Fig.5 Redundancy analysis ordination diagram showing relationships between phytoplankton dominant species and environmental factors圖中優勢種代號與表2相同; pH.酸堿度; TDS.總溶解固體; SPC.電導率; SD.透明度.The code of the dominant species in the figure is the same as that in Tab.2; TDS.total dissolved solid; SPC.conductivity; SD.transparency.
2.5 浮游植物多樣性指數及水質評價
3 討 論
3.1 沉水植物暴發期浮游植物群落特征
沉水植物作為水生態系統的主要初級生產者,是維持水體生物多樣性的基礎[19]。然而,沉水植物蓋度過高或過低均可能不利于水體的生態健康。目前國內對低沉水植被蓋度下浮游植物的群落特征研究較多[20-21]。與白洋淀同時期藻型淀區相比,草型淀區鰣淀浮游植物表現出以下特征:(1)夏季草型淀區鰣淀浮游植物種類組成以藍藻門和綠藻門為主,與藻型淀區夏季浮游植物群落組成一致,但浮游植物種類數(68種)顯著高于藻型淀區(端村)浮游植物種類數(17種)[2,22];(2)鰣淀豐度明顯低于2010年7月白洋淀藻型淀區(端村)豐度10.67×107個/L[2,23];(3)鰣淀浮游植物多樣性指數平均值為3.23,2009年6月藻型淀區(端村)浮游植物為0.93,鰣淀草型淀區水質較好[2,22]。產生這種現象的原因可能是:在淺水湖泊中,沉水植物和浮游植物存在競爭關系[24]。一方面沉水植物通過化感作用影響浮游植物的生長發育[24]。另一方面,沉水植物通過枝葉遮擋光照、競爭營養鹽和生存空間,進而抑制浮游植物生長[25]。同時,端村為養殖區,在餌料和魚類糞便等污染源的作用下,端村浮游植物豐度高于鰣淀,但水質更差,種類數更少。
就不同采樣點而言,浮游植物種類數、豐度和生物量的最低值均出現在S1采樣點;同時,處于湖心采樣點的浮游植物種類、豐度和生物量均處于較高水平。這與吳天浩等[20]對洪澤湖浮游植物群落的調查結果不同。分析其原因可能是:S1采樣點位于近岸淺水區域,春季更有利于沉水植物穗狀狐尾藻和篦齒眼子菜的萌發和生長,大量沉水植物導致近岸處營養鹽水平較低,浮游植物豐度和生物量也處于較低水平。而洪澤湖屬于大型過水型湖泊,水體流速快,近岸區域沉水植物蓋度較低,浮游植物密度相對較高[20]。本次調查中,不同采樣點植被蓋度對浮游植物種類數、豐度和生物量并無顯著影響,主要因為除了S1~S3采樣點之外,其他采樣點之間沉水植物蓋度差異不大(圖2),導致蓋度對浮游植物種類數、豐度和生物量等指標影響不顯著。
優勢種和優勢度是衡量湖泊生態系統穩定性的重要指標,通常優勢種越多、優勢度越低、浮游植物分布越均勻的水體浮游植物群落結構越穩定[21]。本調查中,共檢測到優勢種24種,優勢度為0.02~0.66;81.25%的采樣點優勢種僅有7~10種,出現率超過85%的優勢種僅有澤絲藻、中華尖頭藻和色球藻等3種(表2)。總體來看,單個采樣點浮游植物優勢種數處于較低水平。分析其原因主要是:草型淀區沉水植物的過度生長,占據較多的生存空間,排擠其他水生生物,降低了浮游植物的優勢度[6,26-27]。本調查中,沉水植物暴發期(夏季)浮游植物以綠藻和藍藻為優勢門類,這與白洋淀2009年夏季歷史數據[28]一致。與白洋淀2009年4月沉水植物非暴發期(春季)數據相比,硅藻也是春季浮游植物的主要優勢門類之一,且春季浮游植物豐度顯著高于夏季沉水植物暴發期。其主要原因可能是:夏季溫度高,有利于藍藻和綠藻生長繁殖,而硅藻更適合在較低溫度下生存[29];另一方面,夏季大量沉水植物和浮游植物在營養鹽、光照、生存空間等方面的競爭也會限制浮游植物的生長繁殖。
3.2 沉水植物暴發期浮游植物群落與環境因子的關系
大量研究表明,浮游植物的群落結構受水溫、水深、營養鹽、透明度和pH等環境因子的影響[30-31]。本調查結果顯示,透明度、總溶解固體、電導率和pH是影響鰣淀浮游植物群落結構的主要環境因子(圖5)。與歷史資料相比,2013年影響鰣淀浮游植物群落結構的主要影響因子為pH和總磷[32]。孟睿等[33]對長江中下游草型湖泊(保安湖、斧頭湖、龍感湖和梁子湖)浮游植物的研究也得到了同樣的結果。分析其原因可能是:在2013年之前,鰣淀主要作為養殖水域,餌料過剩、魚類擾動和沉積物再懸浮導致水體營養鹽含量過高,使總磷成為影響鰣淀浮游植物群落的主要環境因子。近年來,隨著鰣淀沉水植被的恢復,水體的氮、磷等營養鹽含量降低,因此營養鹽不再是主要影響因子。
3.3 鰣淀水質評價
基于浮游植物的水質生物學評價方法較多[34-36]。本次調查選擇廣泛使用的多樣性指數法對鰣淀水質進行評價[37]。香農—維納多樣性指數計算結果顯示,鰣淀處于β中污型—輕度染污型。本調查中,總體來看,鰣淀水質處于輕度污染向β中污染過渡的狀態。與白洋淀其他淀泊相比,鰣淀污染程度明顯低于其他淀泊。對一些藻型淀區或草藻過度型淀區的評價結果顯示,其健康狀況多為中度污染或重度污染[2]。形成這種現象的原因可能是:鰣淀相對獨立,受入淀水質和周邊淀區影響較小。淀區內圍網的拆除和水產養殖的取締也減少了對沉水植物生長的不利影響。此外,冬春季節鰣淀水位較低、水下光照充足,適合沉水植物萌發,淀內沉水植物優勢種菹草和穗狀狐尾藻、篦齒眼子菜季節演替明顯,使不同季節水體均保持較高的植被蓋度,有效吸收了大量的營養鹽。
此外,筆者僅調查了草型淀區沉水植物暴發期的浮游植物群落結構,未反映出沉水植物從萌發至消亡整個生命周期中浮游植物群落結構的變化規律,在以后的研究中仍需進一步完善,從而為草型淀區的生態修復提供系統的理論依據。
3.4 研究展望
本研究充分利用浮游植物群落與環境因子的響應關系,對白洋淀草型淀區沉水植物暴發期浮游植物群落組成結構和生物量進行分析,研究結果表明,白洋淀草型淀區沉水植物暴發期水質呈β中污型—輕度污染型,符合近年來鰣淀由養殖區轉化為凈水區的現狀[32],進一步證明了運用浮游植物群落特征判別湖泊污染狀況的可行性。近年來,治理湖泊主要從源頭控制、過程控制、末端治理的角度,運用物理和生物的方法降低湖泊水體中營養鹽,抑制浮游植物、沉水植物過度生長[38-39]。目前,在湖泊治理過程中外源控制已經取得初步成效,但解決湖泊底層營養鹽積累的行之有效的方案很少。疏浚等方式雖然能在一定程度上降低底層營養物含量,但存在短時間內水體水質急劇惡化的風險,同時需面臨大量處理沉積物的后續工作[40]。因此,優化湖泊治理技術,打破湖泊底層營養積累,將湖泊底層營養物質資源化利用,以促進湖泊生態系統物質循環和能量流動,將是一個有意義的研究方向。
4 結 論
經冗余分析,透明度、溶解性固體總量、電導率和pH是決定沉水植物暴發期浮游植物空間分布最主要的環境因子;沉水植物暴發期浮游植物以綠藻和藍藻為主要優勢類群;香農—維納多樣性指數表明鰣淀水質為β中污型—輕度污染型。

