基于群體感應研究苦丁茶多酚對熒光假單胞菌腐敗特性的抑制作用
于淑池,邢文君,馮紫藍,梁宇晴,楊 波,徐小雄,裴志勝
(海南熱帶海洋學院,食品科學與工程學院,海南三亞 572022)
群體感應(quorum sensing,QS)是細菌之間信息交流的一種機制,細菌通過自身合成并釋放信號分子(autoinducer,AI)來感知環境變化,當信號分子濃度積累到閾值時,便會與細菌體內特異性受體相結合,從而啟動腐敗相關基因表達,調控細菌生物被膜的形成、胞外酶的分泌、致腐因子產生及細菌運動等腐敗特性[1]。群體感應抑制劑(quorum sensing inhibitors,QSIs)是以細菌群體感應系統為靶點,干擾或抑制腐敗菌的生物被膜形成和致腐基因表達,且對細菌正常生命活動不造成破壞[2],不會導致細菌耐藥性的形成,具有良好的生態安全性和環境友好性;QSI 主要包括天然來源和人工合成兩類[3];從食品安全的角度考慮,天然來源QSI 具有毒副作用小或幾乎無毒[4]、成本低廉、便于合成、安全性較高等特點[1],而逐漸成為研究熱點。
中草藥和藥食同源植物中發現大量具有 QSI 活性的天然物質[5],苦丁茶來源為冬青科植物大葉冬青的葉,主要產于我國南部及西南部地區,具有2000多年的飲用歷史,也是傳統的藥用植物,苦丁茶多酚主要包括兒茶素類、黃酮類、黃酮醇類、酚酸類等成分[6];具有較強的抗氧化活性,同時還具有降血壓、降脂、抗菌消炎等功效[7];現有文獻報道顯示,茶多酚(tea polyphenols, TP)是茶葉中多酚類物質的總稱,是天然抗氧化劑,同時具有廣譜抗菌性,對有細胞壁和無細胞壁的革蘭氏陰性、陽性菌均有良好的抑制作用[8],在各種食品的保鮮應用中已經非常廣泛[9],但作為群體感應抑制劑研究應用報道較少,黃旭鎮[10]研究發現茶多酚作為一種天然來源的QSI,最小抑菌濃度和亞抑菌濃度下可以阻斷腐敗希瓦氏菌群體感應系統,降低其致腐能力;劉五高等[11]發現茶多酚與常用抗菌藥物聯用對多重耐藥肺炎克雷伯菌具有協同殺菌作用,干擾其生物膜形成和胞外黏液樣物質的產生;丹皮提取物與茶多酚復合作為群體感應抑制劑[12],具有協同保鮮效果,可以減緩冷藏大菱鲆魚塊的腐敗變質速率。苦丁茶多酚作為群體感應抑制劑,抑制水產品腐敗菌熒光假單胞菌(Pseudomonas fluorescens)群體感應及腐敗特性的研究還未見報道。
本實驗室前期研究從0 ℃貯藏的卵形鯧鲹魚肉中分離鑒定出一株優勢腐敗菌熒光假單胞菌(P.fluorescens)[13],研究表明,P. fluorescens是一種典型的革蘭氏陰性腐敗菌,廣泛存在于生魚、肉類、乳制品及新鮮蔬菜中[14],是引起低溫條件下高蛋白和高脂肪食品腐敗變質的優勢腐敗菌[15]。本文以報告菌株紫色桿菌(Chromobacterium violaceum)CV026 為檢測模型,以苦丁茶多酚作為群體感應抑制劑,測定苦丁茶多酚對CV026 的群體感應抑制活性;以熒光假單胞菌(Pseudomonas fluorescens)為目標菌株,探究亞抑菌濃度下苦丁茶多酚對熒光假單胞菌群體感應特性的抑制作用;以期拓寬苦丁茶多酚的應用范圍,為植物源新型群體感應抑制劑研究開發提供理論基礎。
1 材料與方法
1.1 材料與儀器
苦丁茶 購于三亞市勝利路旺豪超市;報告菌株紫色桿菌(Chromobacterium violaceum)CV026購于北京百歐博偉生物技術有限公司;目標菌株熒光假單胞菌(Pseudomonas fluorescens) 自冷藏卵形鯧鲹分離得到,被鑒定為冷藏卵形鯧鲹的特定腐敗菌,保存于實驗室;無水乙醇、乙酸、氯化鈉、乙酸乙酯、結晶氯化鋁、氯化鋅、甲醇、葡萄糖 均為分析純,西隴科學股份有限公司;胰蛋白胨、蛋白胨、牛肉膏 北京奧博星生物技術有限責任公司;瓊脂粉、卡那霉素、堿性蛋白酶試劑盒 索萊寶生物科技有限公司;酵母粉 廣東一品鮮生物科技有限公司;脂肪酶檢測試劑盒 南京建成生物工程研究所;N-己酰基-L-高絲氨酸內酯標準品(C6-HSL) Sigma 公司。
SHB-B95 循環水式多用真空泵 鄭州長城科工貿有限公司;Multifuge XIR 高速冷凍離心機ThermoFisher 有限公司;RE-52 旋轉蒸發器 上海亞榮生化儀器廠;LT-DBX120F 精密可編程熱風循環烘箱 立德泰勀(上海)科學儀器有限公司;T6 新世紀紫外可見分光光度計 北京普析通用儀器有限公司;HWS-26 超級恒溫水浴鍋 金壇市盛藍儀器制造有限公司;全自動菌落計數儀 杭州迅數科技有限公司;歐諾新一代智能搖床 天津歐諾儀器股份有限公司;TECAN Infinice M NANO 酶標儀 勒菲生物科技上海有限公司;SQ510C 高壓蒸汽滅菌鍋 重慶雅馬拓科技有限公司;SW-CJ-1FD 潔凈工作臺 蘇州安泰空氣技術有限公司;BM2000 光學顯微鏡 南京江南永新光學有限公司。
1.2 實驗方法
1.2.1 苦丁茶多酚的制備 苦丁茶多酚的制備參照潘妍霓等[16]的方法并略有改動,稱取100 g 苦丁茶粉末加入250 mL 的 45%乙醇溶液,90 ℃水浴浸提25 min,重復2 次后合并浸提液,調pH 至6.0,加入AlCl3(6 g)、ZnCl2(12 g)混合進行沉淀,混合液離心(3000 r/min,10 min)取沉淀,加入12%鹽酸200 mL 將沉淀轉溶,抽濾后得上清液,400 mL 乙酸乙酯分2 次加入進行萃取,將萃取液進行旋轉蒸發(真空度0.07 MPa,60 ℃)濃縮,進一步干燥得到苦丁茶多酚干物質20.3 g,以45%乙醇溶解,配成20 mg/mL母液,4 ℃冷藏備用,使用前經0.22 μm 微孔濾膜過濾除菌。
1.2.2 苦丁茶多酚對熒光假單胞菌的抑菌活性及最小抑菌濃度(MIC)測定
1.2.2.1 苦丁茶多酚對熒光假單胞菌的抑菌活性測定 參照牛慧超等[17]的方法并略有改動。熒光假單胞菌于28 ℃,160 r/min 搖床振蕩培養過夜活化后,按2%比例接種于LB 肉湯(酵母提取物5 g/L,胰蛋白胨10 g/L,NaCl 10 g/L,pH7.2~7.4,121 ℃滅菌30 min,固體LB 培養基加入瓊脂20 g/L)中,繼續培養至菌體密度OD600nm約為0.4,吸取菌液100 μL,均勻涂布于LB 瓊脂培養基,牛津杯打孔,每孔加入50 μL不同濃度(2、10、20 mg/mL)苦丁茶多酚,以45%乙醇為空白對照。28 ℃培養靜置24 h,觀察苦丁茶多酚對熒光假單胞菌的生長抑制情況。
1.2.2.2 苦丁茶多酚對紫色桿菌和熒光假單胞菌最小抑菌濃度(minimum inhibitory concentration,MIC)的測定 采用平板涂布法[18]測定,將苦丁茶多酚母液二倍比稀釋成6 個濃度,紫色桿菌、熒光假單胞菌最小抑菌濃度測定的濃度選擇分別是0.263、0.525、1.05、2.1、4.2、8.4 mg/mL 以及0.375、0.75、1.5、3.0、6.0、12.0 mg/mL,分別吸取2 mL 苦丁茶多酚溶液加入到無菌平皿內,每皿再倒入18 mL 已滅菌的LB 瓊脂培養基,混勻,冷卻凝固后,于平板中央分別加入100 μL 過夜活化的熒光假單胞菌菌液,涂布均勻,28 ℃倒置培養24 h,觀察菌的生長情況,以完全沒有菌生長的最低濃度為苦丁茶多酚的最低抑菌濃度(MIC),每個濃度重復操作3 次。
1.2.3 苦丁茶多酚的群體感應抑制活性檢測 參照李晴等[19]的方法并稍作改進,將?80 ℃保存的報告菌株紫色桿菌CV026 接種于LB 肉湯,28 ℃、160 r/min條件下搖床振蕩過夜培養,以2%接入量接種于10 mL含有10 μg/mL 卡那霉素的LB 肉湯中,搖床培養16 h 后,吸取1 mL 菌液與100 mL 冷卻至40 ℃左右LB 半固體培養基混勻,倒平板。待凝固后用牛津杯打孔,分別加入 100 μL 亞抑菌濃度(0.5、1. 0、1.5和 2. 0 mg/mL)的苦丁茶多酚(均含有20 μg/mL C6-HSL),以只加入100 μL 20 μg/mL C6-HSL 為陽性對照,28 ℃靜置培養 1~2 d,觀察紫色菌素的產生情況。
1.2.4 苦丁茶多酚對紫色菌素產生及紫色桿菌生長的影響 參照文獻[1]的方法,將過夜活化的紫色桿菌CV026,以1:100(體積比)的比例接種于LB 肉湯中,加入苦丁茶多酚,使其終濃度分別為0.5、1.0、1.5和2.0 mg /mL,并添加20 μg/mL 的信號分子C6-HSL,搖床振蕩培養(28 ℃、160 r /min)至OD595nm為1 左右,依次取300 μL 添加信號分子菌液于1.5 mL 無菌離心管中,加入150 μL 10%十二烷基硫酸鈉,室溫下渦旋振蕩5 s,靜置5 min,加入600 μL飽和正丁醇(正丁醇50 mL 與蒸餾水10 mL),渦旋振蕩8 s,離心(10000 r /min,5 min),取含有紫色色素上清液200 μL 加入96 孔板中,測定OD595nm,以未添加苦丁茶多酚的液體培養基為空白對照。以空白對照組的OD595nm為100%,計算苦丁茶多酚各處理組的紫色菌素生成抑制率,計算公式為:
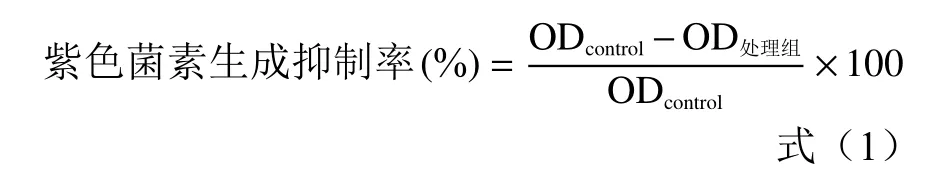
同時為測定苦丁茶多酚對報告菌株CV026 生長的影響,以不加信號分子的實驗組作為對照,其余步驟同上,相同條件下培養,測定紫色桿菌CV026 生長情況。
1.2.5 苦丁茶多酚對熒光假單胞菌生長曲線的影響測定 參照王虹懿等[2]的方法,取活化好的熒光假單胞菌,按2%比例接種于LB 肉湯中,加入苦丁茶多酚,使其在培養基中的終濃度分別為0.5、1.0、1.5、2.0 mg/mL,設置未添加苦丁茶多酚的液體培養基作為對照組,于28 ℃、200 r/min 搖床振蕩培養,每隔1 h 測1 次各組 OD600nm值,以培養時間為橫坐標,OD600nm值為縱坐標,繪制生長曲線。
1.2.6 苦丁茶多酚在亞抑菌濃度下對熒光假單胞菌腐敗特性的影響
1.2.6.1 苦丁茶多酚對熒光假單胞菌蛋白酶活性的影響 配置脫脂牛奶平板[2],15%的脫脂乳粉用純水溶解后單獨滅菌(115 ℃,30 min),取10 mL 脫脂乳與90 mL 含0.85%瓊脂的LB 半固態營養培養基混合均勻,傾注到水瓊脂平板中,蛋白酶活性定性檢測參照文獻[20]的方法,培養基凝固后用牛津杯打孔,加入過夜培養的含有不同濃度(0.5、1.0、1.5、2.0 mg/mL)苦丁茶多酚的熒光假單胞菌菌液100 μL,28 ℃ 靜置培養24 h,以不加苦丁茶多酚的菌液為空白對照,每個處理3 個平行,觀察并測量其水解圈直徑。
蛋白酶活性定量檢測采用堿性蛋白酶活性檢測試劑盒進行,將上述步驟中過夜培養的含有不同濃度(0.5、1.0、1.5、2.0 mg/mL)苦丁茶多酚的熒光假單胞菌菌液,離心(4 ℃,10000 r/min,10 min)后取上清液,并用0.22 μm 無菌濾膜過濾除菌,根據堿性蛋白酶活性檢測試劑盒說明書進行操作,測定680 nm 處吸光度,計算蛋白酶活性,公式如下:
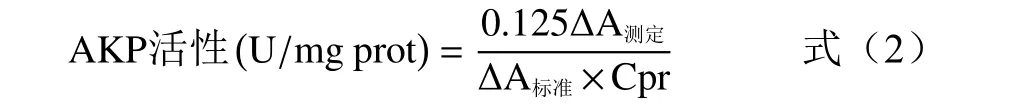
式中:?A測定=A測定管?A對照管;?A標準=A標準管?A空白管;Cpr 為樣液蛋白質濃度,mg/mL。
1.2.6.2 苦丁茶多酚對熒光假單胞菌脂肪酶活性的影響 將含有不同濃度(0.5、1.0、1.5、2.0 mg/mL)苦丁茶多酚過夜培養的熒光假單胞菌菌液分別于4 ℃,10000 r/min 離心10 min,取上清液并用0.22 μm無菌濾膜過濾除菌備用。根據脂肪酶測定試劑盒說明書進行操作,測定420 nm 處吸光度,計算脂肪酶活性,公式如下:

式中: A1為第一次吸光度值;A2為第二次吸光度值;AS為標準吸光度。
1.2.6.3 苦丁茶多酚對熒光假單胞菌生物被膜形成量的影響 采用酶標法[17],將過夜活化的熒光假單胞菌,按1%的比例接種于LB 肉湯中,分裝至無菌離心管,每管1 mL,加入苦丁茶多酚使其終濃度為0.5、1.0、1.5 和 2.0 mg/mL,以無菌去離子水為對照,每組3 次重復,28 ℃靜置培養48 h,測定菌液密度后,傾倒菌液,無菌水清洗3 次后,無菌風干燥30 min,采用0.1%(W/V)結晶紫溶液染色15 min,倒去染液用無菌水沖洗5 次,加入33%冰醋酸1 mL 充分溶解,取200 μL 于96 孔板中,用酶標儀在波長595 nm處測定OD 值。按下列公式計算生物被膜形成率:
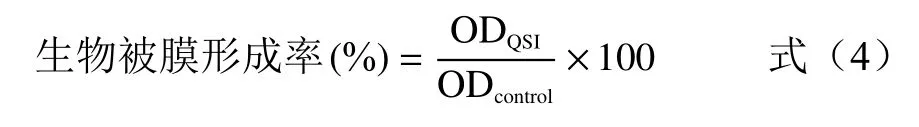
式中:ODcontrol為對照組測得生物被膜的OD595nm值;ODQSI為抑制劑處理組的OD595nm值。
1.2.6.4 苦丁茶多酚對熒光假單胞菌生物被膜生成的影響 參照文獻[1],將載玻片于無水乙醇和去離子水中分別超聲處理30 min,烘干滅菌備用。將過夜活化的熒光假單胞菌,按1%的比例接種于LB 肉湯培養基中,吸取10 mL 熒光假單胞菌菌液加入無菌培養皿中,再加入一定量的苦丁茶多酚,使其終濃度分別為0.5、1.0、1.5、2.0 mg/mL,將處理好的載玻片浸在其中,28 ℃培養72 h,同時以不添加苦丁茶多酚為空白對照組。培養完成后取出載玻片,先用無菌水清洗3 次,加入適量甲醇固定15 min,2% 結晶紫染色5 min,無菌水沖洗6 次,無菌風干燥固定,采用光學顯微鏡(油鏡)觀察生物膜的生成情況。
1.2.6.5 苦丁茶多酚對熒光假單胞菌群集性和泳動性的影響 參考文獻[21]的方法配制群集瓊脂培養基(1%蛋白胨、0.5%葡萄糖、0.5%氯化鈉、0.5%瓊脂)和泳動瓊脂培養基(1%胰蛋白胨、0.5%瓊脂、0.3%氯化鈉),將不同濃度的苦丁茶多酚經0.22 μm的微孔濾膜過濾除菌后,分別與冷卻到40 ℃左右的群集、泳動培養基混勻后倒平板,使苦丁茶多酚的終濃度分別為0.5、1.0、1.5、2.0 mg/mL,以未添加苦丁茶多酚的培養基作為空白對照組,待培養基冷卻后,向平板中央加入過夜活化的熒光假單胞菌菌液5 μL,無菌風吹干,28 ℃培養24 h,觀察菌株的遷移情況,并測量群集、泳動平板中,熒光假單胞菌的群集或泳動直徑,根據測得的直徑值,進一步計算群集、泳動面積并作圖。
1.3 數據處理
采用Excel 處理實驗數據及繪圖,組間數據差異顯著性采用SSPS17.0 進行ANOVA 方差分析,顯著性水平設為P<0.05。
2 結果與分析
2.1 苦丁茶多酚的抑菌活性及最小抑菌濃度的測定
抑菌活性可通過抑菌圈的大小初步反映[22]。采用牛津杯打孔法測定苦丁茶多酚的抑菌活性,結果見圖1。
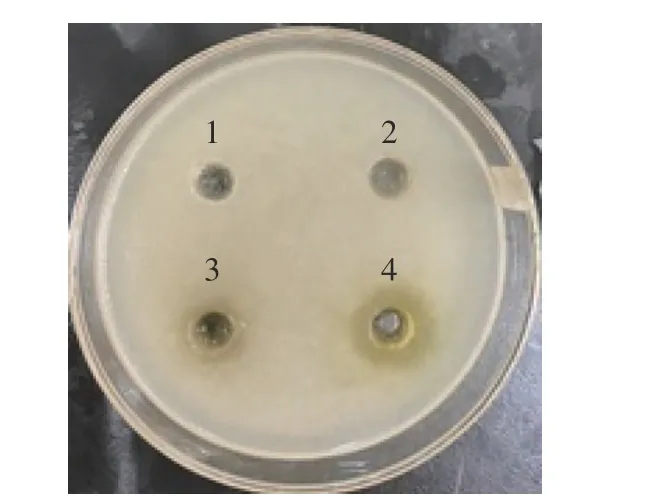
圖1 苦丁茶多酚對熒光假單胞菌的抑菌效果Fig.1 Inhibitory effect of Kuding tea polyphenols on P.fluorescens
由圖1 可知,對照組(圖1-1)及低濃度苦丁茶多酚(圖1-2)沒有抑菌圈產生,說明其對熒光假單胞菌的生長未產生影響;隨著苦丁茶多酚濃度的升高,抑菌作用逐漸顯現,10、20 mg/mL(圖1-3、1-4)苦丁茶多酚處理組的抑菌圈直徑分別為8.58 mm 和13.66mm,說明較高濃度的苦丁茶多酚對熒光假單胞菌的生長具有明顯抑制作用,在所選擇的濃度范圍內,抑菌活性與濃度呈正相關。
最小抑菌濃度(MIC)可用于定量表示抑菌劑的抑菌性能。因此,后續苦丁茶多酚對紫色桿菌和熒光假單胞菌的最小抑菌濃度測定,采用1.2.2.2 中設定的濃度范圍展開,采用平板涂布法經過24 h 靜置培養后,觀察所取濃度范圍內菌株的生長情況,發現2.1、3.0 mg/mL 的苦丁茶多酚剛好完全抑制紫色桿菌和熒光假單胞菌的生長,因此確定苦丁茶多酚對紫色桿菌、熒光假單胞菌的最小抑菌濃度(MIC)為2.1、3.0 mg/mL,為了保證后續各實驗的效果不是由苦丁茶多酚的抑菌作用引起,后續實驗選取苦丁茶多酚的亞抑菌濃度進行,即選擇0.5、1.0、1.5、2.0 mg/mL 4 個濃度。
2.2 苦丁茶多酚的群體感應活性測定
紫色桿菌(Chnomobacterium violaceum)CV026報告菌株是野生菌株Chromobacterium violaceumATCC 31532 的mini-Tn5 突變體,具有卡那霉素抗性,其本身不產生紫色菌素,也不產生N-酰基高絲氨酸內酯類信號分子(AHLs),但當有外源信號分子AHLs 存在時,能感知其存在[23],并產生紫色素;紫色桿菌CV026 紫色素的產生受細菌群體感應調控,而群體感應抑制劑會抑制其紫色素的產生。采用報告平板法測定苦丁茶多酚對報告菌株CV026 紫色素產生的影響,結果見圖2。
圖2 顯示,平板中添加C6-HSL 信號分子處理組(圖2-1),孔徑周圍出現明顯的紫色,表明紫色桿菌CV026 感知到C6-HSL 信號分子存在并產生了紫色菌素;添加苦丁茶多酚的孔徑(圖2-2~5)周圍紫色逐漸減少,隨著苦丁茶多酚濃度的提高,顏色逐漸變淡,抑制作用呈劑量依賴性,說明苦丁茶多酚抑制了紫色桿菌的群體感應系統,降低了紫色素的產生。
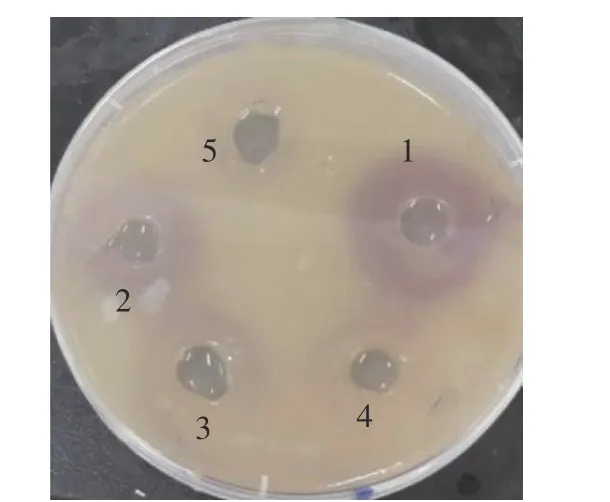
圖2 苦丁茶多酚對紫色桿菌CV026 紫色素產生的抑制作用Fig.2 Inhibitory effects of Kuding tea polyphenols on violacein production of C. violaceum CV026
采用酶標法測定對照組及苦丁茶多酚各處理組紫色菌素生成量,根據公式(1)計算紫色菌素生成抑制率;同時測定紫色桿菌菌液密度,以確定苦丁茶多酚對紫色桿菌生長的影響,結果見圖3。
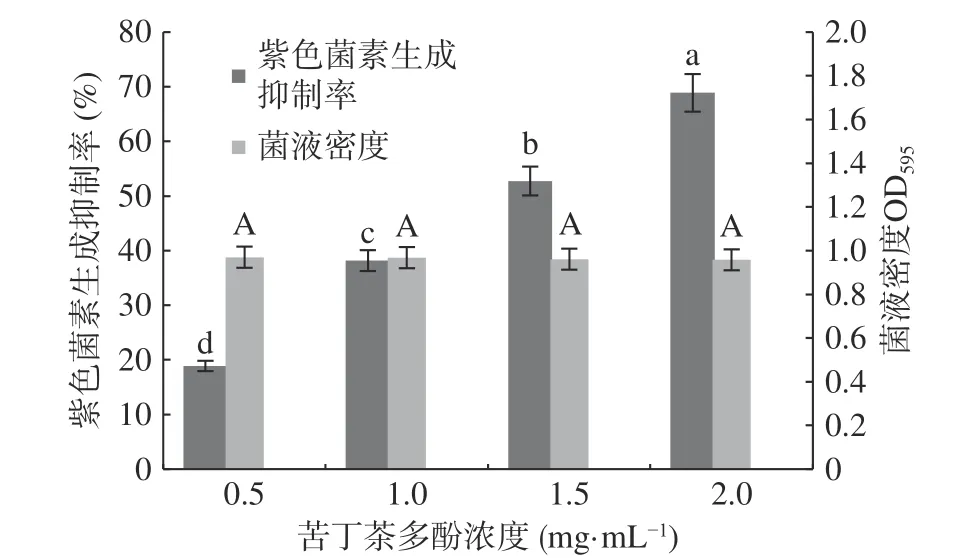
圖3 苦丁茶多酚對紫色桿菌CV026 菌落密度和紫色菌素生成抑制率的影響Fig.3 Effects of Kuding tea polyphenols on bacteria concentration and inhibitory rate of production of mycetin of C.violaceum CV026
圖3 顯示,亞抑菌濃度下,各處理組菌液密度值比較接近,表明苦丁茶多酚對紫色桿菌CV026 生長不產生影響(P>0.05);隨著苦丁茶多酚濃度的升高,紫色桿菌色素生成抑制率逐漸升高,當苦丁茶多酚濃度為2.0 mg/mL 時,紫色菌素產量僅為對照產量的31.11%(P<0.05),抑制率達到68.89%。說明苦丁茶多酚在不影響菌株正常生長條件下,對紫色桿菌群體感應系統具有抑制作用。
2.3 苦丁茶多酚對熒光假單胞菌生長曲線的影響
亞抑菌濃度下,苦丁茶多酚處理組對熒光假單胞菌的生長曲線影響情況見圖4。
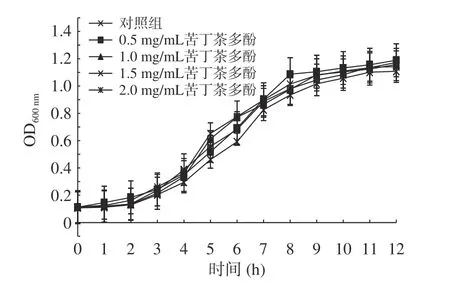
圖4 苦丁茶多酚對熒光假單胞菌生長曲線的影響Fig.4 Effects of Kuding tea polyphenols on the growth of P.fluorescens
由圖4 可知,亞抑菌濃度下的苦丁茶多酚處理12 h,各組P.fluorescens的生長曲線與對照組生長趨勢基本一致,0~2 h 為熒光假單胞菌的生長調整期,細菌密度基本變化不大,2 h 后開始進入對數生長期,細菌進行快速地生長,對照組和0.5、1.0 mg/mL 苦丁茶多酚處理組的生長速度較快。到12 h 時生長曲線已逐漸趨于穩定,對照組和添加0.5、1.0 mg/mL苦丁茶多酚處理組的OD600nm值分別為1.17、1.18、1.15,菌株生長水平整體變化不明顯;但2.0 mg/mL苦丁茶多酚處理組的生長速度相較之下稍慢,在12 h時菌體密度OD600nm值為1.11。說明隨著苦丁茶多酚濃度的升高,菌株活力逐漸受到抑制,細菌生長速度稍微下降,但總體變化趨勢區別不大(P>0.05),苦丁茶多酚對菌株的生長水平影響不明顯。
2.4 苦丁茶多酚對熒光假單胞菌胞外蛋白酶活性的影響
腐敗細菌在脫脂牛奶平板生長過程中,通過分泌胞外蛋白酶,水解牛奶中的酪蛋白,形成明顯的透明圈,蛋白酶水解活性的高低可以通過觀察透明圈的大小來判斷[24]。熒光假單胞菌可分泌胞外蛋白酶水解水產品中蛋白質及游離氨基酸,產生腐敗代謝產物,使水產品腐敗變質[25]。由圖5 可知,未添加苦丁茶多酚的對照組(圖5-1)水解圈最大,為9.41 mm,經苦丁茶多酚處理后蛋白酶水解圈直徑逐漸明顯減小,0.5、1.0、1.5、2.0 mg/mL 苦丁茶多酚處理組的蛋白酶水解圈直徑分別為5.07、3.77、3.63、3.25 mm(圖5-2、3、4、5),水解圈直徑與苦丁茶多酚濃度呈負相關,說明亞抑制濃度的苦丁茶多酚抑制了熒光假單胞菌的胞外蛋白酶活性。群體感應抑制劑能夠抑制腐敗菌胞外蛋白酶活性,相關研究報道較多[1,2,17,19]。P. fluorescens是水產品中主要的蛋白分解菌,具有產生高活性蛋白水解酶的能力[26],該過程是由QS 現象調控的[24],崔方超等[27]研究認為,熒光假單胞菌胞外蛋白酶分泌活性受酰基高絲氨酸內酯類信號分子介導的QS 系統調控。為定量確定苦丁茶多酚抑制熒光假單胞菌胞外蛋白水解酶分泌能力,進一步采用堿性蛋白酶檢測試劑盒定量測定了苦丁茶多酚對P.fluorescens蛋白酶活性的影響,按公式(2)計算蛋白酶活性,結果見圖6。

圖5 苦丁茶多酚對熒光假單胞菌胞外蛋白酶活性的影響Fig.5 Effects of Kuding tea polyphenols on extracellular protease activity of P. fluorescens
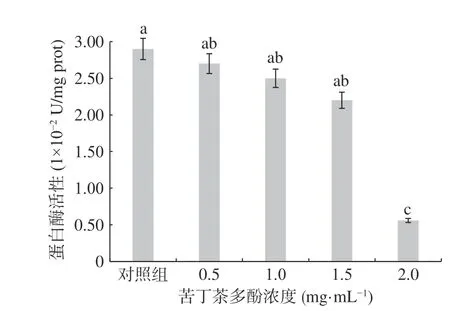
圖6 苦丁茶多酚對熒光假單胞菌蛋白酶活性的影響Fig.6 Effects of Kuding tea polyphenols on extracellular protease activity of P. fluorescens
由圖6 可知,對照組熒光假單胞菌蛋白酶活性最高,蛋白酶活性達到2.9×10-2U/mg prot,隨著苦丁茶多酚濃度的升高,蛋白酶活性逐漸降低。苦丁茶多酚濃度為2.0 mg/mL 時,蛋白酶活性為0.56×10?2U/mg prot,與對照相比其相對抑制率達到80.68%,差異顯著(P< 0.05)。表明苦丁茶多酚對熒光假單胞菌的蛋白酶活性具有抑制作用。這與綠原酸[2]、花椒提取物[19]等對P. fluorescen蛋白水解酶活性的抑制作用測定結果相似,只是研究中發現P. fluorescens蛋白酶活性普遍偏低,可能與所用培養基或培養條件等因素影響相關。
2.5 苦丁茶多酚對熒光假單胞菌脂肪酶活性影響
肉制品腐敗菌通過產生脂肪酶降解肌肉組織,將甘油三酯降解為甘油或脂肪酸,從而改變肌肉組織導致腐敗發生[2]。按公式(3)計算脂肪酶活性,結果見圖7。
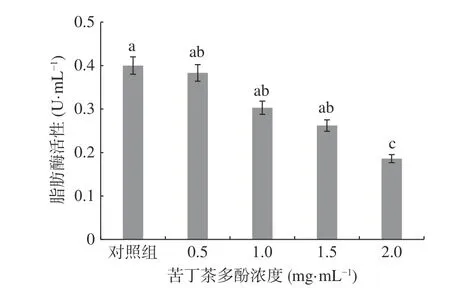
圖7 苦丁茶多酚對熒光假單胞菌胞外脂肪酶活性的影響Fig.7 Effects of Kuding tea polyphenols on extracellular lipase activity of P. fluorescens
圖7 顯示,對照組的脂肪酶活性最高,為0.4 U/mL,處理組隨著苦丁茶多酚濃度的增加,熒光假單胞菌的脂肪酶活性逐漸降低,苦丁茶多酚濃度為2.0 mg/mL時,脂肪酶活性為0.186 U/mL,與對照相比其相對抑制率達到53.50%,差異顯著(P<0.05)。說明苦丁茶多酚能抑制熒光假單胞菌胞外脂肪酶的活性,且濃度越高,抑制能力越強,研究結果與綠原酸對P. fluorescens脂肪酶活性抑制作用相似[2]。
2.6 苦丁茶多酚對熒光假單胞菌生物被膜形成的影響
在外界環境條件不利的情況下,細菌相互粘連并將其自身克隆聚集纏繞于自身的分泌物以及崩解物中,形成的膜樣物為生物被膜(biofilm,BF)[28],其廣泛存在于食品加工設備表面,不易清理,對食品容易造成污染[29],苦丁茶多酚對生物膜形成抑制作用的定量測定,按公式(4)計算生物膜形成率,結果見圖8。
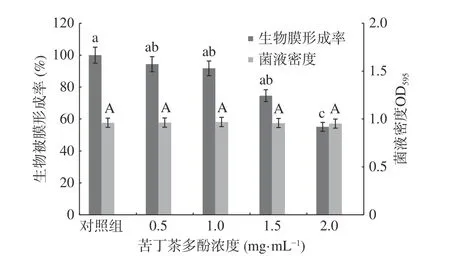
圖8 苦丁茶多酚對熒光假單胞菌的菌液密度和生物被膜形成的影響Fig.8 Effects of Kuding tea polyphenols on bacteria concentration and biofilm formation of P. fluorescens
圖8 顯示,各組菌液密度值都接近,差異不顯著(P>0.05),說明苦丁茶多酚對熒光假單胞菌的生長不產生影響;對照組的生物被膜形成率為100%,0.5 mg/mL 苦丁茶多酚處理組的生物被膜形成率為94.36%;當苦丁茶多酚的濃度為2.0 mg/mL 時,生物被膜的形成率僅為55.10%,抑制率達到44.90%。苦丁茶多酚能夠明顯抑制熒光假單胞菌生物被膜的形成,且濃度與生物被膜形成率呈負相關,說明苦丁茶多酚對熒光假單胞菌的生長無影響,在其菌液密度基本一致的情況下,苦丁茶多酚可以抑制其生物被膜的形成,圖9 為苦丁茶多酚對熒光假單胞菌生物被膜形態的影響顯微鏡觀察結果圖。

圖9 苦丁茶多酚對熒光假單胞菌生物被膜形態影響的光學顯微鏡圖(100×)Fig.9 Effects of Kuding tea polyphenols on biofilm of P. fluorescens under optical microscope(100×)
由圖9 可見,對照組(圖9-1)的菌體成大片聚集膜狀,比較致密,外凸,能夠牢固粘附在載玻片表面,生物膜形成較成熟;處理組(圖9-2~5)的生物膜細胞密度、細胞團塊的大小隨著苦丁茶多酚濃度的升高而降低,0.5 mg/mL 苦丁茶多酚處理組的菌體生物膜產生空隙,呈薄片的網狀分布,形成稀疏的小菌落粘附在載玻片表面,1.0 mg/mL 以上苦丁茶多酚處理組的生物膜形態逐漸被破壞,呈稀疏狀分散,顏色逐漸變淺,菌體膜狀物逐漸稀疏,單個分布呈分散狀在載玻片上。說明苦丁茶多酚對熒光假單胞菌生物膜的形成有抑制作用,能夠減少并阻止生物膜的形成。顯微鏡觀察結果與生物被膜形成定量測定結果相吻合。茶多酚通過干擾細菌群體感應中信號分子的合成從而影響細菌成膜能力[9],對細胞膜形成起到了抑制作用,茶多酚對肺炎克雷伯菌的生物膜形成也具有類似抑制作用。其機制可能與細菌的群體感應作用有關,本研究也進一步證實了茶多酚的這種抑制機制。推測苦丁茶多酚具有干擾P. fluorescens粘附于接觸面的能力,可以通過調控熒光假單胞菌的群體感應活性來調控其生物被膜的生成。
2.7 苦丁茶多酚對熒光假單胞菌群集性與泳動性的影響
群集和泳動是細菌通過鞭毛介導的的兩種遷移方式,主要指細菌在大于0.45%或小于0.45%的瓊脂培養基表面遷移[30]。圖10 為亞抑菌濃度下苦丁茶多酚對熒光假單胞菌群集與泳動性的抑制效果圖。
圖10 顯示,熒光假單胞菌在群集及泳動平板表面培養24 h 后,有向外遷移的趨勢,對照組(圖10A-1、B-1)遷移能力最強,苦丁茶多酚處理組隨著濃度的升高,遷移擴散直徑逐漸減小,表明苦丁茶多酚能有效地抑制熒光假單胞菌的群集和泳動能力,抑制活性與質量濃度存在劑量依賴性,這與孫曉佳等[1]及陳桂芳[31]研究結果相似。說明苦丁茶多酚能夠調控熒光假單胞菌的遷移(群集和泳動),從而干擾了鞭毛吸附于附著物的能力[32],進而抑制其致腐能力。
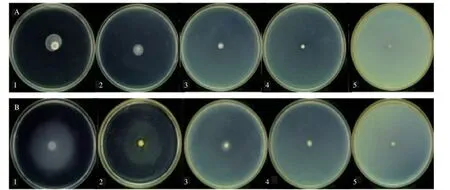
圖10 苦丁茶多酚對熒光假單胞菌群集(A)、泳動性(B)的影響Fig.10 Effects of Kuding Tea polyphenols on swarming(A)and swimming(B)of P. fluorescens
圖11 為苦丁茶多酚對熒光假單胞菌運動區面積和直徑的影響結果。從圖11 可以看出,隨著苦丁茶多酚的濃度增加,P. fluorescens遷移受到了一定的抑制,群集及泳動的直徑及面積與對照相比,均明顯減弱,苦丁茶多酚濃度超過1.0 mg/mL 時,減小趨勢顯著(P<0.05);當質量濃度為2.0 mg/mL 時,苦丁茶多酚對熒光假單胞菌群集和泳動(直徑)的抑制率分別達到79.56%和90.12%。
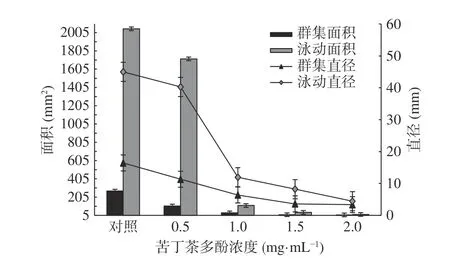
圖11 苦丁茶多酚對熒光假單胞菌運動區面積和直徑的影響Fig.11 Effects of Kuding tea polyphenolson diameter and area of the motility zone of P. fluorescens
泳動有利于細菌生物膜的形成以及細菌在宿主表面的黏附聚集[19]。細菌遷移運動在生物被膜形成過程中具有極其重要的作用[1,32],苦丁茶多酚對P.fluorescens群集、泳動的抑制作用結果,與上述抑制生物膜形成的結果可以互相驗證。
單寧含量豐富的草莓可以通過抑制P.aeruginosa的群體感應系統來干擾其遷移能力[21]。TP 是茶葉中多酚類物質的總稱,又叫茶單寧或茶鞣質,主要包括黃烷醇類(兒茶素)、黃酮類、黃酮醇類、花色苷類、酚酸類等成分,特別是兒茶素含量達60%~80%[33],占茶葉干重的30%~40%[34]。黃旭鎮[10]研究認為,茶多酚通過其主要成分兒茶素類化合物,調控腐敗希瓦氏菌QS 的形成及腐敗指標。苦丁茶多酚中黃烷醇類也是主要成分,黃烷醇類物質中又以兒茶素類物質為主[12]。推測苦丁茶多酚的群體感應活性與其多酚中兒茶素成分更相關。曾亮等[35]研究發現,兒茶素25~80 ℃時抑菌效果最好,熱穩定性高,且活性不受溫度的影響,在酸性條件下更穩定。本研究所制備的苦丁茶多酚與曾亮等的研究報道相似,提取溫度高達90 ℃,同時制備過程中,用強酸轉溶,60 ℃烘箱干燥,活性依然保持,顯示出苦丁茶多酚良好的熱穩定性及酸穩定性,揭示苦丁茶多酚作為群體感應抑制劑具有良好的應用前景。
3 結論
以紫色桿菌CV026 為報告菌株,通過添加外源信號分子,證明了苦丁茶多酚在亞抑菌濃度下,對細菌生長不產生影響,能夠顯著抑制細菌的群體感應活性,抑制CV026 紫色菌素的產生,苦丁茶多酚濃度為2.0 mg/mL 時,紫色菌素生成抑制率達到68.89%;在該濃度下,對熒光假單胞菌胞外蛋白酶活性抑制率為80.68%,脂肪酶活性抑制率53.50%,生物被膜形成抑制率44.90%,群集和泳動能力的抑制率分別達到79.56%和90.12%;抑制作用具有濃度依賴性,制備過程中發現苦丁茶多酚具有較好的熱穩定性及酸穩定性,研究結果可以為其天然群體感應抑制劑的開發應用奠定理論基礎。

