基于證據的化學項目式學習
李奕霖 吳曉紅
摘要:基于證據的項目式學習是在項目進行的各個環節要有證據支撐,學生根據證據提出問題猜想、設計探究方案,并產生新證據支撐最終成果的得出。以初識人體緩沖機制為例,提供信息證據等引導學生從認識人體血液pH穩定原因到深入認識緩沖機制,熟練運用水溶液中離子平衡知識解決實際問題,體會生命中的化學,同時培養證據意識。
關鍵詞:項目式學習;證據意識;緩沖溶液;離子平衡
文章編號:1008-0546(2021)03-0037-03 中圖分類號:G632.41 文獻標識碼:B
doi:10.3969/j.issn.1008-0546.2021.03.008
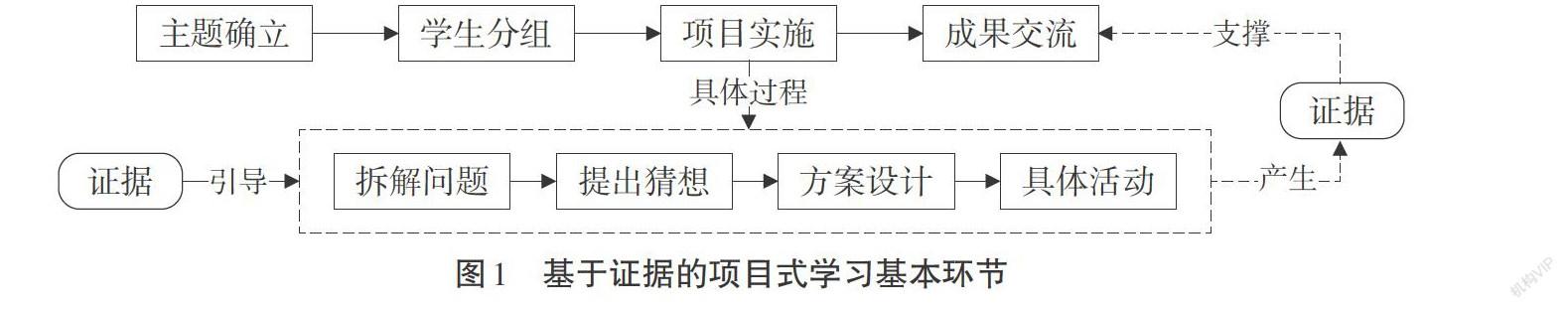
基于證據的化學項目式學習是指在項目式學習實施過程中通過證據引導學生完成系列環節并最終得到一定成果[1]。其進程分為主題確立、學生分組、項目實施、成果交流四步。在項目實施過程中,學生首先將主題問題拆解成一個個小問題并依據證據提出合理的猜想;其次,進一步收集證據設計探究方案并進行有理有據的探究;在實施的過程中產生證據為最終項目成果的得出作支撐,如圖1所示。將證據貫穿項目實施始終,讓學生在學習知識的同時形成證據意識,培養證據推理與模型認知等化學學科核心素養。
一、項目簡介
正常人的血液pH相對恒定,維持在7.34~7.45。然而,在正常情況下人體代謝會不斷產生酸或堿,它們進入血液中并未引起pH明顯的變化。究其原因,是由于血液中存在以HZCO3~HCO3-為主的緩沖體系。定性分析,以H2CO3~HCO3-為例,緩沖溶液作用的機制是水溶液中離子平衡(H2CO3H++HCO3-,HCO3-+H2OH2CO3+OH-)無論H+還是OH-的介入都會引起兩個平衡移動來抵抗外界酸堿的作用[2]。定量分析,根據三段式進行緩沖體系pH計算公式推導,發現pH與緩沖體系共軛酸堿的濃度比有關,而與H+或OH-濃度無關。緩沖機制對于學生而言是一個較新的概念,但所用知識卻是舊知,有利于提高學生對復習課的興趣。同時該主題內容既幫助學生復習并應用離子平衡的原理,又涉及運用三段式、平衡常數相關知識進行數學推導,對該章節重點內容涵蓋較全面,因此具有較好的教學價值。
在本項目中,教師以偽科學“酸堿體質”理論為導入引導學生根據日常生活中的證據推翻它,并繼而提出主題問題“為什么人體血液pH能維持相對穩定”?然后將該問題拆解成三個小問題并形成子項目,分別是尋我維持血液pH穩定的因素、驗證這些因素發揮作用的原理、理論上深度探析該原理。在子項目1中教師提供人體血氣分析部分指標供學生形成證據,推理出血液pH穩定的因素與CO2和HCO3-有關。在子項目2中,學生設計實驗證實保持pH不變的機制與溶液中離子平衡有關,并分析教師提供的人體代謝性酸堿中毒一般治療方案,形成又一證據支撐相關結論。最后,在子項目3中教師根據學生前面的探究提出緩沖體系的概念,引導學生利用三段式進行緩沖體系pH計算公式的推導。以公式為證據分析得出緩沖體系pH與H+或OH-濃度無關,并將公式應用到血液pH計算中,結果與事實相符,首尾呼應。每一子項目中學生以已有知識為證據對問題進行合理的猜想,教師為學生探究與推理提供一定的信息,供學生分析并形成證據。
二、項目目標
(1)學會從已有的知識經驗中搜集并利用證據,能利用證據解決問題,形成證據意識,落實證據推理核心素養;
(2)掌握科學探究的一般過程和規律,學會根據證據進行問題的猜想、科學的探究、結論的獲得;
(3)能結合微粒觀、平衡觀解釋人體血液維持穩定的原因,并認識緩沖作用,體會化學知識在生命健康中的重要性。
三、項目實施
1.項目背景
【背景情境】“酸堿體質”理論(通過食用蘇打水等堿性食物、藥品使血液越來越偏堿性,成為堿性體質從而利于健康)被不少養生達人奉為真理,大量的保健品也基于此誕生。就在近期,這套理論終于被“官宣”偽科學。美國圣地亞哥法庭判一個叫做羅伯特·歐·陽的人賠償一名癌癥患者1.05億美元。而這位羅伯特·歐·陽就是“酸堿體質”理論的創始人。如果你們是癌癥患者的律師,會如何反駁這套偽科學理論?
【學生】該理論是不成立的。(反駁的證據:①根據已學生物知識可知人體八大平衡之一是酸堿平衡,會自動調節酸堿平衡,使血液pH正常維持在7.34~7.45。②根據生活經驗,正常人日常攝人食物既有酸性的、也有堿性的,并未影響到人體血液酸堿性改變。)
【提出問題】為什么人體血液pH能夠維持穩定?
2.項目拆解
(1)子項目1:解讀人體血氣分析表
【拆解問題1]從血液環境中探尋影響血液酸堿性的因素。
【學生猜想】血液中含有一定的粒子造成血液偏堿性并保持pH穩定(猜想的證據:根據已有生物和化學知識,人體內液體由水及其溶解在水中的無機鹽、有機物一起構成,統稱為體液。血漿屬于體液之一,類似于水溶液,pH是其重要的理化參數。溶液酸堿性取決于H+和OH-的濃度,電解質的電離,一些陰陽離子的水解都會產生H+或OH-。)。
【解決方案】參考資料了解血液環境中與pH相關的因素以及酸堿平衡紊亂后相關影響因素的變化。
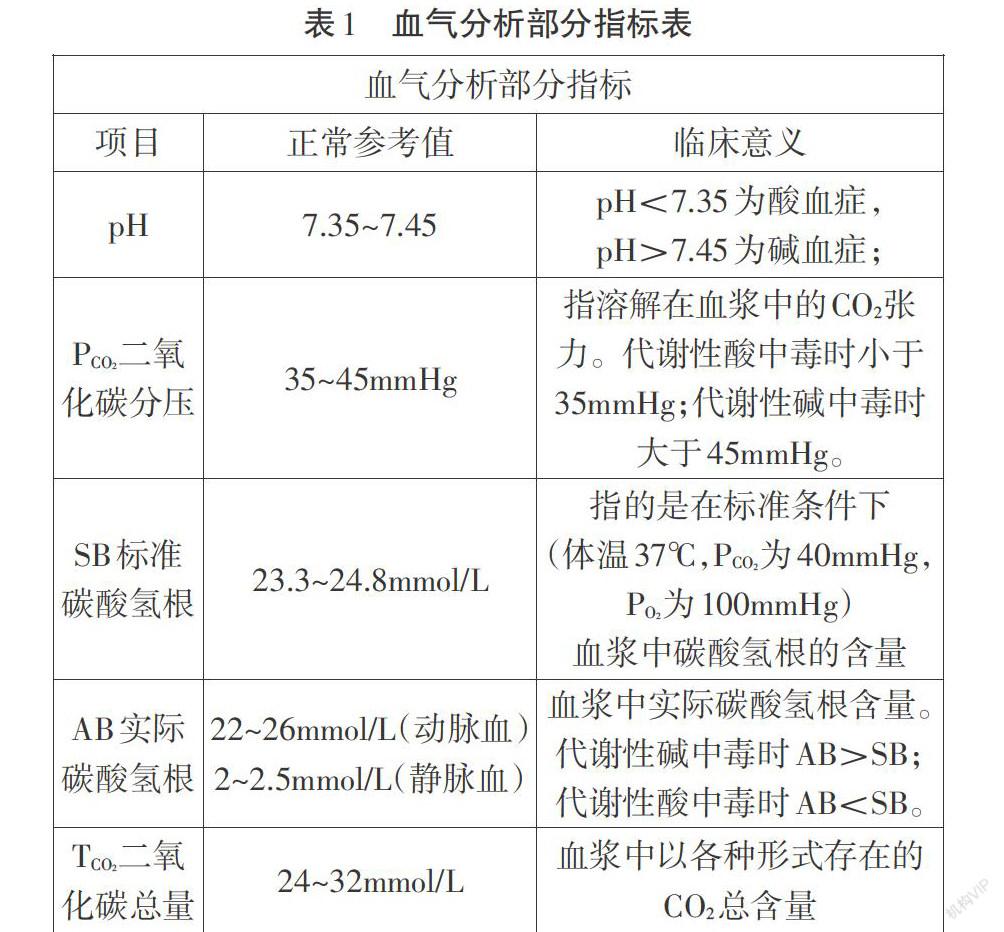
【具體探究】教師提供相關資料,人體血氣分析部分指標說明,如表1。學生小組分析討論,歸納由表格可發現的信息并作為證據繼而得出初步結論[3]。
【結論展示】(1)血液呈現弱堿性是由于碳酸氫根的存在。(支撐的證據:通過血氣分析表知,血液中含有一定量的HCO3-;根據已有的水溶液中離子平衡知識知HCO3-水解(HCO3+H2O=H2CO3+OH-)會產生少量OH-。)(2)血液pH是CO2與HCO3-洪同影響的結果。(支撐的證據:根據血氣分析表可知代謝性酸(堿)中毒會打破血液pH穩定,除了體現在pH不在正常參考范圍內,同時也伴隨PCO2,AB發生變化。)
(2)子項目2:探析血液pH穩定原因
【拆解問題2】CO2與HCO3-是如何具體影響血液pH穩定。
【猜想】CO2與HCO3-之間存在的平衡關系維持血液pH穩定(猜想的證據:根據已有的離子平衡知識,CO2溶于水生成HZCO3,H2CO3電離會產生HCO3-,HCO3-水解也會生成H2CO3。這對平衡中產生H+和OH-影響著pH)。
【驗證方案】思路1:營造體外含有H2CO3與HCO3-的溶液環境,添加少量外界酸堿,以及稀釋,驗證溶液pH不變。(設計的證據:較可能真實地模擬體內血液要探究的環境)
思路2:用其他弱酸及對應的鹽代替H2CO3與HCO3-,如HAc與NaAc,營造溶液環境,添加少量外界酸堿,以及稀釋,驗證溶液pH不變。(替代的證據:根據已有知識,HAc與NaAc同樣存在著電離與水解的平衡關系且HAc易保存。本探究驗證的是H2CO3與HCO3-的作用機制對維持溶液pH有效而非粒子本身,因而找具有相同作用機制的粒子進行替代。)
【具體探究】教師提供實驗藥品和儀器,藥品有0.9%的NaCl溶液、HAc、NaAc、稀鹽酸、NaOH溶液、NaHCO3溶液、甲基橙、酚酞、紫色石蕊溶液等;儀器有錐形瓶、小燒杯、玻璃棒、量筒,pH試紙、pH計等。學生進行實驗,驗證實驗組和對照組中有外界酸堿加入后酸堿性的變化。
【資料卡片】對于一般代謝性酸中毒,常用的治療方法是補充NaHCO3堿性藥物。對于代謝性堿中毒,有循環血容量不足的病人,先快速輸人右旋糖酐70鹽水注射液,恢復有效循環血容量,然后輸生理鹽水補足細胞外液容量,以減少遠端腎曲小管的以H+換Na+,發揮腎臟排出HCO3-的功能;對于心力衰竭、肝硬化的病人可服抑制碳酸配酶利尿劑,減少H+排出,增加K+與Na+交換,減少HCO3-回收,增加HCO3-排出。(教師為學生認識人體中H2CO3~HCO3-通過平衡移動維持血液pH穩定提供事實證據)
【結論展示】在血液中CO2溶解生成H2CO3,H2CO3的電離與其對應的鹽中微粒 HCO3-的水解維持著平衡狀態,外界酸堿介入時會促進平衡移動消耗多余的H+或OH-,從而保持血液pH穩定。(支撐的證據:在探究實驗中,實驗組pH在外界酸堿的少量干預下維持穩定。通過教師提供的資料卡片可知在醫學中,一般治療代謝性酸(堿)中毒,原理都是補充(排出)HCO3-,促進平衡的移動。)
(3)子項目3:認識緩沖溶液
【拆解問題3】理論深入認識作用機制。
【教師】講解緩沖作用以及緩沖溶液定義。
【學生】按照教師講解思路分析加少量堿后,緩沖溶液起作用的原理。認識到H2CO3與HCO3在血液中實際上形成了緩沖體系。
【小組活動】理論計算推導緩沖溶液pH。
設體系中原有的濃度H2CO3為a,HCO3-為b,加入少量外界酸時,增加的H+濃度為x根據三段式算得pH=-lgk1-lga/b[4]。
【結論】緩沖溶液的pH與緩沖對中弱酸電離常數以及緩沖對共扼酸堿濃度比有關,故當有少量外界的酸堿介入或者稀釋時,共扼酸堿濃度比基本不變從而保持溶液PH不變。(支撐的證據:推導的緩沖溶液pH計算公式)
【教師】提供信息37℃下,H2CO3電離常數是7.9×10-7;人體血漿中HCO3-是H2CO3含量的20倍;計算該溫度、配比下HCO3-~H2CO3溶液的pH。
【學生】根據推導公式計算pH=7.4,與血液pH在7.35~7.45相吻合。
【小組活動】討論配制緩沖溶液的注意事項及緩沖溶液的應用。
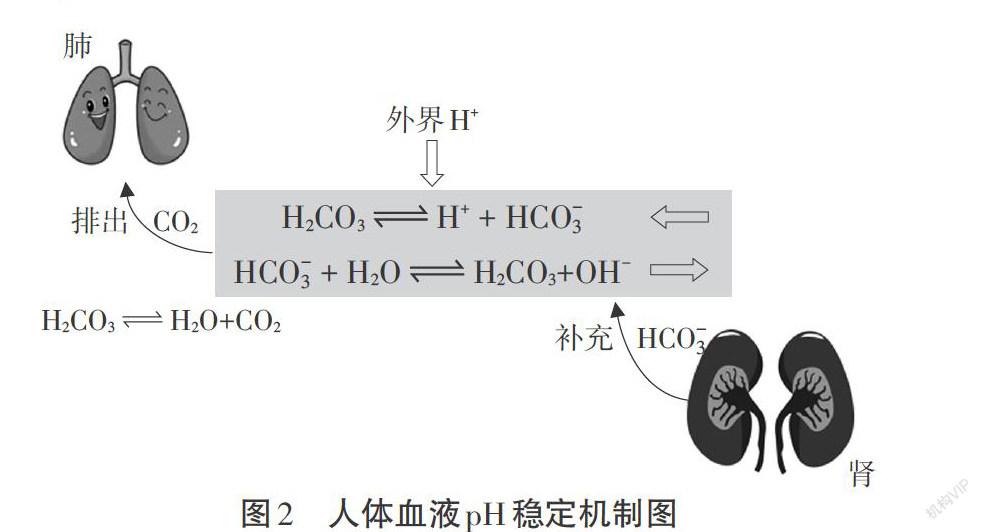
繪制H2CO3~HCO3-在人體中維持血液酸堿平衡的調節圖示。
【最終成果】展示人體血液維持穩定的作用機制圖,如圖2。
四、項目反思
本項目通過“人體血液pH為什么會維持穩定”這一核心問題驅動學生探究其原因,按照“尋找與問題相關的因素——驗證該因素的影響并分析因素作用的機制——上升高度認識原因背后的科學理論”的規律逐步認識緩沖機制,并將離子平衡相關知識得以回顧與運用。在知識層面,學生對緩沖機制的認識主要是通過自主探究的方式得到,更多的是內在動機驅動著學生,在項目探究中綜合離子平衡的相關知識包括弱電解質電離平衡、離子水解平衡、平衡常數的計算等,有利于學生對知識整合并綜合運用,提高理解與復習效果。在能力方面,該學習鍛煉學生人際交往、動手實踐等適應現代化社會生活的種種能力。同時項目活動各個環節基于證據進行,引導學生在解決問題中根據已有的經驗知識作為證據提出對問題的猜想,針對猜想搜集相關信息結合已有知識經驗作為證據進行合理的探究方案設計,在探究過程中產生的各種實驗現象、計算的理論結果等等篩選出有效的,形成證據支撐最終結論,讓整個過程有理有據,具有說服力。在這樣的一步步引導下,有利于學生證據意識的培養,在信息化時代中,養成搜集信息、獲取證據并科學推理的科學態度,打下終身學習的基礎。
參考文獻
[1]馬寧,趙若辰,張舒然.項目式學習:背景、類型與核心環節[J].中小學數字化教學,2018(5):24-27
[2]蘭婷,冀楠,王海波,秦向陽,何煒.化學教育醫用基礎化學緩沖溶液及其作用機制的教學設計與思考[J].化學教育(中英文),2020,41(10):67-70
[3]牛彩霞,鄒映波.基于項目式學習的“水溶液中的離子平衡”專題復習——以“人體代謝性酸中毒治療方案的設計”為例[J].化學教學,2020(6):53-58
[4]北京師范大學,華中師范大學,南京師范大學.無機化學(第四版)[M].北京:高等教育出版社,2003:310-312,323-329
*本文系國家自然科學基金地區科學基金項目“西北民族地區科學探究教育績效評價及影響因素研究”(項目批準號71663042)階段性研究成果。
**通訊聯系人,E-mail:wxhnxuedu@163.com

