H2O分子在Cu(110)和Ni(110)表面吸附與解離行為的理論研究
齊昶霖,侯雪捷,劉紹麗
(煙臺大學 化學化工學院,山東 煙臺 264005)
1 研究背景與意義
大多數暴露在大氣條件下的金屬表面都覆蓋著一層薄薄的水,水還涉及界面的許多物理和化學過程,包括電化學和光化學過程、多相催化中的表面反應、金屬腐蝕和環境科學等[1-3].其中,金屬腐蝕是金屬和周圍環境發生化學或電化學反應而導致的一種破壞性侵蝕,具有極大的破壞性,直接影響金屬構件的使用壽命,甚至造成嚴重的事故.因此,研究金屬腐蝕在分子層面上的反應機理,即水和金屬表面的相互作用,確定水分子和金屬反應的過程尤為重要.
在過去的報道中,人們已經使用傳統的表面科學技術對低溫下水的吸附和反應進行了大量研究.其中很多研究集中在Cu和Ni的低指數面上.之前的研究發現,在Ni(110)表面上,水以分子態形式吸附[4-6].Jacobi等[7]發現,H2O至少在前兩層顯示出層增長,且得出單層最大覆蓋率為 0.7 ML.Pangher等[8]研究表明,水分子在Ni表面吸附,通過氧端與表面鍵合,O—Ni鍵的鍵長為(2.06±0.03)?,且H—O—H平面相對于表面法線傾斜.實驗結果表明,水分子在c(2×2)結構中不形成團簇[8-11].最低溫度為 205 K 時,觀察到水發生部分解離[10].Benndort等[12]研究了基底幾何形狀及預先吸附的氧氣對Ni(110)表面H2O結構和反應性的影響.他們發現,在 80 K 時水以分子態吸附,而當T>200 K 時水會部分解離.熱脫附顯示了4個峰,分別是冰層形式的水脫附(T=155 K),多分子水簇的脫附(T=210 K),被OH穩定的水二聚體的脫附(T=245 K),以及由于OH歧化而引起的水脫附(T=360 K).預先覆蓋的氧氣有利于水的吸附和解離[4-6,12].Nakamura等[13]觀察到在Ni(110)表面,水單體或團簇分子在低至 150 K 的溫度下解離.在Ni(111)表面上,水單體(D2O)在低覆蓋率下位于Ni原子的頂部,而隨著覆蓋率的增加(0.03<θ<0.33),環狀六聚體的水團簇分子(D2O)6在表面生長.在T>165 K 時,吸附的水分子分解產生OD基團.
與Ni表面相同,許多實驗研究表明,在低溫下水以分子態形式吸附在Cu表面[14-17].而在Cu表面吸附的水分子是否解離存在巨大爭議.Spitzer等[18]研究表明,在Cu(110)表面,90 K 時水作為分子吸附,90~300 K 時H2O解離為O原子和OH基團.Polak等[19]也發現在190 K左右,Cu(110)表面吸附的水分子部分解離.但Bange等[20]和Lackey等[21]在 100 K 時沒有觀察到吸附水分子的解離.Ren等[22-23]研究了Cu(110)面上的水覆蓋層,結果發現單個水分子在頂位穩定吸附,Cu—O鍵長為2.18?.覆蓋度為 1 ML 時水分子可以形成冰雙層結構,H-down雙分子層比H-up雙分子層更穩定.他們還研究了Cu(110)表面上的半解離水覆蓋層,與未解離的水覆蓋層相比,吸附能增加,但功函也增加,說明水分子在Cu(110)表面更傾向于分子態吸附.在Cu(111)和Cu(100)面上,水單體通過氧端結合到Cu原子的頂部,且水分子平行于金屬表面,吸附較弱[24].Tang等[24]的DFT計算表明,水單體在Cu(111)和Cu(100)面上的吸附能(~20 kJ/mol)約為實驗值的一半(~40 kJ/mol)[14,25],這表明即使在低溫和低覆蓋度下,水分子也可能形成團簇.
盡管對于水和金屬表面相互作用已經進行了大量的理論和實驗研究,但對于水分子在不同表面上的解離機理并沒有詳細闡明,因此研究了水分子在Cu(110)和Ni(110)表面上的吸附與解離行為,確定了表面物種的穩定吸附構型,進一步比較了水的解離機理和吸附物種與表面的電荷轉移(CT).該研究結果為進一步理解和研究水與金屬表面之間的相互作用提供了有利的理論基礎.
2 計算方法與模型
所有的計算都是在從頭模擬程序包VASP中使用平面波贗勢方法完成的[26-27].使用自旋極化的廣義梯度近似和Perdew-Burke-Ernzerhof泛函(GGA-PBE)描述了交換能和相關能[28].過渡態的計算使用VASP軟件中的CI-NEB線性插值方法[29].當作用在原子上的力小于 0.01 eV/? 時,完成幾何優化.對于每個優化的固定點,均在相同的理論水平上進行振動分析,以確定其性質(能量極小點或鞍點).使用面心立方(fcc)晶胞優化晶格參數,并使用Monkhorst-Pack方法自動生成的15×15×15 k 點網格對它的倒易空間進行采樣[30].
對于Cu(110)和Ni(110)表面,使用真空區域寬度為10.0?的周期性平板,用3×3×1 Monkhorst-Pack k點采樣和 380 eV 的截斷能進行表面結構弛豫和總能量計算.使用(2×2)表面尺寸對周期表面進行建模.使用了4層模型,吸附物種及上面2層弛豫,而底部兩層固定.如圖1所示,Cu(110)面和Ni(110)面上可能的吸附位點為頂位(top,T),橋位(bridge,B),長橋位(long bridge,LB)和短橋位(short bridge,SB).
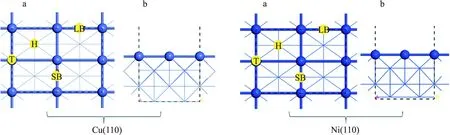
圖1 Cu(110)面和Ni(110)面的俯視圖(a),側視圖(b)及可能的吸附位
使用公式1計算吸附能,其中EX/slab是吸附體系的總能量,Eslab是清潔金屬表面的總能量,EX是氣相中游離吸附物的能量.因此,Eads越負,吸附越強.由于零點能對表面反應影響很小并且主要影響氣體分子,因此所報道的吸附能沒有考慮零點能的校正.
Eads=EX/slab-Eslab-EX.
(1)
根據公式2和3計算解離勢壘(Ea)和反應能(Er),其中EIS,ETS和EFS是相應的初始狀態(IS),過渡狀態(TS)和最終狀態(FS)的能量.
Ea=ETS-EIS.
(2)
Er=EFS-EIS.
(3)
3 結果與討論
3.1 表面物種H,O,OH和H2O的吸附
在Cu(110)和Ni(110)表面,首先考察表面物種H、O、OH、H2O在表面的穩定吸附位及吸附構型.表1列出了表面物種在不同吸附位點的吸附能,穩定吸附構型如圖2所示.
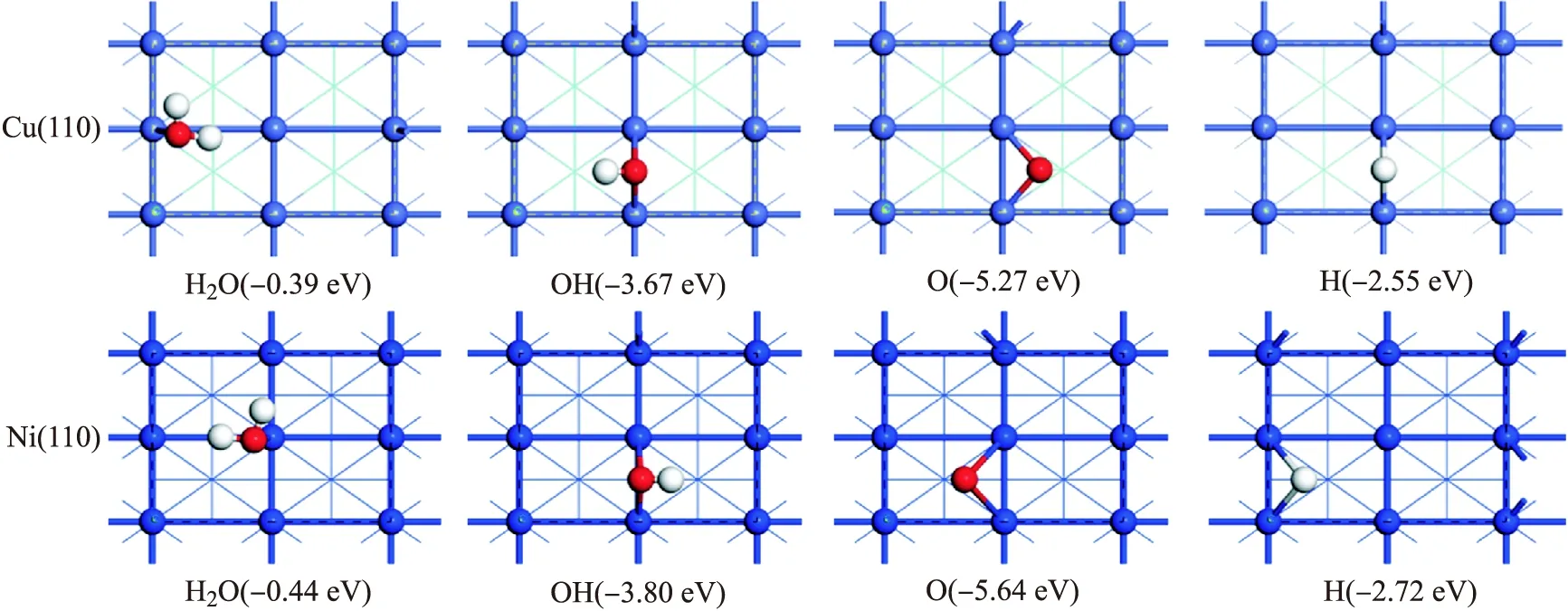
圖2 H2O,OH,O和H在Cu(110)面和Ni(110)面的穩定吸附構型及吸附能
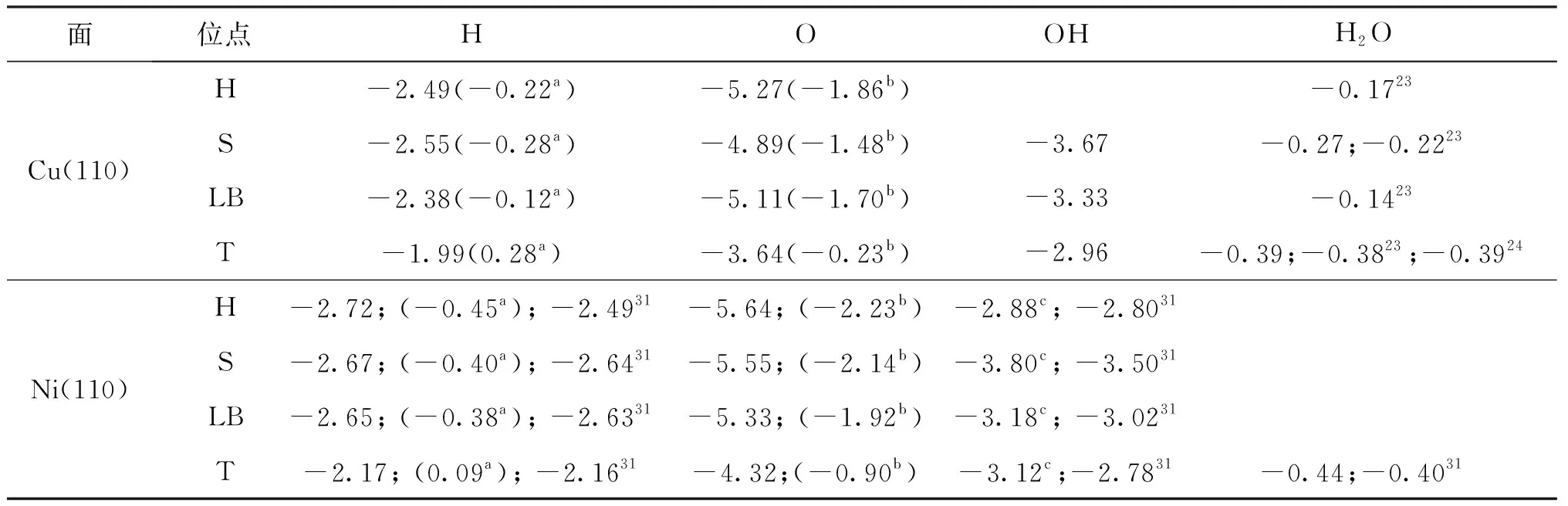
表1 表面物種在Cu(110)面和Ni(110)面上不同吸附位點的吸附能 eV
在Cu(110)表面,H原子在短橋位穩定吸附,吸附能為 -2.55 eV,Cu—H距離為1.651和1.651?.如表2所示,洞位和長橋位的H原子吸附能分別比短橋位少0.06和 0.17 eV.H原子在頂位吸附的吸附能為 -1.99 eV,遠小于短橋位,吸附穩定性相對較差.對于O原子,最穩定的吸附位為洞位,吸附能為 -5.27 eV,Cu—O距離為1.882、1.882、2.940和 2.940 ?.長橋位,短橋位和頂位的O原子吸附能分別比洞位少0.16,0.38和 1.63 eV.優化后的OH物種在短橋位穩定吸附,吸附能為 -3.67 eV,Cu—O距離為2.036和 2.036 ?,與表面的夾角為39.34°.OH物種在長橋位和頂位的吸附能比短橋位少0.34和 0.71 eV,吸附穩定性相對較差.洞位的OH物種優化后遷移到短橋位.最后,對于H2O分子的吸附,研究了所有高對稱吸附位點.優化后,H2O在頂位穩定吸附,吸附能為 -0.39 eV,Cu—O距離為 2.178 ?,與Cu(110)面平行.H2O分子在短橋位的吸附能為 -0.27 eV,吸附不穩定.這一結果與文獻[23-24]報道一致.
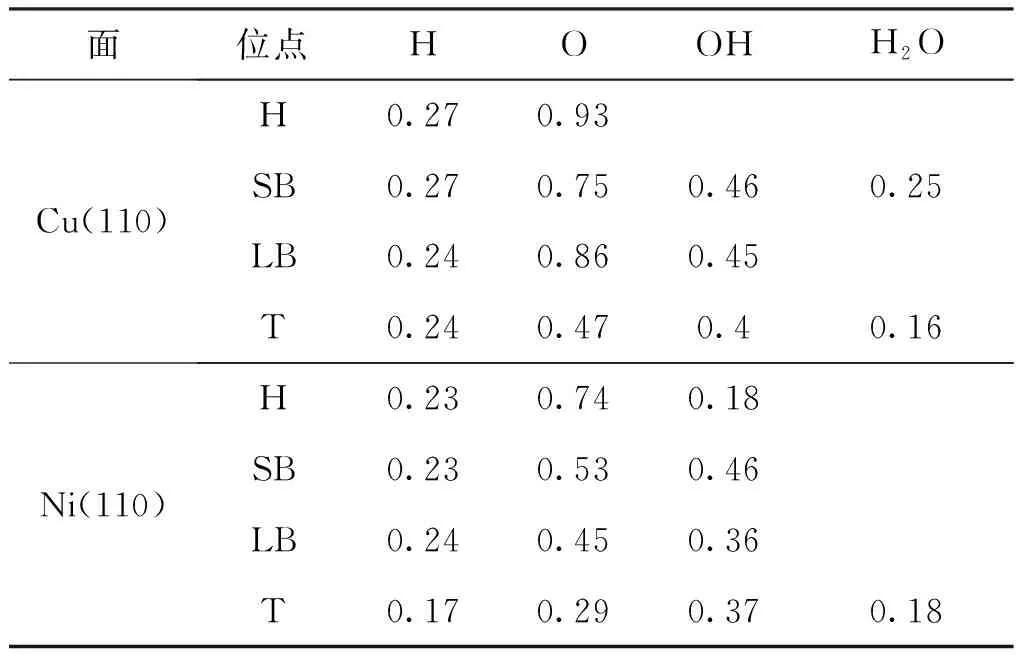
表2 Cu(110)和Ni(110)表面上的表面物種吸附前后的電荷轉移(CT/e)
在Ni(110)表面,H原子在接近洞位的位點穩定吸附,偏轉洞位上方,靠近短橋位,吸附能為 -2.72 eV,Ni—H鍵距離為1.699、1.702、1.803和1.805?.短橋位和長橋位的H原子吸附能分別比洞位少0.05和 0.07 eV.Seenivasan等[31]報道的H原子在短橋位穩定吸附,吸附能為 -2.64 eV,與長橋位的吸附能(-2.63 eV)相似.對于O原子,洞位(-5.64 eV)的吸附能大于短橋位(-5.55 eV),吸附更穩定.O原子在長橋位的吸附能為 -5.33 eV,該構型是O原子從一個洞位轉移到另一個洞位的過渡態,轉移的能壘為 0.31 eV.O原子在頂位的吸附能為 -4.32 eV,吸附穩定性相對較差.OH物種在短橋位穩定吸附,吸附能為 -3.80 eV,Ni—O距離為1.917和 1.919 ?,與表面的夾角為23.98°.OH物種在長橋位的吸附能為 -3.18 eV,與頂位的吸附能(-3.12 eV)相似,Ni—O距離為2.076和 2.077 ?,吸附穩定性相對較差.洞位的OH物種吸附能僅為 -2.88 eV,Ni—O距離為2.320、2.340、2.358、2.378 ?.與Cu(110)面類似,不同位點不同構型的H2O分子優化后在頂位穩定吸附,且平行于Ni(110)表面,吸附能為-0.44 eV,Ni—O鍵距離為 2.125 ?.這一結果與Seenivasan等[31]的報道一致.
上述結果表明,H2O分子以平行于表面的構型吸附在Cu和Ni表面原子的頂位.在緊密堆積的Cu、Ni的(111)面及(100)面上,H原子,O原子以及OH物種傾向于吸附在深洞位和洞位上[32-36].但在(110)面,由于金屬原子之間距離增加,OH物種更傾向于在短橋位吸附.表面物種在Ni(110)面的吸附能大于Cu(110)面,表明表面物種在Ni表面吸附更穩定.
表2中Bader電荷分析獲得的在吸附物和基底之間的電荷轉移的值表明,基底充當電子給體,而吸附物充當電子受體.在Cu和Ni的(110)表面上,電荷轉移按以下順序減少:O> OH> H,這與Cu和Ni的金屬特性和被吸附物的電負性有關.對于不同吸附位點的同種吸附物,電荷轉移的量與吸附穩定性的順序密切相關.對于OH和O,電荷轉移越多,吸附越穩定.
3.2 H2O分子的解離路徑
基于表面物種的最穩定吸附構型,我們計算了Cu(110)和Ni(110)表面上的H2O分子解離為OH,O和H的反應路徑.初始狀態(IS),過渡狀態(TS)和最終狀態(FS)的幾何構型如圖3所示.TS的反應能壘(Ea),反應熱(Er)和結構參數如表3所示.
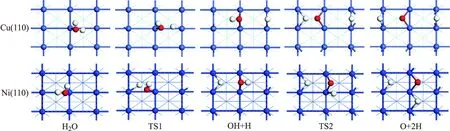
圖3 Cu(110)面和Ni(110)面上H2O解離反應穩定中間體的構型

表3 Cu(110)和Ni(110)表面上H2O解離反應的反應能壘(Ea, eV),反應熱(Er, eV)和斷裂的O—H鍵距離(dO-H,?)

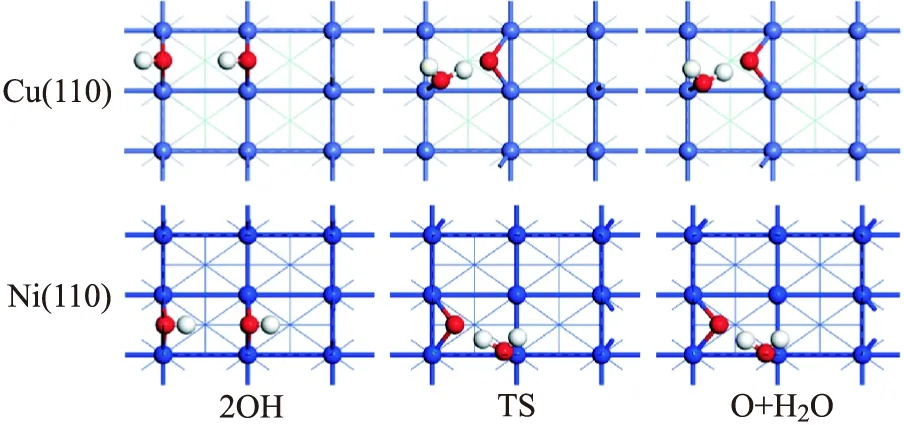
圖4 Cu(110)面和Ni(110)面上OH歧化反應穩定中間體的構型

4 結語
文中利用密度泛函理論方法研究了在Cu(110)和Ni(110)表面上H,O,OH和H2O的吸附以及H2O分子的解離反應.
在Cu(110)面上,H原子和OH物種在短橋位穩定吸附,O原子在洞位穩定吸附.在Ni(110)表面上,H原子和O原子在洞位穩定吸附,OH物種在短橋位穩定吸附.H2O分子以平行于表面的構型吸附在Cu和Ni的頂位.對于不同吸附位點的同種吸附物,電荷轉移的量與吸附穩定性有關.在Cu和Ni的(110)表面上,電荷轉移按以下順序減少:O> OH> H,這與Cu和Ni的金屬特性和被吸附物的電負性有關.
對于H2O的解離反應,H2O分子可以解離為OH+H,而OH繼續解離需要高的反應能壘,反應難以發生.OH歧化反應的反應能壘遠大于其逆反應,因此在Cu(110)和Ni(110)表面上,水分子的最終解離產物為OH和H.這些結果可以為進一步了解和研究水與金屬表面之間的相互作用提供有利的理論基礎.

