十二卷屬花卉糯玉露組培體系建立試驗初報
李曉 王婷婷 陳惠哲 廖智慧 于蘭芳 陳志軍

摘 要 以十二卷屬花卉糯玉露葉片、基部分株葉片、花序做為外植體,以MS為基本培養基,研究植物激素組合和濃度對其誘導分化、增殖培養、生根的影響,試圖建立起糯玉露組培快繁體系。結果表明,最佳外植體為其花序,其誘導率最高為74%;最佳增殖培養基為MS+0.7 mg·L-16-BA+0.1 ?mg·L-1NAA,增殖率為650%;最適的生根培養基為MS+0.3 mg·L-16-BA+0.3 mg·L-1NAA,平均生根數為5.36條,生根率為100.00%。
關鍵詞 十二卷屬;多肉植物;組織培養;快繁體系
中圖分類號:S682 文獻標志碼:B DOI:10.19415/j.cnki.1673-890x.2021.27.025
玉露(Hamworthia cooperi M. B. Bayer)為天門冬目阿福花科十二卷屬下的中小型、多年生多肉植物[1]。糯玉露作為栽培品種,植株矮小、緊湊扁平、葉片肉質、粗短飽滿、頂端半透明且窗型巨大,深受廣大消費者的喜愛。糯玉露生長周期長,自交不親和,種子繁殖困難,傳統采用分株繁殖和種子繁殖,繁殖系數低、擴繁速度慢,難以滿足龐大的市場需求。其他栽培品種,如“姬玉露”“冰燈玉露”“毛玉露”“帝玉露”及“宮燈玉露”等的組織培養已有報道,但是關于糯玉露的相關報道較少。
通過不同外植體的選擇、不同培養階段、不同激素的組合的研究,探索糯玉露組培與快繁體系,以滿足鄉村振興和農業供給側改革的技術需求。
1 材料與方法
1.1 實驗時間、地點和材料
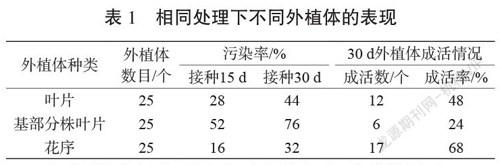
實驗在2020年7月開始,實驗地點在衡水職業技術學院花藝實訓室。供試材料來自衡水市鄧莊農業科技示范園溫室。選擇株型好、無病蟲害、生長健壯具有花序的糯玉露植株為母本,選取糯玉露葉片、基部分株葉片、花序3種器官組織作為外植體進行實驗。
1.2 實驗方法
1.2.1 培養材料的選擇與準備
將糯玉露整個植株從基部小心切下,在流水下沖洗20 min,無菌操作下,將葉片、基部分株葉片和花序從植株上切下,用75%酒精浸泡20 s,再用0.1%HgCl2進行10 min振蕩消毒處理,并在無菌培養皿中分割成適宜接種的小塊,然后用無菌水沖洗5次,將3種組織分別接種于MS培養基上,每個組織接種25瓶,每瓶1個外植體。接種后15 d統計外植體的污染率和成活率,分析外植體的最優選擇。
1.2.2 愈傷組織誘導培養
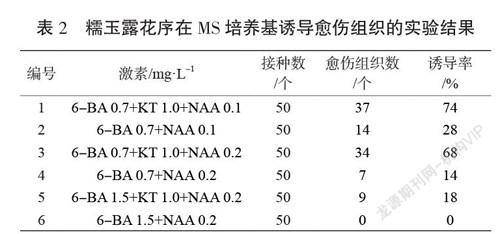
選取未污染的糯玉露愈傷組織,接種至1~6號培養基中(見表2),研究細胞分裂素(6-BA,KT)和生長素NAA對糯玉露誘導愈傷組織的影響。每個處理設置50個外植體開展實驗。接種15 d后觀察愈傷組織誘導情況,統計愈傷組織數目。
1.2.3 增殖培養
糯玉露花序在不同激素組合的培養基上進行愈傷組織誘導培養,15 d表現為花序一端開始膨大為愈傷組織;愈傷組織在形成后,繼續在原培養基中培養,20 d開始,表面上方或周圍出現綠色芽點,之后在突起處形成1~2個葉形不定芽,45 d時長成可分為3~10枝的叢生小苗。將誘導形成的不定芽取出并分割成單個芽苗,轉入7~12號6種培養基上進行增殖培養,分別統計數量。
1.2.4 生根培養
將增殖培養的叢生芽進行分割,選取較健壯的芽苗插入13~21號9種培養基中,置光照培養架上培養30 d,觀察不定根的生長情況。
1.2.5 培養條件及培養基
培養室條件為:溫度25(±2) ℃,濕度50%~
60%,照度2 500 lx,每天光照時間12 h[2];培養基除特別注明外均為MS培養基,蔗糖0.3%,瓊脂0.8%,pH值5.8±0.1。
2 結果與分析
2.1 糯玉露組培體系外植體的選擇
由表1可知,在接種15 d后,3種外植體的培養物表現差異很大。其中以花序作為外植體的培養物的污染率最低;而基部分株葉片的滅菌效果最差,容易污染;葉片作為外植體表現居中,其中有2塊葉片外植體未染菌,但是枯萎死亡,可能是由于糯玉露葉片本身水分含量過多導致的[3]。綜合考慮,在建立糯玉露組培快繁體系時,以其花序作為外植體是相對最優選擇,且不推薦選用基部分株葉片作為快繁外植體。
2.2 不同激素組合及濃度對愈傷組織形成的影響
糯玉露花序愈傷組織在不同激素組合的培養基上進行愈傷組織誘導培養,15 d表現為花序一端開始膨大,形成黃綠色不規則疏松突起;30 d天左右形成大塊愈傷組織。從表2可知,糯玉露花序在6種MS培養基中的5種上都產生了愈傷組織,在MS+1.5 mg·L-16-BA+0.2 mg·L-1NAA培養基上,所有的組織均褐變并死亡,沒有產生足夠強壯的愈傷組織。在其他5種組合中,1號培養基表現得最好,愈傷組織誘導率達到74%。所以,MS+0.7 mg·L-16-BA+1.0 mg·L-1KT+0.1 mg·L-1NAA是糯玉露愈傷組織誘導的最適培養基。
2.3 不同激素組合及濃度對不定芽增殖的影響
從表3可知6-BA對愈傷組織的刺激作用明顯,添加了6-BA的培養基誘導出了更多的叢生芽,同時KT對叢生芽的增殖有抑制作用。從迅速擴大種植規模的角度考慮,MS+0.7 mg·L-16-BA+0.1 mg·L-1NAA是糯玉露花葶愈傷組織分化叢生芽的相對最優培養基[4]。
2.4 不同激素濃度對糯玉露生根的影響
將增殖培養產生的叢生苗分割,轉接到生根培養基上(13~21號,見表4),在15 d后觀察發現有根萌生,在30 d進行生根數目和植株狀態情況統計,當培養基為MS+0.3 mg·L-16-BA+0.3 mg·L-1NAA時,生根率最高,達100%,是最佳的生根培養基。在生根苗長到5片葉子以上,葉片肥厚,根系粗壯時就可以揭開封口膜,在組培室進行煉苗培養。
2.5 馴化移栽
在揭開封口膜5 d后,取出植株,在流動的自來水下洗凈瓊脂培養基。將洗凈的植株放在鋪有滅菌干燥報紙的搪瓷盤上,放在通風陰涼處放置12 h,然后栽種在滅菌好的基質中(蛭石和草炭體積比1∶3)[5]。為防止爛根,應避免積水,在保持基質濕潤的前提下,見干見濕,不干不澆。為防止糯玉露幼苗曬傷,應將植株放置在受控光照環境下,避免陽光直射。每月施1次薄肥,滿3個月即可達到商品標準,總體馴化成活率在90%以上。
3 結論與討論
為探索外植體的選擇,在葉片、基部分株葉片和花序中開展了外植體選擇實驗,結果表明,花序作為外植體進行組織培養,污染率最低,成活率最高。植物激素是植物細胞脫分化和再分化的關鍵因子,在愈傷誘導、不定芽分化、增殖和生根中,本實驗設置了多種激素組合和不同濃度,探索出了一整套糯玉露的組培快繁體系。
綜上所述,結合前人研究成果,研究利用組織培養方法成功獲得了糯玉露的組培苗,建立了組培快繁生產程序,也為十二卷屬多肉植物的組培苗規模化生產提供了參考,具有較好應用前景。
參考文獻:
[1] 郭生虎,朱永興,關雅靜.百合科十二卷屬玉露的組培快繁關鍵技術研究[J].中國農學通報,2016,32(34):85-89.
[2] 郜李彬,曹征宇,顧韻莉,等.玉露增殖培養基配方篩選及光照時間研究[J].上海農業科技,2017(6):109.
[3] 陳紅剛,高素芳,楊韜.玉露的組織培養與快速擴繁[J].北方園藝,2011(12):101-102.
[4] 高越,王婭欣,孫濤,等.毛玉露的組織培養與快速繁殖[J].生物學通報,2010,45(6):54-55.
[5] 張景新,劉艷軍,楊靜慧,等.激素對冰燈玉露不定芽和不定根分化的影響[J].天津農林科技,2016(4):4-6.
(責任編輯:趙中正)
收稿日期:2021-08-13
基金項目:衡水市科技計劃項目(2019014045Z)。
作者簡介:李曉(1986—),男,河北桃城人,碩士,講師,研究方向為生物多樣性。E-mail:359617298@qq.com。

