藥品上市許可持有人藥物警戒外包的風險因素分析
吳其聰 劉穎 許燕 熊慧瑜 劉佐仁

中圖分類號 R95 文獻標志碼 A 文章編號 1001-0408(2021)22-2689-06
DOI 10.6039/j.issn.1001-0408.2021.22.01
摘 要 目的:分析藥品上市許可持有人(MAH)藥物警戒外包的風險因素并提出風險管控策略,為MAH順利實施藥物警戒外包和監管部門制定相應監管策略提供參考。方法:基于委托-代理理論和頭腦風暴法初步確定風險因素,并設計調查問卷,采用隨機抽樣的方式對廣東省內200家MAH的藥物警戒工作人員進行問卷調查。采用因子分析法對問卷數據進行統計分析,歸納得出綜合性風險因素并計算其評分。結果與結論:共發放調查問卷200份,回收有效問卷154份,問卷有效回收率為77.00%。因子分析結果顯示,MAH藥物警戒外包活動涉及的綜合性風險因素主要有4個,按其影響程度由高到低分別為服務提供商與外包管理因素(3.792分)、MAH因素(3.766分)、法規因素(3.626分)和市場因素(3.610分)。針對上述影響因素,建議MAH在開展藥物警戒外包時,應重視完善外包合同、與服務提供商建立信息溝通機制、加強審計與管理工作、強化自身藥物警戒能力及人才建設、明確適宜的藥物警戒外包業務內容、充分做好對服務提供商的事前調查工作;建議相關部門應盡快制定藥物警戒委托質量管理規范或指南,并加強對服務提供商的監管;建議嘗試成立藥物警戒外包行業協會,并通過充分發揮協會的影響力來規范行業行為,進而避免外包風險的發生。
關鍵詞 藥品上市許可持有人;藥物警戒外包;風險因素;因子分析
Analysis of Risk Factors of MAH Pharmacovigilance Outsourcing
WU Qicong1,LIU Ying2,XU Yan2,XIONG Huiyu2,LIU Zuoren1,3(1. College of Pharmacy, Guangdong Pharmaceutical University, Guangzhou 510006, China; 2. Center for ADR Monitoring of Guangdong, Guangzhou 510080, China; 3. NMPA Key Laboratory for Technology Research and Evaluation of Pharmacovigilance, Guangzhou 510006, China)
ABSTRACT? ?OBJECTIVE: To analyze the risk factors of marketing authorization holder (MAH) pharmacovigilance outsourcing and propose risk management and control strategies, and to provide reference for MAH to successfully implement pharmacovigilance outsourcing and regulatory authorities to formulate corresponding regulatory strategies. METHODS: Based on the principal-agent theory and brainstorming method, the risk factors were preliminarily determined, and a questionnaire was designed. The questionnaire survey was carried out among pharmacovigilance staff of 200 MAH in Guangdong province by random sampling. The factor analysis method was used to statistically analyze the questionnaire data, and the comprehensive risk factors and their respective factor scores were summarized. RESULTS & CONCLUSIONS: A total of 200 questionnaires were distributed, and 154 valid questionnaires were returned, with effective recovery rate of 77.00%. The results of factor analysis method showed that there were 4 comprehensive risk factors involved in MAH pharmacovigilance outsourcing activities, which were service providers and outsourcing management factor (3.792 score), MAH factor (3.766 score), regulations factor (3.626 score) and market factor (3.610 score) from high to low. In view of the above factors, it is suggested that MAH should focus on improving outsourcing contract, establishing information communication mechanism with service providers, strengthening auditing and management, strengthening pharmacovigilance ability and personnel building, defining appropriate pharmacovigilance outsourcing business contents, and fully doing pre-service investigation of service providers, when MAH conducts outsourcing of pharmacovigilance. It is suggested that relevant departments should formulate pharmacovigilance entrusted quality management specifications or guidelines as soon as possible and strengthen the supervision of service providers. It is suggested to try to establish a pharmacovigilance outsourcing industry association, and standardize the industry behavior by giving full play to the influence of the association, so as to avoid the outsourcing risk.
KEYWORDS? ?Marketing authorization holder; Pharmacovi- gilance outsourcing; Risk factors; Factor analysis
2019年新修訂的《藥品管理法》明確提出我國要“建立藥物警戒制度,對藥品不良反應及其他與用藥有關的有害反應進行監測、識別、評估和控制”[1];2020年,國家市場監督管理總局發布的《藥品生產監督管理辦法》也明確提出:“藥品上市許可持有人(MAH)應當建立藥物警戒體系,按照國家藥品監督管理局制定的藥物警戒質量管理規范開展藥物警戒工作”[2]。這標志著我國正式開始建立藥物警戒制度,并從立法層面明確了MAH應主動承擔開展藥物警戒活動的責任與義務。然而,對于多數MAH而言,藥物警戒工作并非其業務所長;且隨著藥物警戒工作的不斷細化以及相關人力成本的不斷增加,MAH的藥物警戒部門現有的人員配備已難以滿足藥物警戒工作的需求。國外學者Stergiopoulos等[3]對部分大型生物制藥組織進行的調查顯示,將藥物警戒工作外包可降低藥物警戒操作成本。可以推測,MAH會青睞于將部分藥物警戒工作委托給外部專業的藥物警戒服務提供商(后文簡稱“服務提供商”)來完成,但藥物警戒外包在具體實施過程當中所帶來的風險不容忽視,如服務提供商人員流動率高或水平較低造成的藥物警戒工作質量較差等。2021年5月13日,國家藥品監督管理局出臺的《藥物警戒質量管理規范》(GVP)雖然從協議簽訂、受托方遴選以及定期審計等方面為MAH開展藥物警戒外包工作提供了一定的指導[4],但并未對具體操作細節進行規范。因此,為確保我國MAH藥物警戒外包活動能夠順利開展,有必要對MAH藥物警戒外包的風險因素開展研究。為此,本研究擬在風險因素識別的基礎上,對廣東省內的MAH藥物警戒工作人員進行問卷調查,分析影響MAH藥物警戒外包的風險因素并提出風險管控策略,以期為MAH順利實施藥物警戒外包和監管部門制定相應監管策略提供參考。
1 資料與方法
1.1 問卷設計與預調研
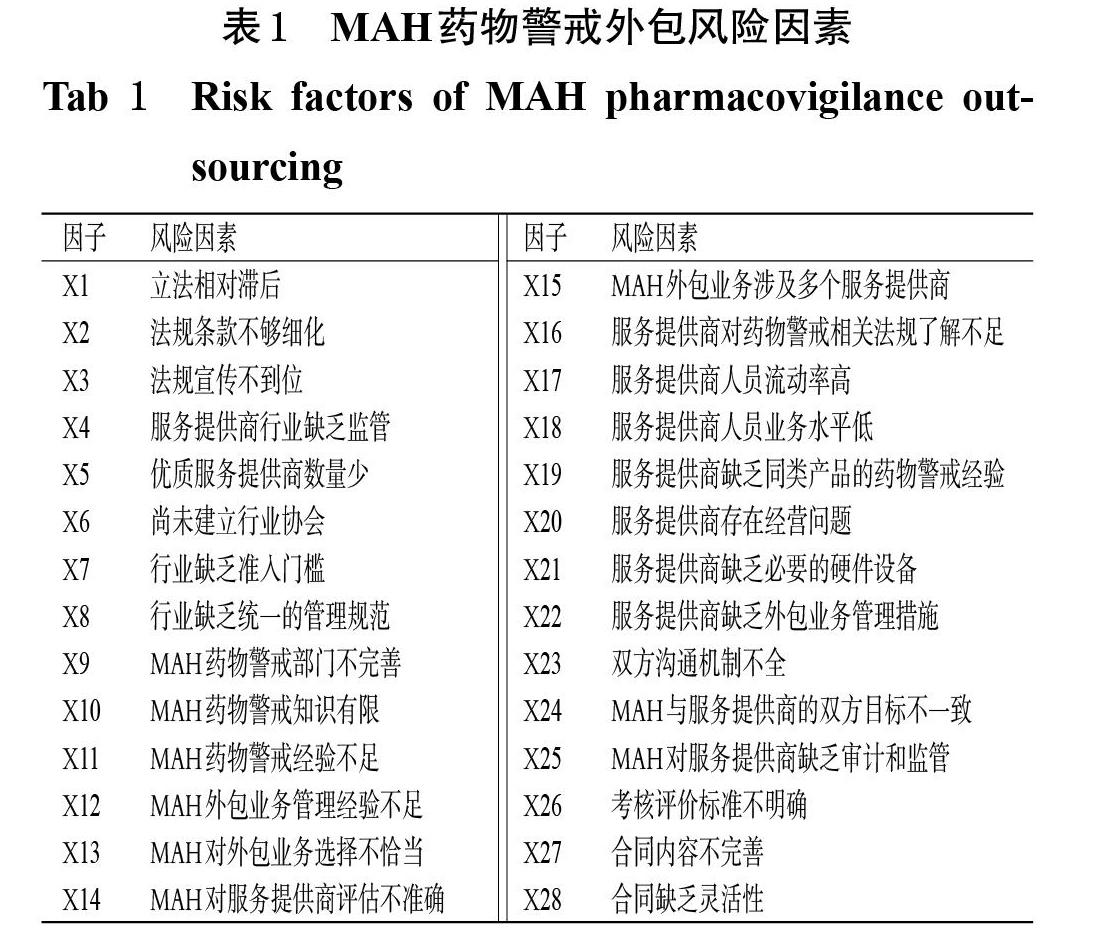
首先,本課題組基于委托-代理理論的5個基本假設[5-6],從理論層面初步識別出16個藥物警戒外包的風險因素。其次,邀請13家已經實施了藥物警戒外包的MAH藥物警戒部門人員參加頭腦風暴研討會,讓與會代表結合自身的工作實際從實踐層面提出藥物警戒外包的風險因素,并對初步識別出來的風險因素進行修正和完善,最終得到28個藥物警戒外包風險因素(表1),并據此設計調查問卷。問卷包括調查對象的基本信息和調查對象對MAH藥物警戒外包風險因素的影響程度評分兩部分,其中影響程度評分采用Likert 5級評分法,按照“影響很大”“影響大”“一般”“影響小”“影響很小”分別評為5、4、3、2、1分。為進一步完善調查問卷并檢驗問卷信度,本研究在正式調查開始前進行了小范圍的預調研(發放并回收有效問卷31份,回收率為100%),問卷整體的Cronbachs α系數為0.881,超過0.800,表明問卷的整體信度非常好[7]。
1.2 問卷調查與數據處理
本課題組采用隨機抽樣法,通過電子郵件向廣東省內的200家MAH藥物警戒部門的工作人員發放電子問卷。采用KMO檢驗和Bartlett球形檢驗對問卷數據進行適宜性檢驗和信度分析;采用SPSS 24.0軟件對問卷數據進行因子分析和描述性統計分析。
2 結果
本次調查共發放問卷200份,回收有效問卷154份,問卷有效回收率為77.00%。
2.1 調查對象的基本情況
調查對象的基本情況見表2。
2.2 問卷數據檢驗
采用KMO檢驗和Bartlett球形檢驗對問卷數據進行適宜性檢驗,結果顯示,KMO值為0.936;Bartlett球形檢驗的χ 2值為3 437.089,P<0.001,表明問卷數據適合開展因子分析[8]。
對問卷數據開展信度分析以明確其可靠性。經計算,問卷整體的Cronbachs α系數為0.963;隨后逐一去掉某一因子后再計算Cronbachs α系數,結果顯示,需刪除X6這一因子,最終保留27個因子,此時的Cronbachs α系數為0.964,超過0.900,表明問卷數據的可靠性非常好[9]。
2.3 因子篩選
采用因子分析法對測量因子進行篩選,具體標準如下:(1)單個測量因子不能自成1個提取成分;(2)每個因子在其所屬提取成分的載荷量應高于0.5;(3)每個因子在其所屬提取成分上的載荷量接近1,而在其他提取成分上的載荷量接近0;(4)如果某個因子在所有提取成分上的載荷量均低于0.5,或者在2個及以上提取成分上的載荷量均高于0.5,則都需要刪除該因子[10]。
對問卷數據進行初始因子分析,將其成分矩陣進行旋轉,結果顯示,因子X4同時在2個提取成分上的載荷量高于0.5;因子X22在所有提取成分上的載荷量均低于0.5。依據上述因子篩選標準,刪除X4和X22這兩個因子。
2.4 提取公因子
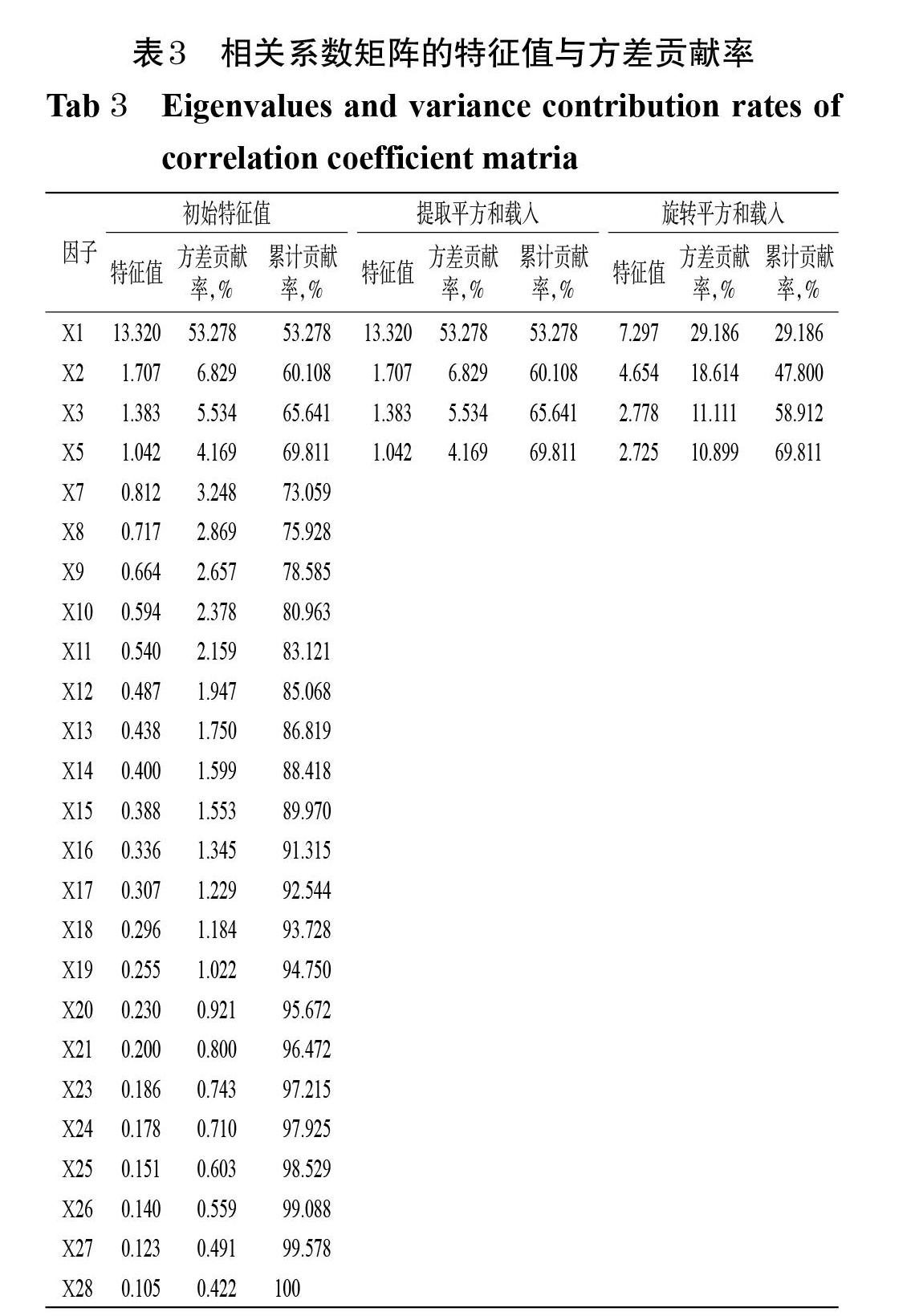
對剩余的25個因子重新開展因子分析,得到相關系數矩陣的特征值與方差貢獻率,結果見表3。由表3可見,有4個提取成分的特征值>1,且累計方差貢獻率達69.811%,超過60%,表明這4個提取成分能反映25個因子當中的關鍵信息[11]。
2.5 旋轉成分矩陣及提取成分命名
對25個因子的初始載荷矩陣進行旋轉,結果見表4。由表4可見,所有因子均僅在1個提取成分上具有高載荷(即載荷量>0.5)。提取成分1(包括X15~X21、X23~X28)主要與服務提供商以及外包管理有關,故將其命名為“服務提供商與外包管理因素”;提取成分2(包括X9~X14)主要與MAH有關,故將其命名為“MAH因素”;提取成分3(包括X1~X3)與法律規范有關,故將其命名為“法規因素”;提取成分4(包括X5、X7~X8)與市場環境有關,故將其命名為“市場因素”。
2.6 提取成分分析
對4個提取成分進行信度分析,并計算其評分均值,以此進一步判斷這4個提取成分各自對MAH藥物警戒外包的影響程度,結果見表5。由表5可見,4個提取成分的Cronbachs α系數均大于0.800,表明各個提取成分的內部一致性非常好[9]。4個提取成分的評分均值由高到低依次為:服務提供商與外包管理因素(3.792分)、MAH因素(3.766分)、法規因素(3.626分)和市場因素(3.610分)。可見,服務提供商與外包管理因素的得分最高,表示該因素對整個藥物警戒外包活動風險的影響程度最大,需要MAH在開展藥物警戒外包過程中予以重點關注。進一步分析可知,服務提供商與外包管理因素和MAH因素均屬于藥物警戒外包活動的內部風險因素,而法規因素和市場因素均屬于藥物警戒外包活動的外部風險因素,提示對于藥物警戒外包而言,內部風險因素的影響程度要大于外部風險因素的影響程度。
3 討論與建議
由上述分析結果可見,MAH藥物警戒外包的風險大小受服務提供商與外包管理因素、MAH因素、法規因素以及市場因素的共同影響,故筆者針對上述風險因素提出相應的風險管控策略。
3.1 服務提供商與外包管理因素
服務提供商與外包管理因素對藥物警戒外包風險的影響程度最大,包括合同不完善、雙方溝通機制不全、MAH對服務提供商缺乏審計和監管、服務提供商自身能力不足等。基于此,本文提出如下建議:
3.1.1 完善外包合同 在正式簽訂藥物警戒外包合同前,合同雙方應當給予部分合同條款留有一定的彈性空間并明確雙方的權責。一方面,合同雙方應當明確可啟動變更程序的基本情況(包括但不限于法律法規及監管文件變更、MAH產品線擴展及上市區域擴大、服務提供商的組織架構變更及服務中斷、藥物警戒系統更新升級導致的功能及費用變化等),并制定變更條款,以確保合同的靈活性。另一方面,合同雙方應將外包業務開展過程的關鍵步驟進行詳細分解,并明確各自的權責。例如,MAH應確保其提供的藥物相關資料的真實性;服務提供商應確保其工作按照相關法規及合同要求開展,做好留痕保存工作、數據保密工作以及數據管理工作等。
3.1.2 建立信息溝通機制 MAH與服務提供商之間應建立適宜的溝通機制,加強溝通及信息共享。一方面,在藥物警戒外包實施前,雙方應當就外包合同當中的委托內容、工作時限、受托單位、對接人以及溝通方式等進行詳細溝通,以明確外包的職責、范圍與負責人,進一步強化合同的約束力;另一方面,雙方應重點就發現藥品風險信號、藥物警戒質量不達標以及藥品監管部門檢查等特殊情況制定相應的溝通方案。
3.1.3 加強審計與管理工作 MAH應根據自身的標準操作程序,結合產品風險級別、服務提供商資質以及藥物警戒經驗等制定詳細的藥物警戒審計計劃。在審計方式上,MAH可視情況采用問卷調查、現場審計等多種適宜的方式;審計內容包括但不限于服務提供商的企業概況、組織架構與人員情況、質量控制體系、藥物警戒系統、風險管理系統、數據保護措施等。對于審計缺陷項目,MAH不僅應要求服務提供商做好整改以及反饋工作,還要做好缺項項目的整改追蹤記錄,及時確認整改的完成情況。
3.2 MAH因素
MAH因素對藥物警戒外包風險的影響程度較大,主要包括MAH自身藥物警戒能力不足、MAH對外包業務以及服務提供商的選擇不恰當等因素。因此,建議MAH要強化自身藥物警戒能力及人才建設,明確適宜的藥物警戒外包業務內容,并充分做好對服務提供商的事前調查工作,進而有效避免外包風險的發生。
3.2.1 強化自身藥物警戒能力及人才建設 首先,MAH應繼續嚴格履行GVP相關法律和規范,提高自身的藥物警戒水平;同時,應充分熟悉外包的各項業務,不斷積累自身的藥物警戒管理經驗。其次,MAH應提高藥物警戒人才隊伍的素質水平并保持人才隊伍的穩定性,充分評估服務提供商所需的支持信息,并做好藥物警戒的外包審計和管理工作。
3.2.2 明確適宜的藥物警戒外包業務內容 MAH應當結合自身藥物警戒工作的實際情況,選擇適宜的藥物警戒外包業務。常見的藥物警戒外包業務主要有:藥品不良反應案例收集、錄入、報告、評價,文獻檢索、翻譯,定期安全性更新報告撰寫,藥物警戒培訓,熱線電話管理,藥物警戒年度報告撰寫等[12]。可以看出,適宜外包的業務主要有兩個特征:一是簡單且重復性較強;二是具有明確的審核評價標準,有利于MAH衡量外包的質量成果。然而,涉及產品安全要素的登記、風險效益的評估以及風險管理計劃的制定等對業務決策有顯著影響的關鍵活動或外包管理工作則不適宜外包[13-14]。
3.2.3 充分做好對服務提供商的事前調查工作 MAH對服務提供商的事前資質調查應當至少涉及如下3個方面:第一,應了解該服務提供商的基本信息情況,包括但不限于其基本情況、行業知名度和信譽度、核心業務人員資質及工作背景、藥物警戒業務服務范圍及所擅長的藥物警戒服務領域等;第二,應了解服務提供商開展藥物警戒工作的硬件設施情況,如藥物警戒系統簡介等;第三,應重點了解服務提供商既往承包過的藥物警戒業務情況,如是否有同類產品藥物警戒項目執行經驗、對該類產品是否足夠了解、能否根據藥品的安全特性制定出相應的藥物警戒計劃和方案、能否及時識別藥品風險信號等藥物警戒能力,以及近年的客戶解約情況和公共關系情況等,以明確服務提供商的業務服務能力。
3.3 法規因素
在外部風險因素中,法規因素對藥物警戒外包風險的影響程度較大,主要包括GVP相關立法相對滯后、法規條款不夠細化等。因此,建議相關部門在細化藥物警戒外包相關法規條款的同時,還要進一步借鑒國外發達國家對服務提供商監管的先進經驗,及時適應我國MAH藥物警戒工作的新形勢,規范MAH藥物警戒外包工作的開展。
3.3.1 制定藥物警戒委托質量管理規范或指南 當前能直接指導藥物警戒外包工作開展的法規主要有GVP和《藥物警戒委托協議撰寫指導原則》[4,15]。兩者雖然能從協議簽訂注意事項、受托方遴選基本要求以及定期審計等方面為藥物警戒外包工作提供原則性的指導,但仍需要進一步具體化。因此,建議在上述法規的基礎上,進一步制定藥物警戒委托質量管理規范或指南,明確MAH遴選服務提供商的基本流程及考察要點、MAH對服務提供商的審計要點、不適宜委托的業務內容、外包合同中應當要求服務提供商承諾的事項等。同時,鑒于可以外包的藥物警戒工作繁多,且MAH和服務提供商的特點各不相同、能力參差不齊,因此建議在制定相關管理規范或指南時,應詳細說明藥物警戒外包原則及主要步驟,而不是描述所有可能的外包任務及具體工作的開展細節[16]。
3.3.2 加強對服務提供商的監管 目前,部分國外發達國家已經開展了對藥物警戒外包工作的監管,例如英國藥品和健康產品管理局認為,針對服務提供商的藥物警戒檢查重點應該放在服務提供商對法規及工作流程的理解執行以及對不同MAH所委托的安全性數據進行正確歸檔這兩個要點上[17]。因此,建議我國藥品監管部門嘗試探索對服務提供商的監管及其藥物警戒業務的檢查工作,明確檢查的側重點并制定針對服務提供商的管理及檢查制度,定期檢查服務提供商的專業人員資質、管理制度以及硬件設備等情況,促進其規范開展藥物警戒工作。
3.4 市場因素
藥物警戒外包屬于市場交易行為的一種,因此市場因素對藥物警戒外包的風險也具有重要影響,包括優質服務提供商數量少、行業缺乏準入門檻以及缺乏統一的管理規范等3個因素。基于此,筆者建議可嘗試通過成立藥物警戒外包行業協會并充分發揮協會的影響力來規范行業行為,進而避免外包風險的發生。
行業協會是國家治理體系和治理能力現代化的有機組成部分[18]。通過行業協會來統一規范相應操作,不僅有利于在宏觀層面上提高行業自律和管理水平,還可以在學術和產業發展層面上加強交流協作、共同進步[19]。通過外包行業協會來搭建行業內部各服務提供商以及行業內部與MAH的信息溝通交流平臺,一方面能夠為MAH與服務提供商提供公開、透明的市場信息,另一方面還可以通過開展行業內部的交流活動,為行業內部的各個服務提供商提供良好的經驗交流、信息共享平臺,以規范行業行為、促進行業健康發展[20]。行業協會可以作為牽頭人,推動相關操作指南、標準的出臺,規范行業行為,進而能夠有效避免不良市場行為的發生[19];同時,行業協會還可以促進行業內監管力度的提升,并對某些服務提供商降低服務質量的行為進行規范,從而確保行業的服務質量水平,以降低藥物警戒外包的風險、推動藥物警戒外包工作的順利開展。
4 結語
本研究基于委托-代理理論和頭腦風暴法創造性地識別出了28個藥物警戒外包風險因素,并對廣東省內的MAH藥物警戒工作人員進行了問卷調查,找出了4個影響藥物警戒外包的關鍵風險因素,即服務提供商與外包管理因素、MAH因素、法規因素以及市場因素等。該研究一方面可為MAH藥物警戒外包工作的順利開展提供參考,另一方面也能為相關部門的政策優化提供依據。
參考文獻
[ 1 ] 全國人民代表大會.中華人民共和國藥品管理法[EB/OL].(2019-08-26)[2021-04-23]. http://www.gov.cn/xinwen/2019-08/26/content_5424780.htm.
[ 2 ] 國家市場監督管理總局.藥品生產監督管理辦法:國家市場監督管理總局令第28號[EB/OL].(2020-03-30)[2021-
04-23]. https://www.nmpa.gov.cn/yaopin/ypfgwj/ypfgbmgzh/20200330182901110.html.
[ 3 ] STERGIOPOULOS S,FEHRLE M,CAUBEL P,et al. Adverse drug reaction case safety practices in large biopharmaceutical organizations from 2007 to 2017:an indu- stry survey[J]. Pharmaceut Med,2019,33(6):499-510.
[ 4 ] 國家藥品監督管理局.國家藥監局關于發布《藥物警戒質量管理規范》的公告:2021年 第65號[EB/OL].(2021-05-13)
[2021-05-31]. https://www.nmpa.gov.cn/xxgk/ggtg/qtggtg/20210513151827179.html.
[ 5 ] 李善良.供應鏈委托代理問題分析[D].上海:復旦大學,2005.
[ 6 ] 龐永紅.委托代理理論的倫理考量[J].蘇州科技學院學報(社會科學版),2006,23(3):46-51.
[ 7 ] 曾五一,黃炳藝.調查問卷的可信度和有效度分析[J].統計與信息論壇,2005(6):13-17.
[ 8 ] 牛建軍,耿岳.普通高校公體課探究式教學評價指標體系構建:基于因子分析法的應用研究[J].體育科學研究,2016,20(6):73-76,92.
[ 9 ] 徐蓓雯.招聘流程外包風險影響因素研究[D].徐州:中國礦業大學,2015.
[10] 劉瑛,互聯網健康傳播:理論建構與實證研究[M].武漢:華中科技大學出版社,2013:106-121.
[11] 楊學軍,曾國軍.影響服務外包承接地競爭力的因子分析:基于示范城市軟件外包企業的問卷調查[J].科技管理研究,2011,31(20):112-115,127.
[12] 高千秋,張浩嘉.歐盟藥品上市許可持有人的藥物警戒責任研究[J].中國藥物評價,2019,36(1):77-80.
[13] LELE C. A successful path to fulfilling pharmacovigilance obligations[J]. Manuf? Chemist,2013,84(7/8):24-26.
[14] 劉麗麗.國外藥品上市許可持有人委托開展藥物警戒監管對我國的啟示[J].中國藥物警戒,2020,17(11):773-776.
[15] 國家藥品監督管理局藥品評價中心.關于發布藥物警戒委托協議撰寫指導原則(試行)的通知[EB/OL].(2020-06-04)
[2021-05-01]. http://www.cdr-adr.org.cn/drug_1/zcfg_1/zcfg_zdyz/202006/t20200604_47472.html.
[16] VAN LEEUWEN B,EDWARDS B. The road to pharmacovigilance outsourcing guidance[J]. Ther Innov Regul Sci,2020,55(2):408-414.
[17] Medicines and Healthcare Products Regulatory Agency.Service provider inspections[EB/OL].(2019-10-09)[2020-
04-21]. https://www.gov.uk/guidance/good-pharmacovigilance-practice-gpvp.
[18] 楊盛峰.培育發展行業協會商會要把握好“三個關系”[N].定西日報,2021-03-25(003).
[19] 鄭航,蔣君好,嚴波.重慶市醫藥研發外包服務產業發展現狀與提升路徑研究[J].中國處方藥,2020,18(10):31-33.
[20] 劉凱鑫,楊錚.建立檔案外包行業協會必要性探析[J].北京檔案,2020(2):34-36.
(收稿日期:2021-05-12 修回日期:2021-10-18)
(編輯:孫 冰)

