車前子多糖對乳腺癌細(xì)胞增殖、遷移和侵襲的影響及其機(jī)制
陳高 楊曉婷 王曦 金湛 朱瑞 甘椿椿 周道堂 姚水洪

摘 要 目的:研究車前子多糖對乳腺癌細(xì)胞增殖、遷移和侵襲的影響,并初步探究其作用機(jī)制。方法:以人乳腺癌細(xì)胞MDA-MB-231為對象,采用MTT法檢測不同質(zhì)量濃度車前子多糖(8、16、32、64 mg/L)對細(xì)胞增殖能力的影響并計(jì)算細(xì)胞存活率;采用劃痕實(shí)驗(yàn)、Transwell侵襲實(shí)驗(yàn)分別檢測不同質(zhì)量濃度車前子多糖(8、16 mg/L)對細(xì)胞遷移和侵襲能力的影響;采用Western blot法檢測轉(zhuǎn)移及上皮間質(zhì)轉(zhuǎn)化(EMT)相關(guān)蛋白[基質(zhì)金屬蛋白酶2(MMP-2)、MMP-9、上皮黏鈣素(E-cadherin)、神經(jīng)黏鈣素(N-cadherin)、波形蛋白(vimentin)]的表達(dá)情況。結(jié)果:MTT實(shí)驗(yàn)結(jié)果顯示,車前子多糖32、64 mg/L組細(xì)胞的存活率均較對照組顯著降低(P<0.05或P<0.01),故以不影響細(xì)胞存活率的8、16 mg/L作為后續(xù)實(shí)驗(yàn)給藥濃度。與對照組比較,車前子多糖8、16 mg/L組細(xì)胞的相對遷移率(12、24 h)、相對侵襲率以及MMP-2、MMP-9、N-cadherin、vimentin蛋白的相對表達(dá)量均顯著降低(P<0.05或P<0.01),E-cadherin蛋白的相對表達(dá)量均顯著升高(P<0.05或P<0.01)。結(jié)論:車前子多糖能夠在體外抑制乳腺癌細(xì)胞MDA-MB-231的增殖,并可能通過抑制轉(zhuǎn)移及EMT相關(guān)蛋白的表達(dá)來抑制該細(xì)胞的遷移和侵襲。
關(guān)鍵詞 車前子多糖;乳腺癌;MDA-MB-231細(xì)胞;增殖;遷移;侵襲
ABSTRACT ? OBJECTIVE: To study the effects of Plantago asiatica polysaccharide on the proliferation, migration and invasion of breast cancer cells, and to investigate its mechanism preliminarily. METHODS: Using human breast cancer cell MDA-MB-231 as subjects, MTT method was adopted to detect the effects of different concentrations of P. asiatica polysaccharide (8, 16, 32, 64 mg/L) on the cell proliferation ability, and survival rate of the cells was calculated. Scratch test and Transwell invasion test were used to detect the effects of different concentrations of P. asiatica polysaccharide (8, 16 mg/L) on cell migration ability and invasion ability. Western blot assay was used to detect the expression of epithelial-mesenchymal transition (EMT)-related proteins
[matrix metalloproteinase-2 (MMP-2), MMP-9, E-cadherin, N-cadherin, vimentin]. RESULTS: Results of MTT assay showed that survival rate of the cells in 32, 64 mg/L P. asiatica polysaccharide groups were significantly lower than control group (P<0.05 or P<0.01), so that 8, 16 mg/L, which did not affect the cell survival rate, were used as the follow-up drug concentrations. Compared with control group, relative mobility (12, 24 h), relative invasion rate and relative expression of MMP-2, MMP-9, N-cadherin and vimentin protein were decreased significantly in 8, 16 mg/L P. asiatica polysaccharide groups (P<0.05 or P<0.01), while relative expression of E-cadherin protein was increased significantly (P<0.05 or P<0.01). CONCLUSIONS: P. asiatica polysaccharide can inhibit the proliferation of breast cancer cells MDA-MB-231, and inhibit the migration and invasion of the cells by regulating the expression of metastasis and EMT-related proteins.
KEYWORDS? ?Plantago asiatica polysaccharide; Breast cancer; MDA-MB-231 cells; Proliferation; Migration; Invasion
近年來,乳腺癌的發(fā)病率已居女性惡性腫瘤之首,其患者數(shù)量已占各種惡性腫瘤患者總數(shù)的7%~10%,已成為影響女性健康的主要原因之一,也是引起女性死亡的重要病因[1]。研究證實(shí),乳腺癌患者死亡的關(guān)鍵因素與乳腺癌細(xì)胞遷移和侵襲有關(guān),故篩選能夠有效抑制腫瘤細(xì)胞遷移和侵襲的抗腫瘤藥物成為相關(guān)研究的熱點(diǎn)之一[2]。車前子Plantaginis Semen是車前屬植物車前Plantago asiatica L.或平車前Plantago depressa Willd.的干燥成熟種子,始見于《神農(nóng)本草經(jīng)》,其性微寒,味淡、甘,具有滲濕止瀉、明目、祛痰等功效[3]。多糖為車前子的主要有效部位,目前國內(nèi)外有關(guān)車前子多糖的研究主要集中于其調(diào)節(jié)血糖、血脂和潤腸通便等作用方面[4-6],而關(guān)于其在抗腫瘤方面的研究報道較為少見。研究表明,車前子多糖在H22肝癌移植瘤小鼠體內(nèi)表現(xiàn)出一定的抗腫瘤活性[7],但有關(guān)其對乳腺癌細(xì)胞的影響尚缺乏系統(tǒng)研究。鑒于此,本研究擬以車前子多糖為干預(yù)物,分析其對人乳腺癌細(xì)胞MDA-MB-231增殖、遷移和侵襲的影響,并初步探究其作用機(jī)制,以期為車前子多糖抗腫瘤作用的闡釋以及乳腺癌的臨床治療提供參考。
1 材料
1.1 主要儀器
本研究所用主要儀器包括3111型CO2培養(yǎng)箱(美國Thermo Fisher Scientific公司)、PowerPac Basic型電泳儀(美國Bio-Rad公司)、3300 Mini型化學(xué)發(fā)光成像系統(tǒng)(上海勤翔科學(xué)儀器有限公司)、BG-XM496型酶標(biāo)儀(廈門百谷生物工程有限公司)、XJL-101型正置顯微鏡(上海皆準(zhǔn)儀器設(shè)備有限公司)、X715 XK-8型轉(zhuǎn)移脫色搖床(江蘇新康醫(yī)療器械有限公司)、SW-CJ-2FD型超凈工作臺(蘇州凈化設(shè)備有限公司)、BSA124S-CW型電子天平和MDF-U3386S型超低溫冰箱(上海巴玖實(shí)業(yè)有限公司)等。
1.2 主要藥品與試劑
車前子藥材(批號Y1805060)購自衢州南孔中藥有限公司,經(jīng)衢州職業(yè)技術(shù)學(xué)院醫(yī)學(xué)院魏自太副教授鑒定為車前科植物車前P. asiatica L.的干燥成熟種子。
DMEM/F12培養(yǎng)基(批號04541,兩者體積比1 ∶ 1)、胎牛血清(批號M2128)均購自美國Hyclone公司;青霉素-鏈霉素雙抗(批號20190103)購自美國Gibco公司;RIPA裂解液(批號P0013C)、BCA蛋白濃度測定試劑盒(批號P0024)、胰酶(批號C0201)均購自上海碧云天生物技術(shù)有限公司;MTT試劑(批號M2128)、二甲基亞砜(DMSO,批號M3321)均購自美國Sigma公司;蘇木精-伊紅(HE)試劑盒(批號20181212)、Matrigel膠(批號20181101)均購自北京索萊寶科技有限公司;兔源基質(zhì)金屬蛋白酶2(MMP-2)多克隆抗體(批號#87809)、兔源MMP-9多克隆抗體(批號#13667)、兔源上皮鈣黏附蛋白(E-cadherin)單克隆抗體(批號#3195)、兔源神經(jīng)鈣黏附蛋白(N-cadherin)多克隆抗體(批號#13116)、兔源波形蛋白(vimentin)多克隆抗體(批號#5741)、甘油醛-3-磷酸脫氫酶(GAPDH)多克隆抗體(批號#5174)、辣根過氧化物酶標(biāo)記的山羊抗兔IgG二抗(批號#7074)均購自美國CST公司;ECL顯影液(批號102030719)購自美國Bio-Rad公司;其余試劑均為分析純或?qū)嶒?yàn)室常用規(guī)格,水為純化水。
1.3 細(xì)胞
人乳腺癌細(xì)胞MDA-MB-231購自中國科學(xué)院上海生命科學(xué)研究院細(xì)胞資源中心。
2 方法
2.1 車前子多糖及其藥液的制備
取車前子藥材25 g,加入35倍量(mL/g)的水,沸水浴中回流提取6 h,濾過,濃縮至原體積的1/2;加入95%乙醇(使乙醇體積分?jǐn)?shù)達(dá)60%),醇沉6 h,濾過;將沉淀烘干即得車前子多糖,得率為6.58%(即100 g生藥可提取得6.58 g多糖)。臨用前,將車前子多糖用pH 7.2的磷酸鹽緩沖液(PBS)混懸,制得質(zhì)量濃度約1 000 mg/L(以多糖提取物質(zhì)量計(jì))的藥液,備用。
2.2 細(xì)胞的培養(yǎng)
將MDA-MB-231細(xì)胞接種于含胎牛血清(10%)、青霉素(200 U/mL)、鏈霉素(200 U/mL)的DMEM/F12培養(yǎng)基(以下簡稱“完全培養(yǎng)基”)中,于37 ℃、5%CO2培養(yǎng)箱中培養(yǎng)(培養(yǎng)條件下同)。每間隔2天換液1次,待80%~90%細(xì)胞融合之后,以胰酶(0.25%)消化并傳代,繼續(xù)培養(yǎng),取對數(shù)期細(xì)胞用于后續(xù)實(shí)驗(yàn)。
2.3 細(xì)胞存活率的檢測
采用MTT法進(jìn)行檢測。收集“2.2”項(xiàng)下對數(shù)期細(xì)胞適量,經(jīng)胰酶消化、吹打,以1 500 r/min離心5 min,棄去上清液;細(xì)胞用完全培養(yǎng)基重懸并調(diào)整密度至2×104 mL-1,按800個/孔接種并培養(yǎng)于96孔板中。待細(xì)胞貼壁后,將其隨機(jī)分為對照組和車前子多糖不同質(zhì)量濃度組(8、16、32、64 mg/L,以多糖提取物質(zhì)量計(jì),下同;劑量參考文獻(xiàn)[7]設(shè)置),同時設(shè)置不含藥物、不含細(xì)胞的空白培養(yǎng)基組,每組設(shè)4個復(fù)孔。其中,對照組加入完全培養(yǎng)基,藥物組加入含相應(yīng)質(zhì)量濃度車前子多糖的完全培養(yǎng)基。細(xì)胞培養(yǎng)48 h后,棄去培養(yǎng)基,每孔加入5 mg/L的MTT試劑20 μL;繼續(xù)培養(yǎng)4 h后,吸棄上清液,每孔加入DMSO 100 μL,振搖10 min。使用酶標(biāo)儀于570 nm波長處檢測各孔的光密度(OD)并計(jì)算細(xì)胞存活率:細(xì)胞存活率(%)=(待測組細(xì)胞OD570 nm-空白培養(yǎng)基組OD570 nm)/(對照組OD570 nm-空白培養(yǎng)基組OD570 nm)×100%。上述實(shí)驗(yàn)重復(fù)3次。
2.4 細(xì)胞遷移能力的檢測
采用細(xì)胞劃痕實(shí)驗(yàn)進(jìn)行檢測。收集“2.2”項(xiàng)下對數(shù)期細(xì)胞適量,經(jīng)胰酶消化、吹打,以1 500 r/min離心5 min,棄去上清液;細(xì)胞用完全培養(yǎng)基重懸并調(diào)整密度至2×105 mL-1,按6×105個/孔接種并培養(yǎng)于6孔板中。待細(xì)胞長成單層之后,用200 μL槍頭在每孔底部中央作一劃痕,用PBS清洗后,將細(xì)胞隨機(jī)分為對照組和車前子多糖不同質(zhì)量濃度組(8、16 mg/L;劑量參考“2.3”項(xiàng)下結(jié)果設(shè)置,下同),每組設(shè)置3個復(fù)孔。其中,對照組加入完全培養(yǎng)基,藥物組加入含相應(yīng)質(zhì)量濃度車前子多糖的完全培養(yǎng)基。分別于細(xì)胞培養(yǎng)0、12、24 h時使用正置顯微鏡觀察并拍照,使用Image J 1.52V軟件分析并計(jì)算相對遷移率:相對遷移率=(待測組細(xì)胞不同培養(yǎng)時間較0 h時的遷移距離/對照組細(xì)胞不同培養(yǎng)時間較0 h時的遷移距離)×100%。上述實(shí)驗(yàn)重復(fù)3次。
2.5 細(xì)胞侵襲能力的檢測
采用Transwell侵襲實(shí)驗(yàn)進(jìn)行檢測。收集“2.2”項(xiàng)下對數(shù)期細(xì)胞適量,經(jīng)胰酶消化、吹打,以1 500 r/min離心5 min,棄去上清液;細(xì)胞用完全培養(yǎng)基重懸并調(diào)整密度至2×104 mL-1,接種200 μL于Transwell小室上層,下層加入含青霉素(200 U/mL)、鏈霉素(200 U/mL)、不含血清的DMEM/F12培養(yǎng)基500 μL。將細(xì)胞隨機(jī)分為對照組和車前子多糖不同質(zhì)量濃度組(8、16 mg/L),每組平行3份。細(xì)胞培養(yǎng)24 h后,取出小室,棄去上層液體,用甲醇固定5 min;細(xì)胞以PBS清洗3次,依次用蘇木精和伊紅試劑各染色5 min。用水洗去殘留的染料,再用棉簽擦去未穿過Matrigel膠和聚碳脂膜的細(xì)胞后,使用正置顯微鏡觀察并隨機(jī)選取5個視野拍照,記錄染色陽性細(xì)胞數(shù)(即發(fā)生侵襲細(xì)胞的數(shù)量)并計(jì)算相對侵襲率:相對侵襲率=(待測組侵襲細(xì)胞數(shù)/對照組侵襲細(xì)胞數(shù))×100%。上述實(shí)驗(yàn)重復(fù)3次。
2.6 細(xì)胞中轉(zhuǎn)移及上皮間質(zhì)轉(zhuǎn)化(EMT)相關(guān)蛋白表達(dá)水平的檢測
采用Western blot法進(jìn)行檢測。收集“2.2”項(xiàng)下對數(shù)期細(xì)胞適量,經(jīng)胰酶消化、吹打,以1 500 r/min離心5 min,棄去上清液;細(xì)胞用完全培養(yǎng)基重懸并調(diào)整密度至3×105 mL-1,按6×105個/孔接種并培養(yǎng)于6孔板中。待細(xì)胞貼壁后,將其隨機(jī)分為對照組和車前子多糖不同質(zhì)量濃度組(8、16 mg/L),每組設(shè)3個復(fù)孔。其中,對照組加入完全培養(yǎng)基,藥物組加入含相應(yīng)質(zhì)量濃度車前子多糖的完全培養(yǎng)基。細(xì)胞培養(yǎng)48 h后,棄去培養(yǎng)基,用RIPA裂解液裂解后,于4 ℃下以8 000 r/min離心3 min,收集上清液,采用BCA法測定蛋白的濃度。取上述蛋白樣品,于100 ℃下加熱8 min使變性;取變性蛋白適量,經(jīng)十二烷基硫酸鈉-聚丙烯酰胺凝膠電泳分離后轉(zhuǎn)膜,以5%脫脂奶粉室溫封閉30 min;加入MMP-2、MMP-9、E-cadherin、N-cadherin、vimentin、GAPDH一抗(稀釋比例均為1 ∶ 1 000),4 ℃下孵育過夜;用TBST溶液清洗3次,加入相應(yīng)二抗(稀釋比例為1 ∶ 3 000),室溫下孵育2 h;用TBST溶液清洗3次,經(jīng)ECL顯色后,使用化學(xué)發(fā)光熒光成像系統(tǒng)成像。采用Image J 1.52V軟件進(jìn)行分析,以目標(biāo)條帶與內(nèi)參GAPDH蛋白條帶灰度值的比值表示目標(biāo)蛋白的相對表達(dá)量,并以各組蛋白相對表達(dá)量與對照組蛋白相對表達(dá)量的比值作為最終結(jié)果。上述實(shí)驗(yàn)重復(fù)3次。
2.7 統(tǒng)計(jì)學(xué)方法
采用SPSS 22.0軟件對數(shù)據(jù)進(jìn)行統(tǒng)計(jì)分析。所有數(shù)據(jù)均以x±s表示,多組間比較采用單因素方差分析,組間兩兩比較采用LSD檢驗(yàn)。檢驗(yàn)水準(zhǔn)α=0.05。
3 結(jié)果
3.1 車前子多糖對MDA-MB-231細(xì)胞存活率的影響
與對照組比較,車前子多糖32、64 mg/L組細(xì)胞的存活率均顯著降低(P<0.05或P<0.01);而車前子多糖8、16 mg/L組細(xì)胞的存活率與對照組比較,差異均無統(tǒng)計(jì)學(xué)意義(P>0.05),詳見表1。鑒于此,本研究將8、16 mg/L作為后續(xù)研究的給藥濃度。
注:與對照組比較,*P<0.05,**P<0.01
Note: vs. control group,*P<0.05,**P<0.01
3.2 車前子多糖對MDA-MB-231細(xì)胞遷移能力的影響
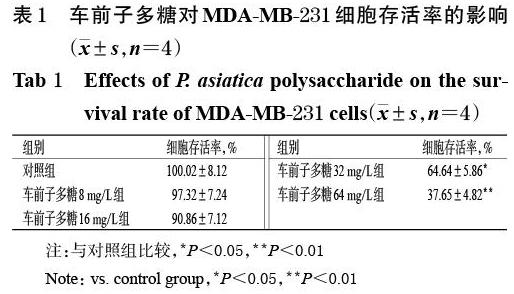
培養(yǎng)12 h時,8、16 mg/L的車前子多糖使細(xì)胞相對遷移率分別降至約20%和9%;培養(yǎng)24 h時,8、16 mg/L的車前子多糖使細(xì)胞的相對遷移率分別降至約24%和5%。在上述各時間點(diǎn),各藥物組細(xì)胞的相對遷移率均顯著低于對照組(P<0.01),且有隨藥物質(zhì)量濃度增加而降低的趨勢,詳見圖1、表2。
3.3 車前子多糖對MDA-MB-231細(xì)胞侵襲能力的影響
與對照組比較,各藥物組的侵襲細(xì)胞數(shù)明顯減少,其相對侵襲率均顯著降低(P<0.05或P<0.01),且有隨藥物質(zhì)量濃度增加而降低的趨勢,詳見圖2、表2。
3.4 車前子多糖對MDA-MB-231細(xì)胞轉(zhuǎn)移及EMT相關(guān)蛋白表達(dá)的影響
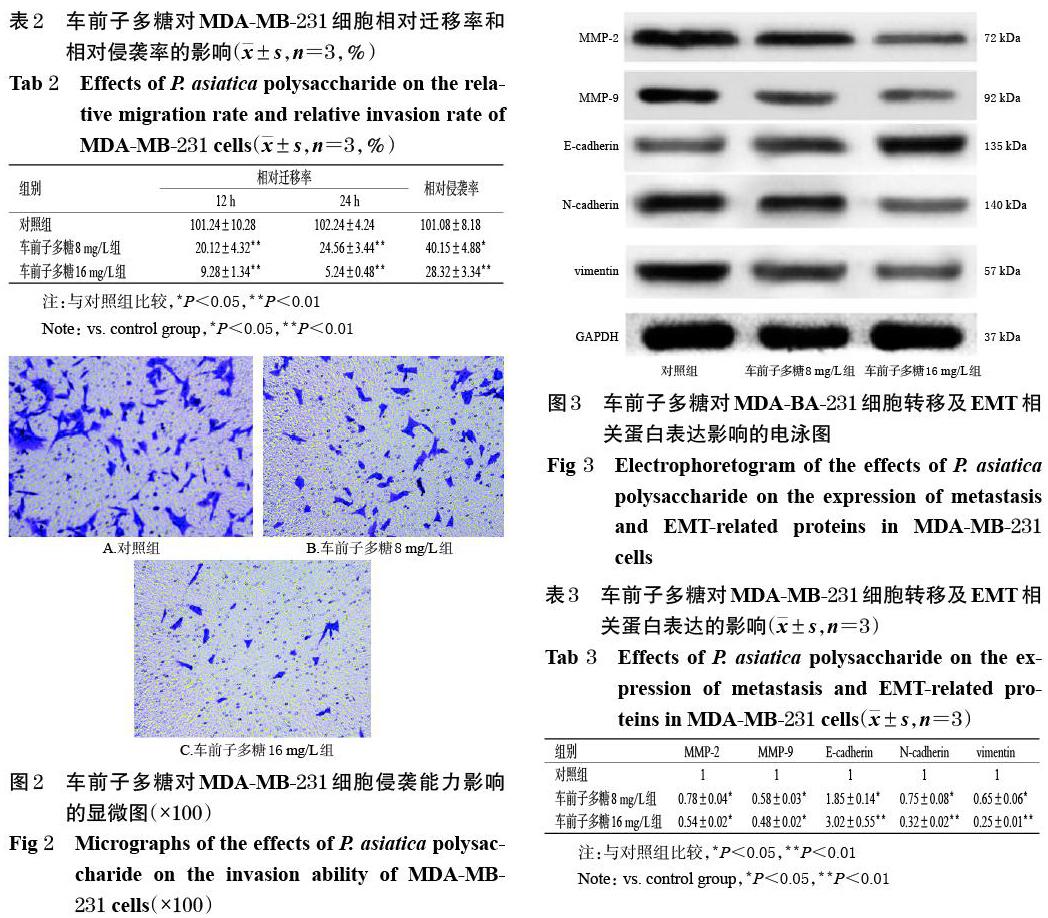
與對照組比較,各藥物組細(xì)胞中MMP-2、MMP-9、N-cadherin、vimentin蛋白的相對表達(dá)量均顯著降低(P<0.05或P<0.01),E-cadherin蛋白的相對表達(dá)量均顯著升高(P<0.05或P<0.01),且均有隨藥物質(zhì)量濃度增加而降低或升高的趨勢,詳見圖3、表3。
4 討論
現(xiàn)階段乳腺癌的治療方式主要以化療為主,但是常規(guī)的化療藥物對乳腺癌細(xì)胞和正常細(xì)胞的選擇性不佳,并容易對心臟、腎臟等重要組織器官產(chǎn)生器質(zhì)性損傷,故有必要進(jìn)一步挖掘有效的治療藥物[8]。車前子的主要有效成分為車前子多糖,該多糖是其種皮外表細(xì)胞壁含有的黏液質(zhì)(為一種親水性膠體)[9]。多糖在動植物和微生物細(xì)胞中分布甚廣,其藥理活性相關(guān)研究的進(jìn)展迅速,已初步證實(shí)其具有包括抗病毒、抗凝血、抗氧化等在內(nèi)的多種生物活性[10-12]。本研究從車前子中提取車前子多糖,考察其對人乳腺癌細(xì)胞MDA-MB-231增殖、遷移和侵襲能力的影響。首先,通過MTT實(shí)驗(yàn)發(fā)現(xiàn),較高質(zhì)量濃度(32、64 mg/L)的車前子多糖對該細(xì)胞增殖具有明顯的抑制作用。根據(jù)細(xì)胞增殖實(shí)驗(yàn)結(jié)果,本研究選擇了對細(xì)胞無顯著抑制作用的8、16 mg/L作為后續(xù)實(shí)驗(yàn)的給藥濃度,進(jìn)一步通過劃痕實(shí)驗(yàn)和Transwell侵襲實(shí)驗(yàn)探討了車前子多糖對細(xì)胞遷移和侵襲能力的影響。結(jié)果顯示,不同質(zhì)量濃度的車前子多糖均能顯著抑制細(xì)胞的增殖和遷移,且有濃度依賴趨勢。
轉(zhuǎn)移是惡性乳腺癌最重要的生物學(xué)特征,是腫瘤轉(zhuǎn)移的必需步驟,同時也是近年來腫瘤患者病死率較高的主要原因之一[13-14]。因此,腫瘤的轉(zhuǎn)移機(jī)制成為近年來相關(guān)領(lǐng)域的研究熱點(diǎn)之一。有研究指出,腫瘤細(xì)胞侵襲、轉(zhuǎn)移的關(guān)鍵因素是細(xì)胞外基質(zhì)(EMC)以及基底膜的降解,而其中發(fā)揮關(guān)鍵作用的則是MMP家族[15]。據(jù)報道,乳腺癌細(xì)胞中MMP-2、MMP-9蛋白的表達(dá)量顯著高于癌旁正常組織,同時這兩種MMP的高表達(dá)與乳腺癌細(xì)胞轉(zhuǎn)移密切相關(guān)[16]。MMP-2和MMP-9具有促進(jìn)基底膜和EMC分解的作用,有利于乳腺癌細(xì)胞的遷移和侵襲。有研究表明,多種中藥提取物具有抑制腫瘤細(xì)胞轉(zhuǎn)移的作用,例如海參提取物能夠抑制前列腺癌細(xì)胞轉(zhuǎn)移,山茱萸提取物能夠抑制乳腺癌細(xì)胞轉(zhuǎn)移,且部分提取物的這種作用是通過抑制MMP-2和MMP-9的表達(dá)來實(shí)現(xiàn)的[17-19]。EMT是乳腺癌細(xì)胞轉(zhuǎn)移的重要機(jī)制,可促進(jìn)惡性腫瘤細(xì)胞的侵襲、轉(zhuǎn)移及耐藥,其主要特征為上皮細(xì)胞的極性喪失,進(jìn)而導(dǎo)致細(xì)胞間的黏附性減弱,使細(xì)胞最終表現(xiàn)出間質(zhì)細(xì)胞的形態(tài)和特性[16,20]。EMT發(fā)生的標(biāo)志性事件是上皮細(xì)胞特征的喪失,如間充質(zhì)標(biāo)志蛋白vimentin、N-cadherin的表達(dá)上調(diào),以及E-cadherin和其他細(xì)胞黏附分子的表達(dá)下調(diào)[21]。本研究結(jié)果顯示,不同質(zhì)量濃度的車前子多糖均能顯著下調(diào)轉(zhuǎn)移相關(guān)蛋白MMP-2、MMP-9的表達(dá),下調(diào)EMT相關(guān)蛋白N-cadherin、vimentin的表達(dá),同時上調(diào)E-cadherin的表達(dá),且有濃度依賴趨勢。這表明車前子多糖能夠抑制MDA-MB-231細(xì)胞間極性的喪失,阻止其向間質(zhì)細(xì)胞形態(tài)發(fā)展,即阻止其EMT的發(fā)生。
綜上所述,車前子多糖能夠在體外抑制人乳腺癌細(xì)胞MDA-MB-231的增殖,并可能通過抑制轉(zhuǎn)移及EMT相關(guān)蛋白的表達(dá)來抑制其遷移和侵襲。但有關(guān)車前子多糖在抗乳腺癌方面的其他相關(guān)機(jī)制以及對其他腫瘤細(xì)胞的影響,尚有待進(jìn)一步的探討。
參考文獻(xiàn)
[ 1 ] SIEGEL R,MILLER K D,JEMAL A. Cancer statistics 2016 CA[J]. CA Cancer J Clin,2016,66(1):7-30.
[ 2 ] 羅嬌,周莉.外泌體在乳腺癌腦轉(zhuǎn)移診斷和治療中的研究進(jìn)展[J].腫瘤,2020,40(5):361-370.
[ 3 ] 國家藥典委員會.中華人民共和國藥典:一部[S]. 2015年版.北京:中國醫(yī)藥科技出版社,2015:68-69.
[ 4 ] 王東,袁昌魯,林力,等.車前子多糖對小腸運(yùn)動障礙小鼠的影響[J].中華中醫(yī)藥學(xué)刊,2008,26(6):1188-1189.
[ 5 ] 李沖沖,龔蘇曉,許浚,等.車前子化學(xué)成分與藥理作用研究進(jìn)展及質(zhì)量標(biāo)志物預(yù)測分析[J].中草藥,2018,49(6):1233-1246.
[ 6 ] 馮亞龍.車前子拮抗芳烴受體介導(dǎo)的腎纖維化物質(zhì)基礎(chǔ)及作用機(jī)制研究[D].西安:西北大學(xué),2019.
[ 7 ] 馮娜,王素敏.車前子多糖抗腫瘤作用的實(shí)驗(yàn)研究[J].天津藥學(xué),2018,30(6):1-4.
[ 8 ] 林嘉燕,張建國.乳腺癌新輔助化療療效的評估方法及其進(jìn)展[J].東南大學(xué)學(xué)報(醫(yī)學(xué)版),2019,38(4):727-731.
[ 9 ] 謝明,楊爽爽,王亮亮,等.中藥車前子的研究進(jìn)展[J].黑龍江醫(yī)藥,2015,28(3):474-476.
[10] 賈偉,毛淑敏,張盼盼,等.金銀花多糖體內(nèi)抗病毒作用研究[J].遼寧中醫(yī)藥大學(xué)學(xué)報,2018,20(6):25-27.
[11] 李德海,顧佳林,孫常雁,等.提取技術(shù)對酸性黑木耳多糖抗凝血活性的影響[J].華南理工大學(xué)學(xué)報(自然科學(xué)版),2018,46(6):93-102.
[12] 王儲炎,程俊文,祝超.黑芝菌發(fā)酵產(chǎn)生胞外多糖的工藝優(yōu)化及其抗氧化活性[J].浙江農(nóng)業(yè)學(xué)報,2018,30(11):1938-1945.
[13] 崔一鳴,周斌,李斐斐,等.益肺清化顆粒對人肺癌PG細(xì)胞增殖、遷移與侵襲能力的影響[J].中華中醫(yī)藥雜志,2014,29(11):3592-3595.
[14] 宋方方,張玲,陳可欣.遷移侵襲抑制蛋白對腫瘤細(xì)胞侵襲轉(zhuǎn)移的調(diào)節(jié)[J].中華勞動衛(wèi)生職業(yè)病雜志,2013,31 (12) :944-947.
[15] 張小博,李艷會,李開良,等. VEGF、MMP-2、MMP-9在胰腺癌中的表達(dá)及臨床意義[J].中國老年學(xué)雜志,2014,34(2):327-329.
[16] LI H,QIU Z,LI F,WANG C,et al. The relationship between MMP-2 and MMP-9 expression levels with breast cancer incidence and prognosis[J]. Oncol Lett,2017,14(5):5865-5870.
[17] 袁磊,周凱,蘇暢,等.海參提取物TBL-12抑制激素非依賴性前列腺癌細(xì)胞的增殖和轉(zhuǎn)移[J].熱帶醫(yī)學(xué)雜志,2019,19(3):261-265,后插4.
[18] 謝靜靜,張金花,金劍英,等.山茱萸提取物對乳腺癌細(xì)胞MDA-MB-231侵襲和轉(zhuǎn)移的抑制作用及機(jī)制研究[J].浙江中西醫(yī)結(jié)合雜志,2020,30(5):369-374,后插3-后插4.
[19] IM I,PARK K R,KIN S M,et al. The butanol fraction of guava (Psidium cattleianum Sabine) leaf extract suppres- ses MMP-2 and MMP-9 expression and activity through the suppression of the ERK1/2 MAPK signaling pathway[J]. Nutri Cancer,2012,64(2):255-266.
[20] KURIOKA K,WATO M,ISEKI T,et al. Differential expression of the epithelial mesenchymal transition factors Snail,Slug,Twist,TGF-β,and E-cadherin in ameloblastoma[J]. Med Mol Morphol,2017,50(2):68-75.
[21] CHAFFER C L,SAN JUAN B P,LIM E,et al. EMT,cell plasticity and metastasis[J]. Cancer Metastasis Rev,2016,35(4):645-654.
(收稿日期:2020-08-31 修回日期:2021-05-13)
(編輯:張?jiān)拢?/p>

