氯膦酸二鈉脂質體治療膝關節骨性關節炎的療效觀察
陸鋒藝 王雨 莊汝杰*
骨性關節炎(Ostereoarthritis,OA)是最常見的關節退行性疾病,臨床上以嚴重的疼痛及肢體功能活動障礙為主要特點[1],嚴重影響患者的生活質量。然而,OA的發病機制尚不明確,既往臨床多責之于關節軟骨,關于關節軟骨的信號機制研究包括C5、hypoxia-inducible factor-2ɑ、syndecan-4、ADAMTS 等[2-5]。本研究通過建立小鼠膝關節骨性關節炎模型,并用氯膦酸二鈉脂質體(Clodronate liposomes,CL)進行干預,觀察膝關節破壞情況,以探討氯膦酸二鈉脂質體對膝骨關節炎的影響。巨噬細胞可吞噬注入人體內的氯膦酸二鈉脂質體,消化脂質體釋放氯膦酸二鈉,在巨噬細胞內聚集達到一定濃度后,巨噬細胞失去活性并凋亡[6]。
1 材料與方法
1.1 實驗動物、試劑與耗材 8 周齡雄性C57BL/6 小鼠,購自浙江中醫藥大學動物實驗中心。氯膦酸二鈉脂質體(LIPOSOMA,CP-005-005),帕瑞西布鈉(MCE,HY-17474A),Collagen 2 抗體(Abcom,Ab34712),MTT細胞增殖及細胞毒性檢測試劑盒(Beyotime,C0009S),RAW264.7 小鼠單核巨噬細胞系(Procell,CL-0190),96 孔板孔細胞培養板(NEST),DMEM 培養基(gibco),特級胎牛血清(HYCLONE,SH30070.03)。
1.2 實驗方法 SPF 級健康8 周齡雄性C57BL/6 小鼠30 只,隨機均分為A(CL)組,B(帕瑞西布鈉)組,C(空白對照)組,每組各10 只。A 組和B 組小鼠進行DMM 造模,建立小鼠KOA 模型,C 組不做處理。造模步驟參考WELCH 等[7],術后4 周關節炎造模成功。在造模成功前1 周,A 組小鼠膝關節注射氯膦酸二鈉脂質體(1 mg/mL)6μL,1 次,進行巨噬細胞耗竭。從術后第4 周開始,B 組小鼠關節腔注射帕瑞昔布鈉(1 mg/mL)20μL,1 周2 次。C 組小鼠注射生理鹽水20μL,1 周2 次。
1.3 檢測指標 于造模后第4 周、第8 周獲取小鼠膝關節標本,并采用4%多聚甲醛固定。置于10%甲醛溶液中固定48 h 后,經0.27 mol/mL EDTA-2Na 脫鈣2 個月,每隔1 周更換脫鈣液。脫鈣后將膝關節石蠟包埋,從關節內側邊緣開始于矢狀平面連續切片,進行常規HE 染色及Ⅱ型膠原免疫組化,比較各組膝關節軟骨的病理變化。染色結果半定量分析以染色強度結合陽性細胞數百分比綜合計分。
1.4 細胞培養 RAW264.7 巨噬細胞培養于含10%胎牛血清的DMEM 完全培養基中,置于37 ℃、含5%CO2及飽和濕度的培養箱中培養。將RAW264.7 巨噬細胞濃度調整為2×105個/mL,接種于96 孔板,100 μL/孔,置37 ℃、含5% CO2培養箱內貼壁培養3 h,分為空白對照組(0μg/mL)、空白脂質體組(150 μg/mL、175 μg/mL、200 μg/mL、225 μg/mL、250 μg/mL、275 μg/mL、300 μg/mL),CL 組(150 μg/mL、175 μg/mL、200 μg/mL、225 μg/mL、250 μg/mL、275 μg/mL、300 μg/mL),各組3 個復孔,分別培養24 h 后,加入10 μL 配置好的MTT 溶液,在細胞培養箱內繼續孵育4 h。每孔加入100μL Formazan 溶解液,適當混勻,在細胞培養箱內再繼續孵育。直至在普通光學顯微鏡下觀察發現Formazan 全部溶解,在570 nm 測定吸光度。
1.5 統計學方法 采用 SPSS 19.0 統計軟件。計量資料以(±s)表示,采用重復測量方差分析,多組間比較采用單因素方差分析,兩兩比較采用LSD-t 檢驗。以P<0.05 為差異有統計學意義。
2 結果
2.1 各組小鼠膝關節HE 染色及二型膠原免疫組化 空白對照組為正常關節軟骨,CL 組的關節表面破壞較少,保留較多的健康完整的軟骨細胞。4周時帕瑞昔布組還有保留較多的軟骨細胞,8 周時軟骨細胞退變嚴重,關節表面破壞較CL 組嚴重。說明CL 可延緩軟骨細胞的退變。見圖1。
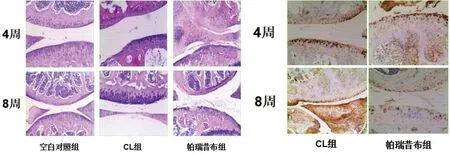
圖1 各組小鼠膝關節HE染色及二型膠原免疫組化(×40)
2.2 不同濃度CL 培養巨噬細胞的變化 巨噬細胞吞噬CL 后,氯膦酸二鈉在細胞內聚集,導致巨噬細胞凋亡,最終留下富含脂質體的巨噬細胞,稱為泡沫細胞,見圖2。MTT 試驗后,獲得不同組的OD 值,空白脂質體組各濃度之間無差異(P>0.05);CL 組各濃度之間,150 μg/mL、175 μg/mL、200 μg/mL、225 μg/mL、250 μg/mL 之間的OD 值存在差異(P<0.05),而275 μg/mL、300 μg/mL 較高濃度下的OD 值無明顯差異(P>0.05),巨噬細胞幾乎均轉化為充滿脂質的泡沫細胞。150 μg/mL、175 μg/mL 較低濃度下的OD 值反而高于空白對照組(0μg/mL),可見低濃度CL 對巨噬細胞的增殖有一定的促進作用。見表1 和圖3。

圖2 不同濃度CL培養的巨噬細胞
表1 不同CL濃度培養下MTT試驗后的OD值比較(±s)

表1 不同CL濃度培養下MTT試驗后的OD值比較(±s)
濃度(μg/mL)0150175200225250275300空白脂質體0.445±0.0490.435±0.0820.507±0.0950.436±0.0430.400±0.0480.412±0.0880.338±0.1230.330±0.125氯膦酸二鈉脂質體0.418±0.0690.605±0.1320.529±0.1150.424±0.0220.354±0.0750.264±0.0570.279±0.0440.275±0.068
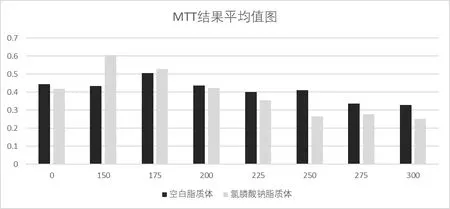
圖3 不同CL濃度培養下MTT試驗后的OD值柱狀圖
3 討論
膝關節骨性關節炎(Knee Ostereoarthritis,KOA)是一種退行性骨關節疾病,是由衰老、肥胖和遺傳等多種原因引起的滑膜炎癥、關節軟骨的損傷、骨贅生成、韌帶松弛和關節周圍肌肉減弱。早預防、早診斷并給予有效的治療,不僅可以緩解疼痛癥狀、改善其生活質量,還可以降低晚期膝關節置換率,減輕家庭和社會的經濟負擔。研究發現,骨關節炎小鼠的滑膜組織中炎性巨噬細胞增加[8],巨噬細胞產生的白細胞介素(IL)-1β、IL-6、腫瘤壞死因子(TNF)-α、基質金屬蛋白酶(MMPs)等炎性細胞因子,會加劇疼痛癥狀[9],促進疾病發展[10]。比如,IL-6 等細胞因子為主的炎癥反應可以抑制軟骨中的聚糖蛋白和膠原合成,并上調MMP-13[11];組織金屬蛋白酶抑制劑的下調也可導致MMPs 上調。因為軟骨細胞外基質中90%~95%的成分為Ⅱ型膠原蛋白,而MMPs 中的MMP-13 對裂解Ⅱ型膠原蛋白的活性最強[12]。
氯膦酸二鈉脂質體是一種人工合成的雙膦酸脂,是一種破骨細胞抑制劑,臨床多用于骨質疏松的治療[13]。巨噬細胞可吞噬注入人體內的CL,消化脂質體釋放氯膦酸二鈉,在巨噬細胞內聚集達到一定濃度后,巨噬細胞失去活性并凋亡,而體內的其它細胞如平滑肌細胞,由于不能吞噬體循環中游離的氯膦酸二鈉,而且氯膦酸二鈉的半衰期較短,對體內除吞噬細胞以外的其他細胞無明顯影響。VAN LENT 等[14]研究證實,在RA中CL 消耗巨噬細胞后,膝關節的炎癥表達明顯減少,但仍有相當多的蛋白多糖丟失,輕微的炎癥仍然可以對軟骨造成破壞。BLOM 等[15]在膠原酶誘導小鼠膝關節實驗性骨性關節炎中,于關節腔內注射CL 后,滑膜巨噬細胞耗盡導致骨贅形成顯著減少,說明滑膜巨噬細胞在實驗性OA 過程中是滑膜介導骨贅形成和其他OA 相關病理(如纖維化)的關鍵細胞,而CL 可以通過消耗滑膜巨噬細胞以減輕炎癥反應。TAKANO 等[16]研究發現,滑膜巨噬細胞是OA 小鼠降鈣素受體樣受體(CLR)的主要IL-1β 產生和調節細胞,可以用CL 小鼠的巨噬細胞耗竭降低滑膜中IL-1β 和CLR 基因的表達。李洪強等[17]研究發現,血管內皮生長因子(VEGF)在KOA 的發生、發展過程中發揮重要作用,可以影響軟骨細胞增殖、凋亡和代謝,刺激釋放基質金屬蛋白酶(MMP)及其他代謝介質來降解軟骨基質。IL-33 和ST2在人和鼠骨關節炎中升高[18],IL-33 水平的升高加劇鼠骨關節炎的進展,進而增加軟骨降解蛋白酶(MMP-13、MMP-3 和ADAMTS-5)的表達,減少軟骨形成標志物(COL2A1、SOX-9 和Aggrecan)。而OA 關節中的IL-33主要來自軟骨細胞,所以在體內中和IL-33 和ST2 可以減少軟骨退化和疼痛。
關于CL 消耗巨噬細胞減輕炎癥反應的研究,既往實驗雖然證實了CL 在OA 中可見較少骨贅的生成,減少IL-1β 等炎癥基因表達,但CL 在OA 中的研究仍較少。本實驗結果驗證了CL 對軟骨的保護作用以及對巨噬細胞的耗竭作用。后續研究將繼續驗證CL 耗竭巨噬細胞后,膝關節中IL-6、MMP-13、TIMP-1、VEGF 以及IL-33 的表達。從目前證據來看,氯膦酸二鈉脂質體具有緩解OA 癥狀、保護軟骨的潛力,但具體通過調節哪些細胞因子來緩解OA,有待進一步研究探討。

