磷霉素與其他抗菌藥物對多重耐藥銅綠假單胞菌的聯合藥敏試驗研究
劉云寧,李小鳳,湯建華,張鶴鳴,劉金祿,劉曉明
(河北北方學院附屬第一醫院 1. 藥學部; 2. 微生物科,河北 張家口 075000)
銅綠假單胞菌(Pseudomonasaeruginosa, PA)是醫院感染常見的條件致病菌,當人體接受侵襲性操作、免疫力下降、具有慢性結構性肺病、長期應用廣譜抗菌藥物等情況時,常會導致感染[1]。2014—2019年全國細菌耐藥監測網監測數據[2]顯示,PA對亞胺培南的耐藥率為18.2%~21.0%。 PA的耐藥機制復雜,包括主動外排泵作用,產生抗生素水解酶和修飾酶,改變菌體細胞膜通透性以及染色體突變或捕獲外源性基因盒獲得耐藥性等[3],在常用抗菌藥物中極易產生交叉耐藥,并呈現多重耐藥(multidrug resistance, MDR)或泛耐藥(extensive drug resistance, XDR)的特征,增加臨床治療難度[4]。磷霉素(fosfomycin, FOS)是磷酸烯醇丙酮酸的類似物,對耐藥的革蘭陽性(G+)菌和革蘭陰性(G-)菌均具有良好的抗菌活性,作用機制獨特且與其他抗菌藥物無交叉耐藥[5]。研究以FOS為主,聯合其他抗菌藥物對PA的體外藥敏試驗,以期為臨床治療多重耐藥銅綠假單胞菌(MDR-PA)感染提供合理的給藥方案。
1 材料與方法
1.1 標本來源 2018年1月—2019年12月某三甲醫院50例不同住院患者標本無重復分離的50株(痰40株,分泌物7株,血3株)受試PA。菌株的分離、培養嚴格按照《全國臨床檢驗操作規程》第4版進行。全部菌株均采用BD Phoenix 100全自動微生物鑒定/藥敏分析儀鑒定,對于常見抗菌藥物(包括頭孢菌素類、碳青霉烯類、β-內酰胺酶抑制劑復合制劑、氟喹諾酮類和氨基糖苷類)中3類或3類以上的藥物耐藥,符合MDR-PA標準[1]。
1.2 藥品與儀器 FOS購自中國藥品生物制品檢定所,葡萄糖-6-磷酸鹽購自上海浦津生物科技有限公司,哌拉西林/他唑巴坦(TZP)、頭孢他啶(CAZ)、美羅培南(MEM)、阿米卡星(AMK)、環丙沙星(CIP)藥敏紙片均購自OXOID公司,BD-Phoenix 100全自動細菌鑒定儀。
1.3 試驗方法 采用瓊脂平板稀釋法結合紙片擴散法,測定聯合藥物對PA的敏感性。嚴格按照《全國臨床檢驗操作規程》(第四版)制備瓊脂培養液(培養液含25 mg/L葡萄糖-6-磷酸鹽),在瓊脂培養液中加入 FOS,制成含不同濃度 FOS的瓊脂培養皿(50、100、150、200、250 μg/mL)。將同一株PA菌株接種到含不同濃度 FOS的瓊脂培養皿中,并將聯用抗菌藥物的藥敏紙片粘貼于培養皿上,置37℃培養箱培養24 h,由同一檢驗師用游標卡尺測量抑菌環。
1.4 統計分析 應用WHONET 5.6軟件、SPSS 22.0軟件進行耐藥資料分析。相同藥物與不同濃度FOS的組合,對PA的敏感性變化采用多個獨立樣本非參數檢驗中的多組秩和檢驗(Kruskal-WallisH),以P≤0.05為差異有統計學意義。
2 結果
2.1 試驗菌株對抗菌藥物的敏感性 試驗篩選的50株MDR-PA均通過BD Phoenix 100全自動微生物鑒定/藥敏分析儀進行復核,對TZP 2株中介,CAZ 2株中介,MEM 8株中介,AMK 6株中介,CIP 3株中介;對哌拉西林、氨曲南、頭孢吡肟、左氧氟沙星均表現為耐藥;多粘菌素對試驗菌株的MIC≤1 μg/mL;此外2株試驗菌株對慶大霉素表現為中介。
2.2 聯合藥敏試驗結果 FOS 200 μg/mL組,TZP+FOS組敏感2株,中介5株,耐藥43株,敏感率4.0%;CAZ+FOS組敏感6株,中介6株,耐藥38株,敏感率12.0%;MEM+FOS組敏感30株,中介8株,耐藥12株,敏感率60.0%;FOS+AMK組敏感7株,中介16株,耐藥27株,敏感率14.0%;FOS+CIP組敏感29株,中介11株,耐藥10株,敏感率58.0%。
分析FOS不同濃度含藥平板分別聯合5種抗菌藥物的藥敏結果,結果顯示:FOS+TZP、FOS+CAZ在不同FOS濃度(50~250 μg/mL)組間均無協同作用(P>0.05);FOS+MEM、FOS+AMK、FOS+CIP在不同磷霉素濃度(50~250 mg/L)組間均表現出協同作用(P<0.05)。FOS+MEM、FOS+CIP、FOS+AMK組合兩兩比較,FOS+MEM組合與FOS+CIP組合在所有劑量組中比較,差異均無統計學意義(均P>0.05);在低劑量組(50、100 μg/mL),FOS+AMK與FOS+MEM、FOS+CIP比較,差異均無統計學意義(均P>0.05);在高劑量組(150、200 μg/mL),FOS+AMK與FOS+MEM比較,差異存在統計學意義(χ2=9.032 5,P=0.003;χ2=9.4578,P=0.002);在高劑量組(150、200 μg/mL),FOS+AMK與FOS+CIP比較,差異存在統計學意義(χ2=11.6768,P=0.001;χ2=12.3981,P<0.001)。FOS+MEM組合、FOS+CIP組合比FOS+AMK組合更敏感。見表1。
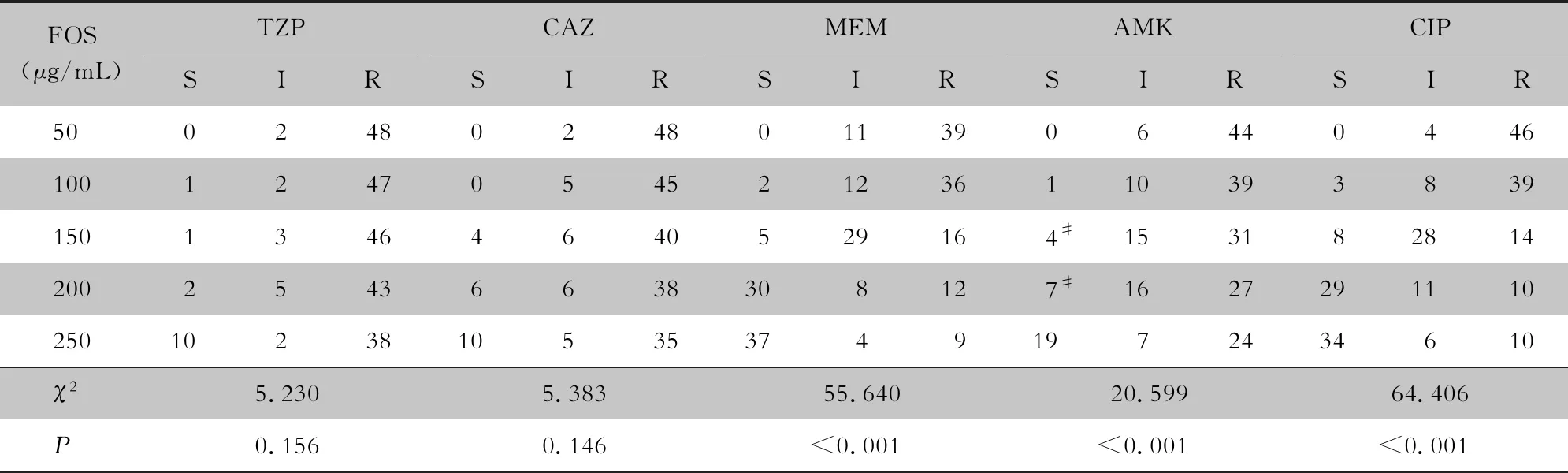
表1 50株MDR-PA體外聯合藥敏試驗結果
3 討論
FOS是小分子親水性抗菌藥物,血漿蛋白結合率極低(2.16%),靜脈給藥后幾乎完全通過腎小球濾過消除(95%~99%)。靜脈滴注 FOS 0.5、1.0、2.0、4.0 g后血藥峰濃度分別為28、46、90、195 μg/mL。蒙特卡洛模擬顯示,對于重癥感染患者延長輸注法(6g/q6h)可提高 Cmax并縮短 Tmax,且與其他抗菌藥物有很好的協同作用[6]。 FOS持續輸注(負荷劑量8 g,之后1 g/h)給藥方案,其穩態濃度為(183.8±35.9)μg/mL[7]。Walsh等[8]體外研究顯示, FOS可中等程度殺滅低接種量(最大殺滅3 log10 CFU/mL)的PA,但24 h后PA會再次生長,此時敏感菌株完全由耐藥株取代,該研究結果與Rodríguez-Gascón等[9]的研究均提示, FOS不宜單藥治療PA感染。
PA的耐藥機制復雜多變,其中生物被膜的形成可以使PA逃避機體免疫和抗菌藥物的殺傷作用。Wang等[10]研究顯示,FOS+CIP聯合用藥對PA生物膜清除的協同作用為57.1%。Yamada等[11]通過電子顯微鏡觀察到,與單獨用藥相比, FOS聯合CIP更易導致細胞膜溶解。Gómez-Garcés等[12]體外抗菌試驗顯示, FOS聯合CIP對40%的CRPA具有協同作用,未見拮抗作用。
一項關于FOS+AMK聯合吸入系統(AFIS)的研究發現,聯合用藥(AMK∶FOS為 5∶2)聯合劑對PA的最低抑菌濃度(MIC)值較AMK和FOS單藥的MIC值降低一半[13]。Sime等[14]研究呼吸機相關肺炎患者臨床分離菌株發現,FOS單藥對PA無任何抗菌活性,AMK 24 h內可產生較好的抗菌活性,但隨后可快速產生耐藥性,但二者聯合用藥可產生快速殺菌作用,同時有效抑制耐藥菌株的產生。CRPA體外抗菌活性試驗顯示,FOS與AMK的協同殺菌率為12%[12],無拮抗作用。
FOS聯合碳青霉烯類抗生素可降低PA生物膜的形成,并降低其自發突變率。FOS聯合MEM對PA的協同殺菌率為53.3%(8/15)[15],對CRPA的協同殺菌率40.0%(28/70)[16],且均未發現拮抗作用。Albiero等[17]對產生金屬β-內酰胺酶(MBL)的PA進行體外抗菌試驗,研究發現FOS聯合MEM使得PA的MIC50和MIC90降低至1/8。Drusano等[18]研究顯示,不同給藥劑量的FOS聯合MEM方案,均能夠降低選擇耐藥性的出現(MEM突變體被聯合殺傷,以及FOS突變體被聯合殺傷),研究結果表明,聯合給藥方案對于殺滅細菌細胞和抑制耐藥菌株的出現均具有明顯的協同作用。
本研究結果顯示,FOS+MEM、FOS+AMK、FOS+CIP組合在FOS各劑量組合比較中均有差異(P<0.05),敏感性增加,但在兩兩比較中FOS+MEM組合和FOS+CIP組合與FOS+AMK組合在FOS高劑量組(150、200 μg/mL)中均表現出統計學差異(P<0.05),提示FOS+MEM組合和FOS+CIP組合對MDR-PA表現出較高的抗菌活性。結合FOS的藥代動力學數據提示,FOS聯合治療MDR-PA感染時應給予較高的劑量。
FOS與TZP、CAZ聯合用藥方案的文獻報道相對較少,Tessier等[19]研究顯示,FOS與CAZ聯合用藥僅有20%的相加作用,80%無關。本研究結果顯示,FOS+TZP組合與FOS+CAZ組合在FOS各劑量組合比較中,差異均無意義(均P>0.05),敏感性無明顯增加,與文獻[19]報道一致,因此不推薦臨床聯合給藥。
MDR-PA的治療藥物選擇非常有限。本研究為FOS聯合其他藥物治療MDR-PA提供了理論依據,但本研究數據較為有限,且研究結果僅顯示藥物體外敏感情況,聯合用藥的臨床療效有待進一步的臨床研究證實,同時本研究中FOS發揮抗菌活性時給藥劑量相對較高,臨床應用過程中需要警惕FOS引起的靜脈炎、高鈉血癥等不良反應。

