鮑曼不動桿菌的調控性非編碼RNA與抗菌藥物耐藥
彭 勤,凌保東
(1. 成都醫學院結構特異性小分子藥物研究四川省高校重點實驗室,四川 成都 610500; 2. 成都醫學院藥學院,四川 成都 610500; 3. 南充市中心醫院藥學部,四川 南充 637000)
鮑曼不動桿菌(Acinetobacterbaumannii)是醫院感染中常見的革蘭陰性條件致病菌,是全球6大超級細菌-ESKAPE(Enterococcusfaecium、Staphy-lococcusaureus、Klebsiellapneumoniae、Acinetobacterbaumannii、Pseudomonasaeruginosa、Entero-bacterspecies)的成員之一[1-2]。近年來,隨著抗菌藥物的廣泛使用,鮑曼不動桿菌的耐藥率不斷上升,出現多重耐藥、泛耐藥,甚至是全耐藥。2017年世界衛生組織(WHO)發布首份抗生素耐藥“重點病原體”清單,列出了對人類健康構成最大威脅的急需開發新抗生素的12種重點耐藥細菌,耐碳青霉烯類鮑曼不動桿菌是其中之首,它的出現給抗感染治療帶來重重困難[3-5]。鮑曼不動桿菌的耐藥機制主要包括藥物滅活酶的產生、藥物外排泵的表達、藥物作用靶點改變、生物被膜的形成等[6-8]。近年研究發現,細菌在抗菌藥物等外界環境壓力下,會產生特異的調控性非編碼RNAs(ncRNAs),在伴侶蛋白Hfq的作用下,與靶基因的mRNA互補配對或通過其構像的變化調控相關耐藥基因(藥物外排泵、生物被膜形成、毒力因子、細胞膜通透性、細胞壁的合成)的表達水平,從而幫助細菌適應外界環境壓力[8-11]。此文針對鮑曼不動桿菌的調控性ncRNAs對耐藥性的調控作用,以及其作為藥物靶點的研究進展進行綜述。
1 調控性ncRNAs的分類及作用機制
細菌調控性ncRNAs是一類廣泛存在于原核生物基因組中能被轉錄但不編碼蛋白質的長度為50~300nt的RNA分子。細菌ncRNAs主要位于基因間區,某些還可位于編碼基因的5’端非翻譯區(5’UTR)和3’端非翻譯區(3’UTR),能折疊成穩定的莖環或發夾結構,與靶基因的mRNA互補或直接與靶蛋白結合,導致mRNA或蛋白的功能衰減或喪失。根據調控ncRNAs的轉錄和調控方式不同,本文將其分為3類即小RNAs(sRNAs)、5’UTR或3’UTR調控元件、成簇規律間隔短回文重復序列(CRISPR)[12-14]。
sRNAs多數位于基因間隔區,自身擁有獨立轉錄的啟動子和終止子,轉錄開始于一段能折疊成穩定莖環結構的序列,終止于 Rho 不依賴的轉錄終止子,以順式或反式作用調節靶基因的表達[15-17]。靶基因的5’UTR 或者3’UTR調控元件,以順式作用調控靶基因的表達[18],核糖體停靠機制以及核糖開關通過靶基因的5’UTR或者3’UTR的莖環或發夾結構構像改變使核糖體結合位點和起始密碼子暴露或隱藏,從而調控細菌對抗生素的敏感性[19-22]。CRISPR序列由眾多短而保守且含有回文序列的重復序列區(repeat,轉錄后可以形成具有穩定發卡結構的tracRNA)和間隔區(spacer,被細菌俘獲的部分外源DNA序列,轉錄后可形成成熟的crRNA)組成。當這些外源遺傳物質再次入侵時,crRNA、tracRNA形成sgRNA復合體,與外源遺傳物質互補配對并引導cas剪切蛋白破壞外源遺傳物質[23-24]。ncRNAs不需要翻譯,在轉錄后水平發揮作用,作用速度比蛋白產生速度快,能更快地調節諸如群體感應、生物被膜、毒力因子、藥物外排泵等相關耐藥基因的表達[25],是細菌對抗菌藥物產生耐藥的重要參與者,因此調控性ncRNAs有希望成為對抗細菌耐藥的新靶點。
2 調控性ncRNAs對鮑曼不動桿菌耐藥性及毒力的調控作用
2.1 調控性sRNAs對鮑曼不動桿菌生物被膜形成和黏附能力的調控作用 生物被膜是鮑曼不動桿菌對抗菌藥物高度耐藥的重要原因,也是其重要的毒力因子,而調控性sRNAs可以通過調控細菌生物被膜的形成從而影響細菌耐藥性和毒力。付竹青[26]研究發現,在鮑曼不動桿菌17978中AbsR25和AbsR28的缺失不僅能抑制其對細胞的黏附,還能顯著減少細菌生物被膜的形成以及提高大蠟螟的存活率。研究者發現,在鮑曼不動桿菌17978中有9個sRNAs只在生物被膜狀態下高表達,而其中sRNA13573的高表達又可增強鮑曼不動桿菌生物被膜形成的能力和對人肺上皮細胞A549的黏附能力[27]。在鮑曼不動桿菌中,sRNAs作用于靶基因時,常需要分子伴侶Hfq的協助,以加快sRNAs與靶mRNA二聚體的形成,Kuo等[28]證明,鮑曼不動桿菌17978在Hfq缺失的情況下生物被膜形成量減少,對細胞的黏附能力也減弱,而且參與生物被膜形成的相關基因,如外膜蛋白ompA、菌毛合成系統csuA/B基因的表達水平也顯著下調。
2.2 調控性sRNAs和5’UTR調控元件對鮑曼不動桿菌外排泵的調控作用 鮑曼不動桿菌中的藥物外排泵種類多而且底物廣,其高表達是細菌耐藥重要機制之一。研究[29]發現,AbsR25的靶基因是外排泵主要易化家族(MFS)中的一種新型的磷霉素外排泵基因abaF,在不同亞抑菌濃度的磷霉素條件下AbsR25負調控abaF基因的表達。在雙組份調控體adeRS與adeABC外排泵操縱子中,adeR與adeA基因之間存在基因間區,而且Marchand等[30]研究顯示,adeR與adeA基因間區存在adeA 5’UTR元件。Wen等[31]研究證實,AdeR蛋白與該基因間區中的一對10 bp直接重復序列結合,從而調控adeABC的表達,提示adeR 5’UTR元件在調節adeABC的表達中起著關鍵作用。
2.3 5’UTR調控元件對鮑曼不動桿菌耐藥酶的調控作用 在氯霉素的誘導下,氯霉素乙酰轉移酶cat基因mRNA的5’UTR調控元件通過核糖體停靠機制使其二級結構改變,導致mRNA的核糖體結合位點和起始密碼子暴露,使下游cat基因高表達,從而使細菌對氯霉素產生抗性。aac/aad氨基糖苷類抗生素核糖開關在氨基糖苷類抗生素的誘導下,aac/aad基因mRNA的5’UTR調控元件的二級結構改變,導致mRNA的核糖體結合位點和起始密碼子暴露,使下游aac/aad基因高表達,介導氨基糖苷類抗生素核糖耐藥[21-22]。

2.5 CRISPR抵抗外源耐藥基因對鮑曼不動桿菌的入侵 CRISPR的間隔序列包含了部分耐藥基因序列,可作為防御外源核酸侵襲的特定“武器”[34]。付恒霞等[35]研究62株臨床耐藥鮑曼不動桿菌,無CRISPR系統的菌株中β-內酰胺酶、乙酰轉移酶、核苷酸轉移酶及16sRNA 甲基化酶等耐藥基因的攜帶率均高于有CRISPR系統菌株,表明CRISPR一定程度上可以抵御外源耐藥對細菌的入侵。
3 靶向調控性ncRNAs的抗感染策略
3.1 Hfq靶點 在調控性sRNAs參與的細菌耐藥網絡中,Hfq發揮著至關重要的作用,Hfq與sRNA結合后可避免sRNA被核糖核酸酶降解,有助于sRNA的穩定,同時促進sRNA-mRNA結合生成環狀蛋白質復合物[36-37]。此外,Hfq作為鮑曼不動桿菌對外界環境壓力的相關應答物質,對幫助細菌在外界環境壓力下生長繁殖具有重要意義[28, 38]。El-Mowafi等[39]發現,RI20這種物質可以抑制Hfq與sRNA的相互作用,從而抑制革蘭陰性致病菌毒力基因的表達,提高細菌對H2O2與抗菌藥物的敏感性。因此,Hfq抑制劑的研發及運用有望成為對抗細菌耐藥的新策略。
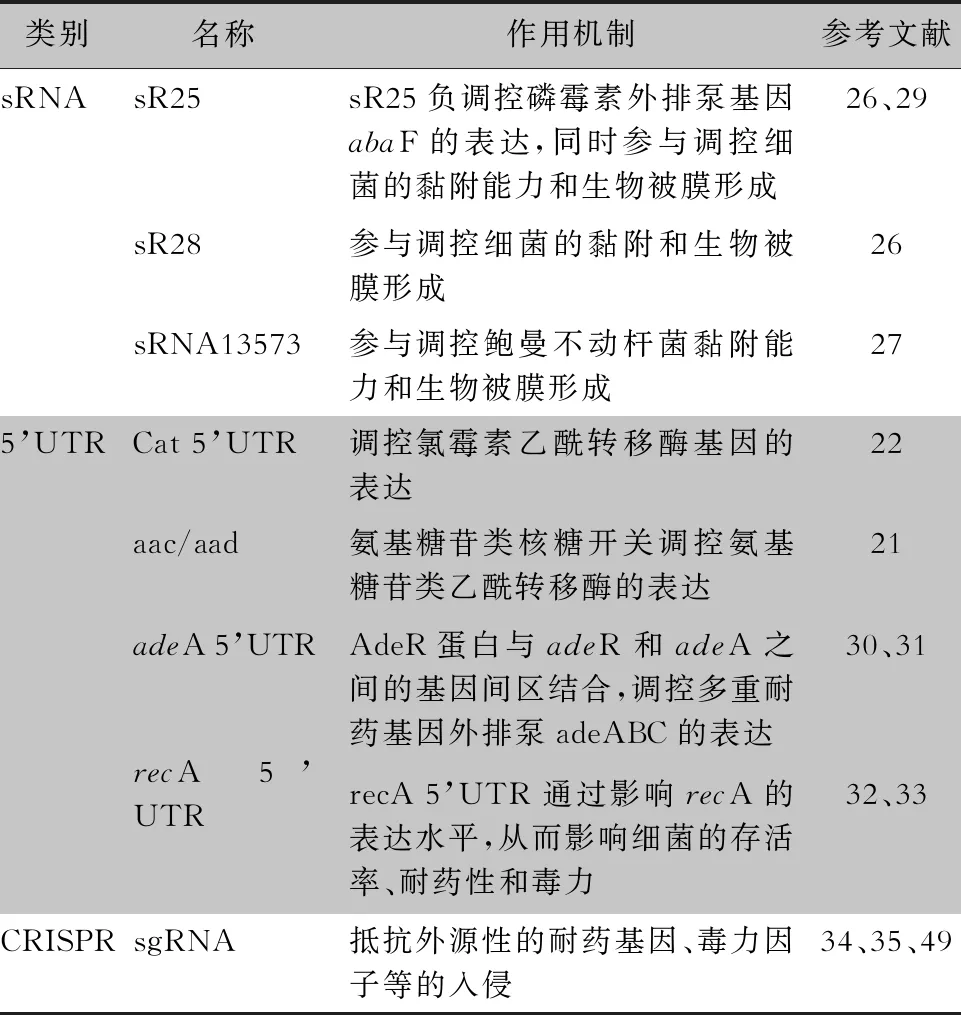
表1 調控性ncRANs對鮑曼不動桿菌耐藥性或毒力的調控機制
3.2 核糖開關靶點 嘌呤合成是細菌繁殖的必需過程,嘌呤核糖開關廣泛存在于細菌當中。鳥嘌呤類似物5,6-三氨基嘧啶-4-酮配體(PC12)可通過結合嘌呤核糖開關抑制金黃色葡萄球菌的生長繁殖[40-41]。類似的核糖開關如黃素單核苷酸(FMN)核糖開關,FMN類似物配體在對抗大腸埃希菌感染時表現出良好的活性[42-44]。核糖開關成為解決日益嚴重耐藥問題的新出口,而這些配體物質與抗菌藥物的聯合運用也是一種抗感染治療的新策略。在鮑曼不動桿菌中為了防止配體與誘導耐藥基因表達的核糖開關(aac/aad)結合,以期設計產生與核糖開關競爭結合但不改變核糖開關結構,不與耐藥基因核糖開關相互作用的新型小分子物質[45]。
3.3 CRISPR/Cas9基因編輯技術 在對抗耐藥基因方面,改造的CRISPR/Cas9 基因編輯技術已成功應用于細菌。Citorik等[46]構建了靶向β-內酰胺酶1(NDM-1)基因的CRISPR/Cas9系統,幫助細菌對抗NDM-1。Kim等[47]運用CRISPR/Cas9系統恢復了產超廣譜β-內酰胺酶(ESBLs)細菌對抗菌藥物的敏感性。Sun等[48]運用CRISPR/Cas9 基因編輯技術成功敲除了大腸埃希菌中粘菌素耐藥基因mcr-1,使其恢復了對多粘菌素的敏感性。寧夏醫科大學總醫院研究人員[49]發明了CRISPR/Cas9系統,成功敲除鮑曼不動桿菌的OXA-23基因,恢復了其對亞胺培南的敏感性。將改造的CRISPR/Cas9系統植入耐藥細菌,并破壞相關耐藥基因,使耐藥菌重新對抗菌藥物敏感,也是一種有效的抗感染策略。
4 結論
鮑曼不動桿菌中的調控性ncRNAs(sRNAs、5’UTR或3’UTR調控元件、CRISPR)具有穩定的莖環或發夾結構,均具有高度保守性,這種特殊的結構與其調控細菌的耐藥性、毒力因子等密切相關[50-52]。ncRNAs在調控鮑曼不動桿菌生物被膜、藥物外排泵、藥物滅活酶、毒力因子等的表達,以及抵抗外源耐藥基因的入侵等方面起著關鍵的作用,從而影響細菌的耐藥性和毒力。因此,ncRNAs極具作為藥物靶點的潛在價值,此外針對Hfq、核糖開關等靶點研發新的抗菌物質,以及開發出適用于鮑曼不動桿菌的CRISPR/Cas生物靶向制劑,都是解決鮑曼不動桿菌耐藥問題的新思路。但是目前對鮑曼不動桿菌中的調控性ncRNAs的研究還處在初期探索階段,大量的調控性ncRNAs,以及其靶基因還有待進一步發現,調控性ncRNAs還通過哪些調控方式參與細菌的耐藥網絡也有待進一步深入研究。近年來,隨著篩選、鑒定ncRNAs,以及預測其靶基因等的分子生物信息學方法與技術的發展[11, 53],將會有更多的調控性ncRNAs及其調控細菌耐藥的相關作用機制會被發現。

