慢羽雞成纖維細胞內源性白血病病毒ev21基因敲除
徐天鵬 吳思樂 溫健 韋義榮 李思佳 謝龍 虞霖田 宋中寶 陸陽清

摘要:【目的】探索在慢羽雞成纖維細胞中敲除ev21基因的可行性,凈化雞群內源性逆轉錄病毒,同時為快速培育缺失ev21基因的慢羽雞配套系打下基礎。【方法】根據ev21基因序列(KY235336)特點,分別在其5'和3'端各設計2個sgRNA,用于構建4種不同sgRNA的打靶質粒,篩選出在5'和3'端打靶效率較高的sgRNA。然后基于CRISPR/Cas9基因編輯技術對ev21基因進行剪切,并通過同源重組方式以紅色熒光蛋白(mCherry)的DNA片段(CAG-mCherry)替換ev21基因,實現對慢羽雞成纖維細胞內源性白血病病毒ev21基因定點敲除。【結果】在慢羽雞成纖維細胞中能檢測到ev21基因,構建的4種sgRNA(sgRNA1~sgRNA4)均能成功插入對應的打靶質粒中,經嘌呤霉素篩選及T7E1酶切檢測,發現轉染4種不同sgRNA打靶質粒后慢羽雞成纖維細胞均有不同程度的死亡,其中又以sgRNA1和sgRNA3的基因敲除效率較高。同時針對同源位點左右同源臂構建表達mCherry的供體質粒,以其轉染293T細胞12 h后均能表達出mCherry。以sgRNA1和sgRNA3打靶質粒及供體質粒共同轉染慢羽雞成纖維細胞,觀察發現成纖維細胞內的mCherry持續表達,至轉染后第30 d通過流式細胞儀分選收集紅色熒光陽性成纖維細胞,并提取其總DNA進行PCR鑒定與基因測序,結果顯示紅色熒光陽性成纖維細胞中有目的片段(CAG-mCherry)插入,即以插入替換方式能實現對ev21基因的敲除。【結論】基于crispr/cas9基因編輯技術的基因敲除方法能成功敲除慢羽雞成纖維細胞內源性白血病病毒ev21基因,為培育缺失ev21基因的慢羽雞品系提供技術支持。
關鍵詞: 慢羽雞;禽白血病病毒(ALV);ev21基因;CRISPR/Cas9;基因敲除
中圖分類號: S831.2 ? ? ? ? ? ? ? ? ? ? ? ? ? ? ?文獻標志碼: A 文章編號:2095-1191(2021)08-2259-08
Knockout of endogenous leukemia gene ev21 in slow
feathering chicken
XU Tian-peng1, WU Si-le1, WEN Jian1,WEI Yi-rong1, LI Si-jia1, XIE Long1,
YU Lin-tian1, SONG Zhong-bao2, LU Yang-qing1*
(1College of Animal Science and Technology, Guangxi University/State Key Laboratory for Conservation and Utilization of Subtropical Agro-bioresources, Nanning ?530005,China; 2Nanning Liangfeng Agriculture and Animal
Husbandry Co., Ltd., Nanning ?530005,China)
Abstract:【Objective】The objective was to explore the feasibility of knockout of ev21 gene in slow feathering chicken fibroblasts for the endogenous retroviruses purification of chicken flocks, and lay a foundation for rapid breeding of slow feathering chicken lines without ev21 gene. 【Method】 Based on the characteristics of ev21 gene sequence(KY235336), two sgRNAs were designed at each of its 5' and 3' ends, respectively, for the construction of four different sgRNA targeting plasmids, and the sgRNAs with higher efficiency at the 5' and 3' ends were screened. Then the ev21 gene was cut based on CRISPR/Cas9 gene editing technology and the ev21 gene was replaced by a DNA fragment of red fluorescent protein(mCherry) (CAG-mCherry) by homologous recombination to achieve targeted knockout of the ev21 gene of endogenous leukemia virus in slow feathering chicken fibroblasts. 【Result】The results showed that the ev21 gene could be detected in slow feathering chicken fibroblasts, and the four constructed sgRNAs(sgRNA1-sgRNA4) could be successfully inserted into the corresponding targeting plasmids. After puromycin screening and T7E1 digestion assay, it was found that slow feathering chicken fibroblasts had different degrees of death after transfection with the four different sgRNAs, among which the knockdown efficiency of sgRNA1 and sgRNA3 was higher. Donor plasmids containing the left and right homology arms and expressing mCherry were also constructed with reference to the homologous site. All 293T cells were able to express mCherry after 12 h transfection with the donor plasmid. Cells were found to consistently express mCherry when slow feathering chicken fibroblasts were co-transfected with sgRNA1 and sgRNA3 targeting plasmids and donor plasmids. Red fluorescent positive fibroblasts were collected by flow cytometry at day 30 after transfection, and their total DNA was extracted for PCR identification and gene sequencing, which showed that the target fragment (CAG-mCherry) was inserted in the red fluorescent positive fibroblasts, and therefore the knockdown of ev21 gene could be achieved by insertion substitution. 【Conclusion】The gene knockout method based on CRISPR/Cas9 gene editing technology can successfully knock out the ev21 gene of endogenous leukemia virus in slow feathering chicken fibroblasts, and provide technical support for breeding slow feathering chicken strains without ev21 gene.
Key words: slow feathering chicken; ?avian leukemia virus(ALV); ev21 gene; CRISPR/Cas9; gene knockout
Foundation item: National Natural Science Foundation of China(31960157); Guangxi University Student Innovation and Entrepreneurship Training Project(201910593306)
0 引言
【研究意義】禽白血病病毒(Avian leukosis virus,ALV)是一種在進化過程中整合到基因組中并隨宿主基因組遺傳復制的內源性反轉錄病毒(Endogenous retroviruses,ERVs)(曹利利等,2020;Mason et al.,2020)。根據寄主、抗體反應和受體的不同,ALV被分為A~J等10個亞群,其中A、B、C、D、E和J亞群的宿主都是雞(劉健等,2019)。A、B、C、D和J亞群為致病性強的外源性病毒,而E亞群(Avian leukosis virus subgroup E,ALVE)是致病性弱的內源性病毒(崔治中,2010)。ALVE的表達除了影響外源病毒感染和疾病發生外,還對家禽的重要經濟性狀產生影響(廖卓鋒等,2019),主要影響其產蛋性能及母源抗體水平(Smith and Fadly,1988)。ALVE不僅可在家禽個體間傳播,還能通過配子將其傳播給下一代,給傳統的凈化選擇手段帶來嚴峻挑戰(Payne and Nair,2012)。ev21基因是ALVE的受體基因,且與羽速基因K緊密連鎖(王麟等,2017)。因此,利用分子生物學的基因編輯技術開展ev21基因敲除研究,對凈化ALVE感染及通過羽速基因鑒別雌雄個體具有重要意義。【前人研究進展】1988年,Bacon等在所有的慢羽雞中發現ev21基因,但在快羽雞中未發現,故推斷ev21基因和慢羽基因K緊密連鎖或慢羽基因K是由野生型快羽基因k+插入ev21基因突變所導致。隨后,Levin和Simth(1990)研究發現,在雞基因組中至少有1個額外的DNA區域與ev21基因整合位點的DNA序列高度同源,且這個同源區域存在ev21插入(OR)和無ev21插入(UR)2種情況。Elferink等(2008)的研究首次從分子水平上解釋ev21基因和慢羽基因K及快羽基因k+間的關系。K基因是由2個與k+基因相同的串聯重復序列構成,且這個重復序列導致K基因上催乳素受體基因(PRLR)及編碼精子鞭毛蛋白2基因(SPEF2)部分重復。K基因上有ev21基因插入,而在k+相同的位置并無ev21基因插入(Elferink et al.,2008)。PRLR和SPEF2基因是控制羽速性狀的良好候選基因(Bu et al.,2013;Zhao et al.,2016)。Takenouchi等(2018)對52個品種1994羽雞進行全面檢測,結果發現幾乎所有的慢羽雞中同時含有ev21基因與PRLR和SPEF2基因不完全重復的片段(ID),并發現幾乎所有的快羽雞都缺少ev21基因和ID,表明ev21基因與慢羽基因的表達無必然聯系。由于ev21基因與K基因緊密連鎖,因此種雞生產上應用快慢羽自別雌雄選淘公雞時無法嚴格凈化ev21基因。【本研究切入點】相對于傳統的翻肛鑒別法,通過羽速基因鑒別雛雞性別具有簡便易行、快速準確及節省勞力的優點,且能避免翻肛鑒別對雛雞產生應激反應和減少疾病傳播。羽速基因與ALVE的ev21基因緊密連鎖,ev21基因的表達會干擾對禽白血病的檢測,雖然自然界存在極少量缺少ev21基因的慢羽個體,但通過篩選育種需要花費大量的人力、物力和時間。【擬解決的關鍵問題】通過CRISPR/Cas9基因編輯技術對慢羽雞成纖維細胞中ALVE的ev21基因進行定點敲除,探索在雞慢羽雞成纖維細胞中敲除ev21基因的可行性,凈化雞群的ERVs,同時為快速培育缺失ev21基因的慢羽雞配套系打下基礎。
1 材料與方法
1. 1 試驗材料
供試種蛋為廣西東蘭烏雞(慢羽雞)和廣西麻雞(快羽雞)的種蛋,TIANamp Genomic DNA Kit(DP304)、0.25%胰酶/EDTA(Gibco/25200-056)、DMEM/F12培養液(Gibco/11320033)、嘌呤霉素(Invitrogen)及Xfect? Transfection Reagent等購自TaKaRa公司;倒置顯微鏡和免疫熒光系統購自日本Olympus公司。
1. 2 雞胚胎成纖維細胞分離及培養
在37 ℃和65%相對濕度條件下將種蛋孵化至第7 d,取出雞胚放入無菌培養皿中,顯微鏡下去除四肢、頭部、內臟和性腺;以無菌PBS洗滌3遍后,用滅菌手術剪剪碎雞胚;加入0.25%胰酶,在37 ℃水浴中消化15 min,每隔5 min振蕩搖晃1次,待其消化完畢加入等量含血清的DMEM/F12培養液終止消化;然后15000 r/min離心10 min,棄上清液,將細胞重懸并接種至細胞培養瓶中,置于37 ℃、5% CO2培養箱進行培養,待細胞融合達90%~95%時進行傳代和凍存處理。
1. 3 引物設計與合成
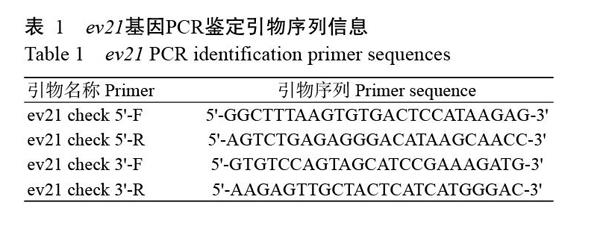
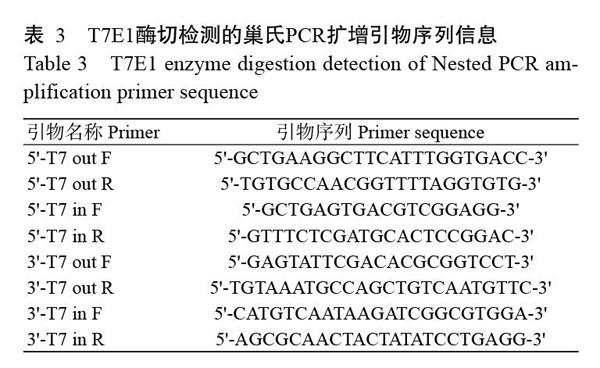
根據NCBI已公布的ev21基因序列(KY235336),分別在ev21基因的5'和3'端各設計1對引物(表1)。同時,在ev21基因5'端設計2個sgRNA(sgRNA1和sgRNA2),在3'端設計2個sgRNA(sgRNA3和sgRNA4),具體序列信息見表2。此外,在5'和3'端打靶位點左右兩側400 bp左右的位置分別設計2對相互包含的巢氏PCR擴增引物(表3),用于sgRNA效率檢測(T7E1酶切檢測);并設計1對引物用于鑒定目的片段(CAG-mCherry)的插入情況,具體序列信息見表4。所有引物合成和測序均委托北京六合華大基因科技公司完成。
1. 4 DNA提取及PCR鑒定
收集快羽雞和慢羽雞的成纖維細胞,使用DNA提取試劑盒(TIANamp Genomic DNA Kit)提取總DNA。為精確檢測陽性細胞基因組DNA編輯情況,采用高保真酶(PrimerSTAR Max DNA Polymerase)在BioRad C1000 PCR儀中進行擴增,PCR反應體系20.0 μL:2×Enzyme Mixed(PrimerSTAR/Tiangene Taq)10.0 μL,DNA模板100 ng,正、反義引物(10 μmol/L)各0.5 μL,ddH2O補足至20.0 μL。擴增程序:98 ℃預變性10 s;98 ℃ 10 s,55~60 ℃ 15 s,72 ℃ 15 s(1000 bp/15 s),進行35個循環;4 ℃結束反應。PCR擴增產物采用2.0%瓊脂糖凝膠電泳進行鑒定。
1. 5 細胞轉染
細胞轉染流程嚴格按照XfectTM Transfection Rea-gent說明進行操作。在6孔板中,每孔質粒用量為8 μg,打靶質粒和供體質粒的用量為1∶1;轉染12 h后將轉染液更換為新鮮的培養液。
1. 6 流式細胞分選
以打靶質粒和供體質粒共轉染慢羽雞成纖維細胞,待對照組(單轉供體質粒)成纖維細胞的紅光完全消失后,通過流式細胞儀分選出攜帶紅色熒光的陽性細胞,接種至培養皿上繼續培養。
2 結果與分析
2. 1 ev21基因插入慢羽雞成纖維細胞基因組的鑒定結果
為鑒定慢羽雞基因組中是否成功插入ev21基因,分別提取慢羽雞和快羽雞的成纖維細胞總DNA進行PCR檢測,結果(圖1)顯示,慢羽雞成纖維細胞基因組DNA在5'和3'端均有1條清晰且單一的條帶,而快羽雞成纖維細胞基因組DNA無任何條帶,說明慢羽雞成纖維細胞基因組中有ev21基因插入。
2. 2 打靶質粒構建情況及sgRNA打靶效率檢測結果
以U6啟動子驅動sgRNA表達,CAG啟動子驅動Cas9蛋白表達,分別構建4種不同sgRNA的打靶質粒,其測序結果顯示4種sgRNA均成功插入對應的打靶質粒中(圖2-A)。為進一步篩選出打靶效率較高的sgRNA,將慢羽雞成纖維細胞分為4組,分別轉染4種不同的sgRNA打靶質粒,經嘌呤霉素篩選48 h后,與轉染前相比,發現各組成纖維細胞均有不同程度的死亡(圖2-B),收集細胞并提取總DNA。采用巢氏PCR擴增目的片段,純化回收的目的片段以T7E1進行酶切,酶切產物經2.0%瓊脂糖凝膠電泳鑒定,結果顯示sgRNA1和sgRNA3的目的條帶灰度較低(圖2-C),說明其基因敲除效率較高。
2. 3 供體質粒構建情況
ev21基因全長7524 bp,包括上、下游序列共9679 bp(圖3-A)。其中,1~970 bp為雞Z染色體序列,970~8500 bp為ev21基因序列(王麒等,2017)。為敲除慢羽雞成纖維細胞中的ev21基因,采取同源重組修復(Homologous recombination repair,HDR)策略,以紅色熒光蛋白(mCherry)的DNA片段(CAG-mCherry)替換整個ev21基因(圖3-B)。針對同源位點左右同源臂構建表達mCherry的供體質粒,供體質粒主要由基本骨架(PUC19)、左端同源臂(HAL)、右端同源臂(HA)和mCherry部分組成,其中mCherry是質粒(XP61)經EcoR V和Age I雙酶切獲得。對供體質粒的左右同源臂進行測序,測序結果顯示左右同源臂無突變(圖3-C),即成功構建獲得供體質粒。
2. 4 ev21基因敲除及鑒定結果
為探索在慢羽雞成纖維細胞敲除內源性ev21基因的可能性,將慢羽雞成纖維細胞分為試驗組和對照組,試驗組成纖維細胞共同轉染sgRNA1和sgRNA3打靶質粒及供體質粒,對照組成纖維細胞僅轉染供體質粒。轉染后48 h觀察發現,對照組和試驗組均有部分成纖維細胞表達出mCherry(圖4-A);轉染后第7 d,對照組成纖維細胞的紅色熒光基本消失,而試驗組中紅色熒光比例的成纖維細胞越來越多(圖4-B);至轉染后第10 d,對試驗組的成纖維細胞進行流式細胞分選,收集攜帶紅色熒光的陽性細胞;轉染后第30 d,試驗組成纖維細胞內的mCherry持續表達(圖4-C),說明CAG-mCherry已成功整合到慢羽雞成纖維細胞基因組中,即成功建立了穩定表達mCherry的細胞系。
為鑒定紅色熒光陽性成纖維細胞中ev21基因的敲除情況,分別在跨基因組和插入片段(CAG-mCherry)的5'和3'端設計特異性擴增引物,通過流式細胞儀分選收集轉染后第30 d的紅色熒光陽性成纖維細胞,提取其總DNA進行PCR鑒定,結果(圖4-D)顯示紅色熒光陽性成纖維細胞中有CAG-mCherry插入。同時對sgRNA的靶位點進行測序,結果(圖4-E)顯示靶位點附近的序列與預測結果一致,說明基于CRISPR/Cas9基因編輯技術通過插入替換方式能成功實現對ev21基因的敲除。
3 討論
雞是從紅色原雞進化而來,為最常見的家養動物之一。在長期進化的過程中,雞一直面臨著病原微生物的威脅與浸染。病原侵染不僅引發動物疾病,還會導致動物機體的基因組發生改變,包括基因(堿基或片段)的插入、缺失及突變等(Wildschutte et al.,2016)。基因組改變進而造成表型性狀發生改變,導致疾病發生、生長性能和繁殖性能下降及適應性降低等。Wang等(2016)研究發現,在ZNF132基因中插入16 bp堿基會顯著影響海南黑山羊的體長;Zang等(2016)研究證實,DGAT2基因3'-UTR發生13 bp插入突變后,會影響豬的背膘厚度及瘦肉率;Wei等(2018)研究表明,將19 bp堿基插入PLAGI基因會導致牛的生長性能下降。有關雞的研究表明,CDKN3基因啟動子區域多等位基因插入后會影響其生長性能和屠宰性狀(Li et al.,2018);ZNF764L基因發生22 bp插入與雞的初生重、胸寬及體斜長密切相關(Han et al.,2019);雞PTH1R基因第1個內含子中51 bp堿基插入突變與其生長和屠宰性能密切相關(Ren et al.,2020)。可見,動物基因組中發生插入或缺失突變會影響其生產性能。
病毒是導致雞基因組發生改變的重要因素之一,特別是逆轉錄病毒。內源性逆轉錄病毒EAV-HP插入并整合到雞SLCO1B3基因5'-UTR,會導致SLCO1B3基因在雞輸卵管蛋殼腺中高表達,致使雞生產綠殼蛋(Wang et al.,2013)。Park等(2013)研究表明,ALV插入并整合到TYR基因第4個內含子會導致TYR基因逆轉錄本功能失活,從而形成隱形白突變。ALV是一種典型的逆轉錄病毒,自1908年首次分離獲得以來,全球許多國家均有暴發流行,其垂直和水平傳播引起的臨床和亞臨床感染給養禽業造成巨大經濟損失(劉公平等,2000;余河玲等,2020)。經過幾十年的探索與研究,雖然已取得一定成績,但禽白血病尚未得到有效遏制,仍需耗費大量人力和物力去篩選及淘汰攜帶病毒的雞群。本研究首次嘗試以基因編輯技術探索解決禽白血病對家禽養殖產業的危害,在分離培養的慢羽雞成纖維細胞中檢測出ev21基因,并成功構建獲得4種sgRNA的打靶質粒和供體質粒;以基因敲除效率較高的sgRNA1和sgRNA3打靶質粒和供體質粒共同轉染慢羽成纖維細胞,轉染后第30 d采用流式細胞儀分選收集攜帶紅色熒光的陽性細胞,即得到穩定表達mCherry的細胞系;隨后通過PCR擴增與基因測序相結合的方法在sgRNA靶位點檢測到目的片段(CAG-mCherry)精準插入,且以插入替換方式成功實現對ev21基因的敲除。可見,在體外培養的慢羽雞成纖維細胞中敲除內源性白血病病毒ev21基因具有可行性,可為培育缺失ev21基因的慢羽雞品系提供技術支持。
4 結論
基于CRISPR/Cas9基因編輯技術的基因敲除方法能成功敲除慢羽雞成纖維細胞內源性白血病病毒ev21基因,為培育缺失ev21基因的慢羽雞品系提供技術支持。
參考文獻:
曹利利,董航,郭衍冰,姜旭,姚新華,苑淑賢,邵洪澤,宋建臣,賈立軍. 2020. 禽白血病病毒ELISA檢測方法的建立與初步應用[J]. 中國動物傳染病學報,28(1):16-21. [Cao L L,Dong H,Guo Y B,Jiang X,Yao X H,Yuan S X,Shao H Z,Song J C,Jia L J. 2020. Development and preliminary application of ELISA method for detection of avian leukosis virus[J]. Chinese Journal of Animal Infectious Diseases,28(1):16-21.]
崔治中. 2010. 雞白血病及其鑒別診斷和預防控制[J]. 中國家禽,32(8):1-12. [Cui Z Z. 2010. Differential diagnosis,prevention and control of avian leukosis[J]. China Poultry,32(8):1-12.]
廖卓鋒,劉永,謝強明,楊柳平,楊潤. 2019. 禽白血病研究進展[J]. 當代畜牧,(8):65-67. [Liao Z F,Liu Y,Xie Q M,Yang L P,Yang R. 2019. Development in avian leucosis research[J]. Contemporary Animal Husbandry,(8):65-67.]
劉公平,趙振芬,劉福安. 2000. 禽白血病病毒研究進展[J]. 中國獸醫學報,20(6):621-623. [Liu G P,Zhao Z F,Liu F A. 2000. Advance of research on avian lekosis virus[J]. Chinese Journal of Veterinary Science,20(6):621-623.] doi:10.3969/j.issn.1005- 4545.2000.06.030.
劉健,李凱航,鞠厚斌,李鑫,葛菲菲,楊德全,楊顯超,葛杰,鄧波,周錦萍. 2019. 七彩山雞內源性禽白血病病毒的檢測與env基因序列分析[J/OL]. 中國動物傳染病學報. http://kns.cnki.net/kcms/detail/31.2031.S.20190917.1522. 051.html. [Liu J,Li K H,Ju H B,Li X,Ge F F,Yang D Q,Yang X C,Ge J,Deng B,Zhou J P. 2019. Detection and env gene analysis of endogenous avian leukosis virus from phasianus colchicas[J/OL]. Chinese Journal of Animal Infectious Diseases. http://kns.cnki.net/kcms/detail/31.2031.S.20190917.1522.051.html.]
王麒,王晗,張秀玲,劉春楊,張樂超,李蘭會,李祥龍. 2017. 雞內源白血病病毒ev21與慢羽非連鎖分析和LTR區啟動子活性分析[J]. 畜牧獸醫學報,48(5):930-937. [Wang Q,Wang H,Zhang X L,Liu C Y,Zhang L C,Li L H,Li X L. 2017. Analysis of non-linkage between endogenous ALV-ev21 and late feathering of chickens and its promo-ter activity of LTR[J]. Acta Veterinaria et Zootechnica Sinica,48(5):930-937.] doi:10.11843/j.issn.0366-6964. 2017.05.018.
余河玲,朱師良,何啟牮,王彥. 2020. PDPK1 3'UTR雙熒光素酶報告載體的構建及與gga-miR-148a-5p的靶向驗證[J]. 江蘇農業學報,36(1):147-151. [Yu H L,Zhu S L,He Q J,Wang Y. 2020. Construction of PDPK1 3'UTR dual luciferase reporter vector and targeting verification with gga-miR-148a-5p[J]. Jiangsu Journal of Agricultural Sciences,36(1):147-151.] doi:10.3969/j.issn.1000-4440. 2020.01.020.
Bacon L D,Smith E,Crittenden L B,Havenstein G B. 1988. Association of the slow feathering(K) and an endogenous viral(ev21) gene on the Z chromosome of chickens[J]. Poultry Science,67(2):191-197. doi:10.3382/ps.0670 191.
Bu G X,Huang G,Fu H,Li J,Huang S M,Wang Y J. 2013. Characterization of the novel duplicated PRLR gene at the late-feathering K locus in Lohmann chickens[J]. Journal of Molecular Endocrinology,51(2):261-76. doi:10. 1530/JME-13-0068.
Elferink M G,Vallée A A A,Jungerius A P,Crooijmans R P M A,Groenen M A M. 2008. Partial duplication of the PRLR and SPEF2 genes at the late feathering locus in chicken[J]. BMC Genomics,9(1):391. doi: 10.1186/1471-2164-9-391.
Han R L,Wang X N,Wang X L,Guo Y P,Li D H,Li G X,Wang Y B,Kang X T,Li Z J. 2019. Chicken ZNF764L gene:mRNA expression profile,alternative splicing analysis and association analysis between first exon indel mutation and economic traits[J]. Gene,695:92-98. doi:10. 1016/j.gene.2019.02.010.
Levin I,Smith E J. 1990. Molecular analysis of endogenous virus ev21-slow feathering complex of chickens. 1. Cloning of proviral-cell junction fragment and unoccupied integration site[J]. Poultry Science,69(11):2017-2026. doi: 10. 3382/ps.0692017.
Li W Y,Liu D L,Tang S Q,Li D H,Han R L,Tian Y D,Li H,Li G X,Li W T,Liu X J,Kang X T,Li Z J. 2018. A multiallelic indel in the promoter region of the Cyclin-dependent kinase inhibitor 3 gene is significantly associated with body weight and carcass traits in chickens[J]. Poultry Science,98(2):556-565. doi:10.3382/ps/pey404.
Mason A S,Lund A R,Hocking P M,Fulton J E,Burt D W. 2020. Identification and characterisation of endogenous avian leukosis virus subgroup E(ALVE) insertions in chi-cken whole genome sequencing data[J]. Mobile DNA,11: 22. doi:10.1186/s13100-020-00216-w.
Park M N,Kim T H,Lee J H,Choi J A,Heo K N,Kim C D,Choo H J,Han J Y,Lee T,Lee J H,Lee K T. 2013. Genetic variations of chicken TYR gene and associations with feather colorof Korean Native Chicken(KNC)[J]. Korean Journal of Poultry Science,40(2):139-145. doi:10.5536/KJPS.2013.40.2.139.
Payne L N,Nair V. 2012. The long view:40 years of avian leukosis research[J]. Avian Pathology,41(1):11-19. doi:10.1080/03079457.2011.646237.
Ren T,Zhang Z,Fu R,Yang Y,Li W,Liang J,Mo G,Luo W,Zhang X. 2020. A 51 bp indel polymorphism within the PTH1R gene is significantly associated with chicken growth and carcass traits[J]. Animal Genetics,51(4):568-578. doi:10.1111/age.12942.
Smith E J,Fadly A M. 1988. Influence of congenital transmission of endogenous virus-21 on the immune response to avian leukosis virus infection and the incidence of tumors in chickens[J]. Poultry Science,67(12):1674-1679. doi:10.3382/ps.0671674.
Takenouchi A,Toshishige M,Ito N,Tsudzuki M. 2018. Endogenous viral gene ev21 is not responsible for the expression of late feathering in chickens[J]. Poultry Scien-ce,97(2):403-411. doi:10.3382/ps/pex345.
Wang X,Yang Q,Luo J,Wang Y,Feng Q,Zhang Z H,Lei C Z,Chen H,Lan Y F. 2016. Novel 16-bp insertion/deletion variant of ZNF132 gene and its influence on growth traits in goats[J]. Journal of Animal & Plant Sciences,26:1813-1818.
Wang Z P,Qu L J,Yao J F,Yang X L,Li G,Zhang Y Y,Li J Y,Wang X T,Bai J R,Xu G Y,Deng X M,Yang N,Wu C X. 2013. An EAV-HP insertion in 5' flanking region of SLCO1B3 causes blue eggshell in the chicken[J]. PLoS Genetics,9(1):e1003183. doi:10.1371/journal.pgen.100 3183.
Wei X,Hua H,Li Z,Xu J W,Lei C Z,Zhang G M,Dang R H,Niu H,Qi X L,Chen H,Huang Y Z. 2018. Detection of 19-bp deletion within PLAG1 gene and its effect on growth traits in cattle[J]. Gene,675:144-149. doi:10.1016/ j.gene.2018.06.041.
Wildschutte J H,Williams Z H,Montesion M,Subramanian R P,Kidd J M,Coffin J M. 2016. Discovery of unfixed endogenous retrovirus insertions in diverse human populations[J]. Proceedings of the National Academy of Scien-ces of the United States of America,113(16):E2326- E2334. doi:10.1073/pnas.1602336113.
Zang L,Wang Y D,Sun B X,Zhang X,Yang C H,Kang L,Zhao Z H,Jiang Y L. 2016. Identification of a 13 bp indel polymorphism in the 3'-UTR of DGAT2 gene associa-ted with backfat thickness and lean percentage in pigs[J]. Gene,576(2):729-733. doi:10.1016/j.gene.2015.09. 047.
Zhao J,Yao J,Li F,Yang Z,Sun Z,Qu L,Wang K,Su Y,Zhang A,Montgomery S A,Geng T,Cui H. 2016. Identification of candidate genes for chicken early- and late-feathering[J]. Poultry Science,95(7):1498-1503. doi:10.3382/ps/pew131.
(責任編輯 蘭宗寶)
收稿日期:2020-07-20
基金項目:國家自然科學基金項目(31960157);廣西大學大學生創新創業訓練計劃項目(201910593306)
通訊作者:陸陽清(1976-),https://orcid.org/0000-0003-1641-6142,博士,研究員,主要從事干細胞及動物繁殖生物技術研究工作,E-mail:lyq@gxu.edu.cn
第一作者:徐天鵬(1995-),https://orcid.org/0000-0003-0175-0295,研究方向為動物遺傳育種與繁殖,E-mail:1491159801@qq.com

