3-羥基糖取代對槲皮素與人血清蛋白相互作用的影響
傅俏琴,張露*,賈曉燕,馬天新,涂宗財,2
1(江西師范大學 國家淡水魚加工技術研發專業中心和江西省淡水魚高值化利用工程技術研究中心,江西 南昌,330022) 2(南昌大學 食品科學與技術國家重點實驗室,江西 南昌,330047)
黃酮類化合物是普遍存在于各類蔬菜、水果、谷物和中草藥中的主要活性成分,根據3-羥基取代類型和C-環結構差異,黃酮類化合物又可進一步分為黃酮類、黃酮醇類、黃烷酮類、查耳酮類、黃烷醇類和花青素類等,黃酮醇類是植物中最為普遍的一類黃酮類化合物[1]。研究表明,黃酮類化合物具有預防高血壓、高血脂、炎癥、心血管疾病和衰老等一系列慢性疾病發生和發展的能力[2],高的黃酮膳食攝入與糖尿病[3]、癌癥[4]的發生率呈負相關。但黃酮類化合物的生物利用率和功能活性受其與其他生物大分子的相互作用的影響,如槲皮素、蘆丁和兒茶素與血漿蛋白的相互作用會降低其抗氧化活性[5],但β-乳球蛋白-姜黃素的相互作用會提高姜黃素的抗氧化活性[6],牛奶蛋白和大豆蛋白與沒食子酰兒茶素混合后會降低其生物利用率,但對非沒食子酰兒茶素無影響[7]。闡明食品營養成分與生物大分子的相互作用是食品營養學和食品科學,尤其是食品營養成分遞送領域的重要研究內容之一。
人血清蛋白(human serum albumin,HSA)是人血漿中含量最豐富的重要載體蛋白,由585個氨基酸組成,分子質量約為6.65 kDa。HSA的三維構象由區域I(1~195位氨基酸殘基)、區域II(196~383位氨基酸殘基)和區域III(384~585位氨基酸殘基)這3個相似的螺旋亞基通過物理作用松散結合在一起組成,具有貯存與轉運內源性代謝產物和外源性活性小分子到達靶組織的作用,是血液中活性小分子傳送的重要運輸載體蛋白[8]。營養活性成分與載體蛋白的結合能力決定其被吸收后在血液中的釋放和活性濃度,并為功效保持提供保障,因此,活性分子與載體蛋白的相互作用對其在體內的轉運、分布、降解、代謝和毒理特性有重要影響[9],是分析其生物活性的重要基礎,也是闡明食品營養與功效作用的第一步。目前,已有許多學者研究天然活性小分子與血清蛋白相互作用,如槲皮素與HSA的相互作用[10]、鞣花酸和橄欖苦苷與HSA的相互作用[11],ANAS等[12]也研究發現迷迭香與HSA的相互作用會改變HSA的構象結構,降低HSA的糖基化反應活性。
槲皮素是最為常見的黃酮醇類化合物,主要以糖苷形式存在,如槲皮素-蕓香糖苷、槲皮素-六碳糖苷、槲皮素-葡萄糖醛酸、槲皮素-鼠李糖苷、槲皮素-五碳糖苷等,具有抗炎、抗腫瘤、心血管保護和提高免疫力等保健作用[2-4]。目前已有許多關于黃酮的糖取代類型和位置對其功能活性的影響,但不同的糖取代對黃酮類化合物與血漿蛋白的結合和相互作用的影響還未見報道。因此,本文以槲皮素和4種常見的槲皮素糖苷(蘆丁、異槲皮素、槲皮素-3-O-木糖苷、槲皮素-3-O-鼠李糖苷)為研究對象,采用熒光滴定、同步熒光和分子對接技術研究這5種黃酮與HSA的相互作用,通過Sterm-Volmer和Double logarithmic方程,結合同步熒光光譜變化,分析熒光淬滅類型、熱力學參數、結合常數和結合位點數差異,并通過分子對接技術研究槲皮素及槲皮素糖苷與HSA結合區域與結合位點變化,最終闡述槲皮素上3-羥基的五碳糖、脫氧六碳糖、六碳糖和二糖取代對槲皮素與HSA相互作用的影響,為黃酮類化合物的功能活性分析提供理論基礎。
1 實驗方法
1.1 試劑和儀器
人血清白蛋白,美國sigma公司;槲皮素(quercetin,Que)、異槲皮素(quercetin-3-O-glucoside,Q3G)、蘆丁(quercetin-3-O-rutinoside,Q3Ru)(純度>95%),北京索萊寶科技有限公司;槲皮素-3-O-木糖苷(quercetin-3-O-xyloside,Q3X)(純度98%),成都普瑞法科技開發有限公司;槲皮素-3-O-鼠李糖苷(quercetin-3-O-rhamnoside,Q3Rh)(純度98%),深圳菲斯生物科技有限公司。
F-7000熒光光譜儀,日本Hatachi公司;BLD-FSN-ENT5高精度恒溫循環水槽,昆山佰利達實驗設備有限公司;FA1104 N型電子分析天平,上海丙林電子科技有限公司。
1.2 熒光滴定實驗
采用熒光滴定的方法分別測定溫度為298、304和310 K時,研究不同濃度的黃酮溶液對HSA在激發波長280 nm,發射波長為300~400 nm時的熒光發射光譜的影響。向3.0 mL 0.25 mg/mL的HSA溶液(50 mmol/L,pH 7.4磷酸鹽緩沖鹽水配制)中逐步滴加0.5 mmol/L的Que、Q3X、Q3Rh、Q3G和Q3Ru溶液,混勻后在對應測定溫度條件下反應3 min,最后測HSA的熒光發射光譜,掃描電壓為700 V,狹縫寬度為2.5 nm,掃描速度為1 200 nm/min。反應體系中黃酮溶液的濃度分別為0.0、0.83、1.66、2.47、3.29、4.10、4.91、5.70、6.49 μmol/L。
化合物淬滅HAS熒光的淬滅速率常數Kq可以通過Stern-Volmer方程根據公式(1)進行計算[11]:
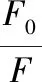
(1)
式中:F和F0分別為含和不含黃酮樣品時HAS的熒光強度;c,黃酮的濃度;Ksv,Stern-Volmer淬滅常數;τ0,不存在淬滅劑時HAS的平均熒光壽命,10-8s。
黃酮醇樣品與HAS相互作用的結合常數(Ka)和結合位點數(n)可通過Double logarithmic方程根據公式(2)計算[12]:
(2)
式中:F0和F分別為不加和加抑制劑時HSA的熒光強度;c,反應體系中黃酮的濃度,mol/L。
1.3 同步熒光分析
采用F-7000熒光光譜儀測定不同濃度的黃酮溶液對HSA同步熒光光譜的影響[13]。發射波長(λEm)與激發波長(λEx)差值(Δλ)為60 nm時,激發光譜掃描范圍為250~320 nm,熒光發射起始波長為310 nm;Δλ=15 nm時,熒光發射起始波長為280 nm,激發光譜掃描范圍為265~350 nm。HSA質量濃度為0.50 mg/mL,測定溫度為310 K,掃描速度為1 200 nm/min,掃描電壓為700 V,狹縫寬度為2.5 nm,反應體系中黃酮溶液的濃度為0.0~12.99 μmol/L。
1.4 分子對接分析
采用AutoDockTools 1.5.6分別對HSA和Que、Q3X、Q3Rh、Q3G、Q3Ru的相互作用進行分析。HSA的三維結構(1H9Z)從Protein Data Bank上下載(https://www.rcsb.org/),然后依次用Pymol和AutoDockTools 1.5.6進行去水、加氫、計算電荷和合并非極性氫等處理,保存為pdbqt格式文件。Que、Q3X、Q3Rh、Q3G和Q3Ru的三維結構用ChemBio3D Ultra 14.0繪制,能量最優后保存為pdb文件,最后保存為pdbqt格式文件用于對接。對接盒子中心坐標為(20.853,9.572,-19.114),對接盒子XYZ各方向的格點數設為100×100×120,格點間距為0.375 ?[10-11],采用Lamarckkian GA遺傳算法對接150次,其余參數采用默認值。對接結果采用AutoDockTools和Discovery Studio進行分析和處理。
1.5 數據分析
所有數據采用Excel軟件進行處理,熒光掃描圖譜用Origin 2019b繪制,分子對接圖譜采用Discovery Studio 2017 R2 Client繪制。
2 結果與分析
2.1 內源熒光光譜分析
熒光光譜技術是研究小分子對蛋白構象結構的影響,以及小分子與蛋白質相互作用動力學的重要工具,目前已經廣泛被用于研究藥物與靶標蛋白[14]、活性功能因子與血漿蛋白[15]、活性小分子與食品蛋白[16]的相互作用。Que、Q3X、Q3Rh、Q3G和Q3Ru對HSA內源熒光光譜的影響如圖1所示。當0.83、1.66、2.47、3.29、4.10、4.91、5.70、6.49 μmol/L黃酮醇添加到HSA溶液中后,HSA的內源熒光強度均顯著下降,且其最大熒光發射波長也均出現了明顯藍移。當濃度為6.49 μmol/L時,HSA的內源熒光強度分別下降了57.70%、27.46%、30.18%、33.84%、25.90%,最大熒光發射波長分別減少了1.6、4.6、2.2、5.2、3.2 nm。說明Que、Q3X、Q3Rh、Q3G和Q3Ru均能導致HSA構象結構的展開,改變HSA的空間構象,且3-羥基糖取代會降低槲皮素對HSA的熒光淬滅效果,蕓香糖和木糖取代的槲皮素糖苷的熒光淬滅效果最弱。另外,添加Q3G后,HSA的最大熒光發射波長偏移量最大,因此,葡萄糖取代增強槲皮素對HSA中熒光性氨基酸微環境的影響。
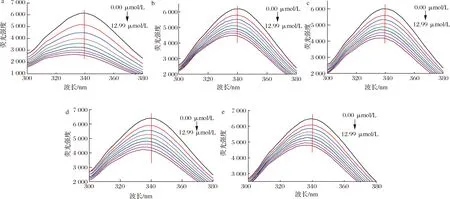
a-槲皮素;b-槲皮素-3-O-木糖苷;c-槲皮素-3-O-鼠李糖苷;d-異槲皮素;e-蘆丁圖1 五種黃酮對HSA內源熒光光譜的影響Fig.1 Effect of five flavonoids on the intrinsic fluorescence spectra of HAS
2.2 熒光淬滅機制分析
動態淬滅、靜態淬滅和混合型淬滅是活性小分子淬滅蛋白熒光的作用機制,對于動態淬滅過程,其Kq值通常會隨溫度升高而增大;對于靜態淬滅過程,熒光淬滅速率常數Kq會隨反應溫度的升高而減小,且其值大于最大擴散碰撞淬滅常數2.0×1010L/(mol·s)[16]。但很多文獻表明,Kq值隨溫度升高而增大,但其值遠高于2.0×1010L/(mol·s)時,也可認定淬滅機制為靜態淬滅[13]。
在溫度298、304、310 K的條件下,HSA與Que、Q3X、Q3Rh、Q3G和Q3Ru相互作用的Stern-Volmer圖如圖2所示,其Ksv和Kq值如表1所示。由圖2可知,5種黃酮的Stern-Volmer圖均呈很好的線性關系(R2>0.99)說明Que、Q3X、Q3Rh、Q3G和Q3Ru都是通過單一方式淬滅HSA的內源熒光[17]。由表1可知,Que、Q3X、Q3Rh、Q3G和Q3Ru對HSA的熒光淬滅速率常數Kq均隨溫度的升高逐漸下降,分別由298 K的28.63×1012、6.31×1012、7.62×1012、8.42×1012、5.82×1012L/(mol·s),降低至310 K的21.04×1012、5.78×1012、6.39×1012、7.78×1012、5.15×1012L/(mol·s),且值均大于2.0×1010L/(mol·s),說明Que、Q3X、Q3Rh、Q3G和Q3Ru通過靜態方式淬滅HSA的熒光。
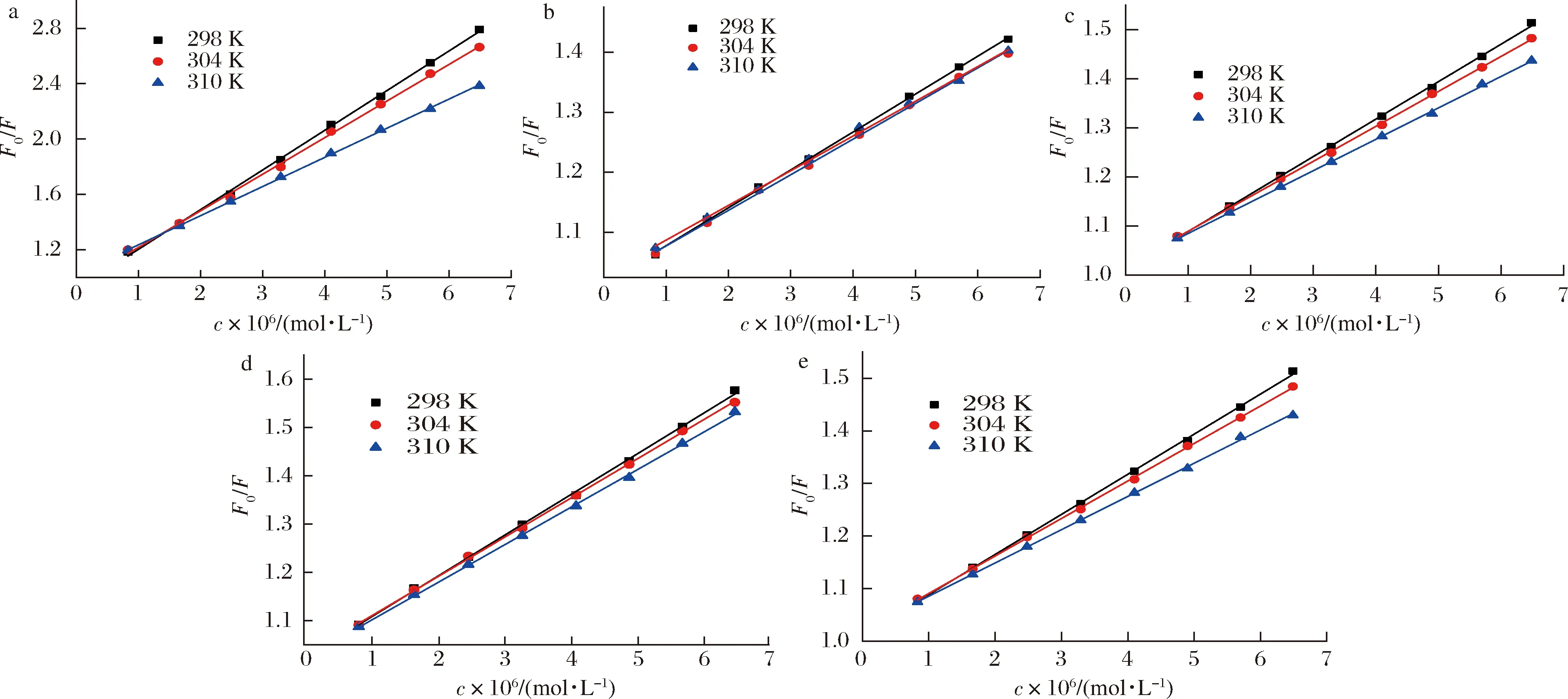
a-槲皮素;b-槲皮素-3-O-木糖苷;c-槲皮素-3-O-鼠李糖苷;d-異槲皮素;e-蘆丁圖2 五種黃酮淬滅HSA熒光的Stern-Volmer圖Fig.2 The Stern-Volmer plot of five flavonoids quenching HSA intrinsic fluorescence spectra
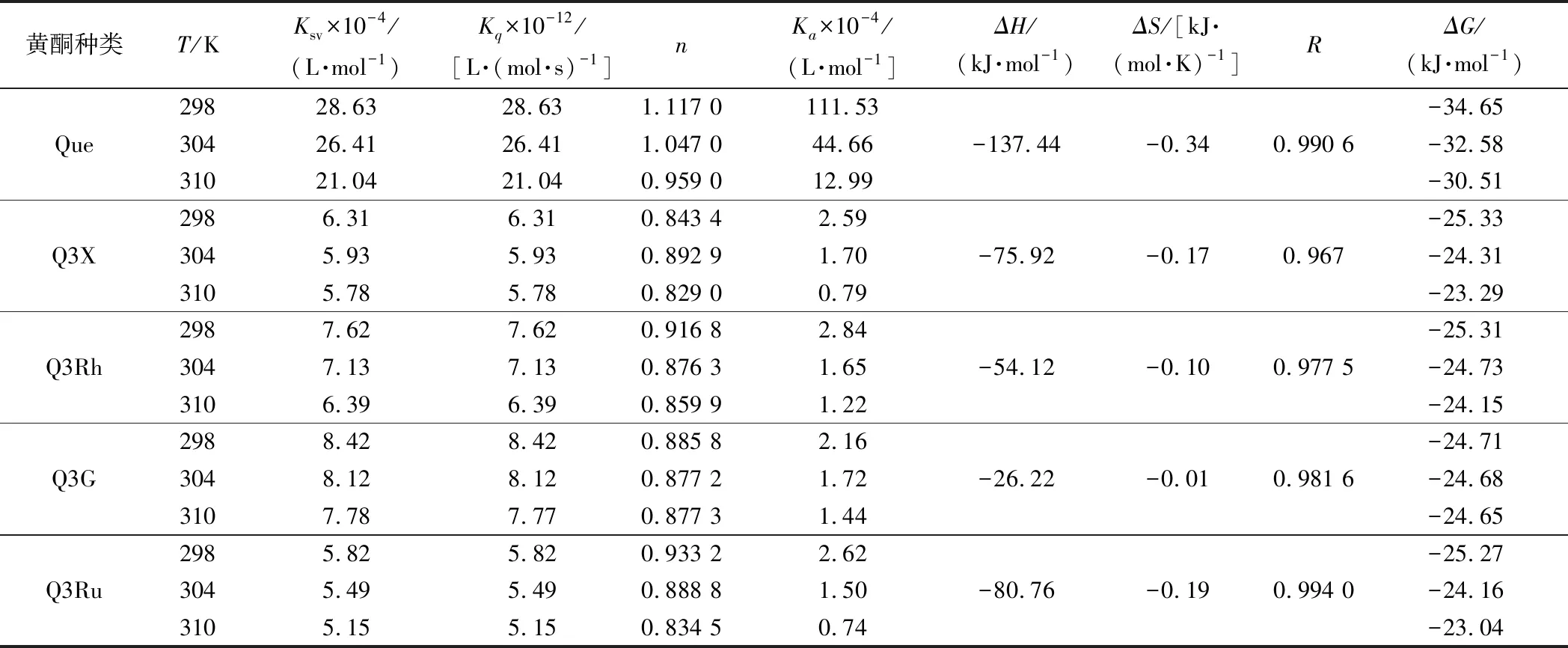
表1 五種黃酮與HSA在298、304和310 K條件下相互作用的結合常數和熱力學參數Table 1 The binding constants and thermodynamic parameters for the interaction of HSA with five flavonoids at 298,304 and 310 K
2.3 結合常數和結合位點數分析
根據方程(2)的斜率和截距計算不同溫度下黃酮樣品與HSA相互作用的結合常數(Ka)和結合位點數(n),結果如表1所示。由表可知,Q3X、Que、Q3Ru、Q3G和Q3Rh與HSA結合的位點數n接近于1,且在溫度為298 K時,5個黃酮與HSA相互作用的結合常數Ka值均大于2.16×104L/mol,說明5個黃酮均是通過1∶1的摩爾比與HSA結合,形成穩定的復合物[17]。所有樣品的Ka均隨反應溫度的增加呈下降趨勢,說明Q3Ru-HSA、Q3X-HSA、Q3Rh-HSA、Q3G-HSA和Que-HSA復合物的穩定性均隨著反應溫度的增加而降低,這些復合物的形成均為放熱過程[18]。另外,Que與HSA相互作用的Ka值最大,其次為Q3G,Q3Ru最小,說明Que與HSA的結合能力最強,3-羥基的木糖、鼠李糖、葡萄糖和蕓香糖取代均會降低Que與HSA的結合能力以及形成的復合物的穩定性。
2.4 熱力學參數分析
槲皮素和槲皮素糖苷與HSA相互作用的熱力學參數焓變(ΔH)、熵變(ΔS)和自由能變化(ΔG)可通過用van’t Hoff方程計算[19],計算如公式(3)、公式(4)所示:
lnKa=-ΔH/RT+ΔS/R
(3)
ΔG=ΔH-TΔS
(4)
式中:R,氣體常數8.314 J/(mol·K);T,反應絕對溫度(298、304、310 K);Ka,對應溫度條件下槲皮素、槲皮素糖苷與HSA的結合常數。
根據公式(3)計算出的ΔH、ΔS和ΔG如表1所示。活性小分子與蛋白質之間的作用力主要有氫鍵、疏水相互作用、范德華力和靜電斥力,當ΔH<0,ΔS<0時,氫鍵和范德華力為小分子與蛋白質之間的主要作用力;ΔH>0,ΔS>0時,疏水相互作用為主要作用力;ΔH<0,ΔS>0時,靜電相互作用為主要作用力[13]。
Que、Q3X、Q3Rh、Q3G、Q3Ru與HSA結合的ΔH分別為-137.44、-75.92、-54.12、-26.22、-80.76 kJ/mol,ΔS分別為-0.34、-0.17、-0.10、-0.01、-0.19 kJ/(mol·K),表明Que-HSA、Q3X-HSA、Q3Rh-HSA、Q3G-HSA和Q3Ru-HSA復合物形成的主要驅動力均為氫鍵和范德華力,不同糖取代不會影響槲皮素與HSA主要相互作用力類型的變化。另外,ΔG為負值,且其值隨反應溫度的增加而上升,說明復合物的穩定性均隨著溫度的升高而降低,進一步證明Que/Q3X/Q3Rh/Q3G/Q3Ru-HSA復合物形成的過程是一個自發的放熱過程[20]。另外,相同溫度條件下,Que-HSA復合物的穩定性最高,Q3G-HSA復合物的穩定性最差,表明糖取代降低復合物的穩定性。
2.5 同步熒光光譜分析
槲皮素及槲皮素糖苷對HSA同步熒光光譜的影響如圖3所示,Δλ為15和60 nm時獲得的熒光光譜分別反映的是酪氨酸和色氨酸微環境和極性的變化,激發波長向長波方向偏移,表明色氨酸/酪氨酸殘基所處微環境的疏水性降低,極性增強;向短波方向偏移,則說明色氨酸/酪氨酸殘基微環境的疏水性增強,極性降低[13,21]。
Δλ固定為15 nm時,HSA的最大激發波長為286.4,Que、Q3X、Q3Rh、Q3G和Q3Ru對HSA的最大激發波長影響較小,激發波長增量僅為0.2~0.6 nm;當Δλ為60 nm時,添加Q3X、Q3Rh、Q3G和Q3Ru使HSA的最大激發波長發生了明顯紅移,波長增量分別是1.4、2.0、2.4、1.6 nm,但Que對HSA的最大激發波長無顯著影響。說明Q3X、Q3Rh、Q3G和Q3Ru可顯著增加色氨酸微環境的極性,使色氨酸暴露在更加親水的環境中,但對酪氨酸微環境極性的影響很小,Que不會誘導HSA中酪氨酸和色氨酸殘基周圍微環境極性的變化[22]。許多研究也發現,活性小分子可以誘導蛋白上色氨酸微環境極性的變化,但對色氨酸微環境極性變化影響較小,如LI等[16]發現,芹菜素、柚皮素、山奈酚和染料木素的添加促使β-乳球蛋白中色氨酸微環境的極性增加,但對酪氨酸的微環境的極性無顯著影響。DAN等[13]研究表明川陳皮素可誘導β-乳球蛋白上色氨酸殘基熒光發射波長的紅移,但對酪氨酸殘基的熒光發射波長無影響。綜上可知,糖取代降低了槲皮素對HSA的熒光淬滅效果和構象的改變,但可增加Que對HSA上酪氨酸和色氨酸微環境極性的影響,其中葡萄糖的效果最強,木糖最小。
2.6 分子對接
分子對接是廣泛用于分析小分子與蛋白質之間相互作用的一種計算機模擬技術,可以預測小分子配體與蛋白等大分子受體之間的作用力、結合區域和結合位點。如圖4所示,Que、Q3X、Q3Rh、Q3G和Q3Ru分別結合在HSA上由13、14、18、14和20個氨基酸組成的疏水腔中,氫鍵、疏水相互作用和范德華力為Que-HSA、Q3X-HSA、Q3Rh-HSA、Q3G-HSA和Q3Ru-HSA復合物形成的主要作用力,形成的氫鍵數分別為4、6、4、2、4個。

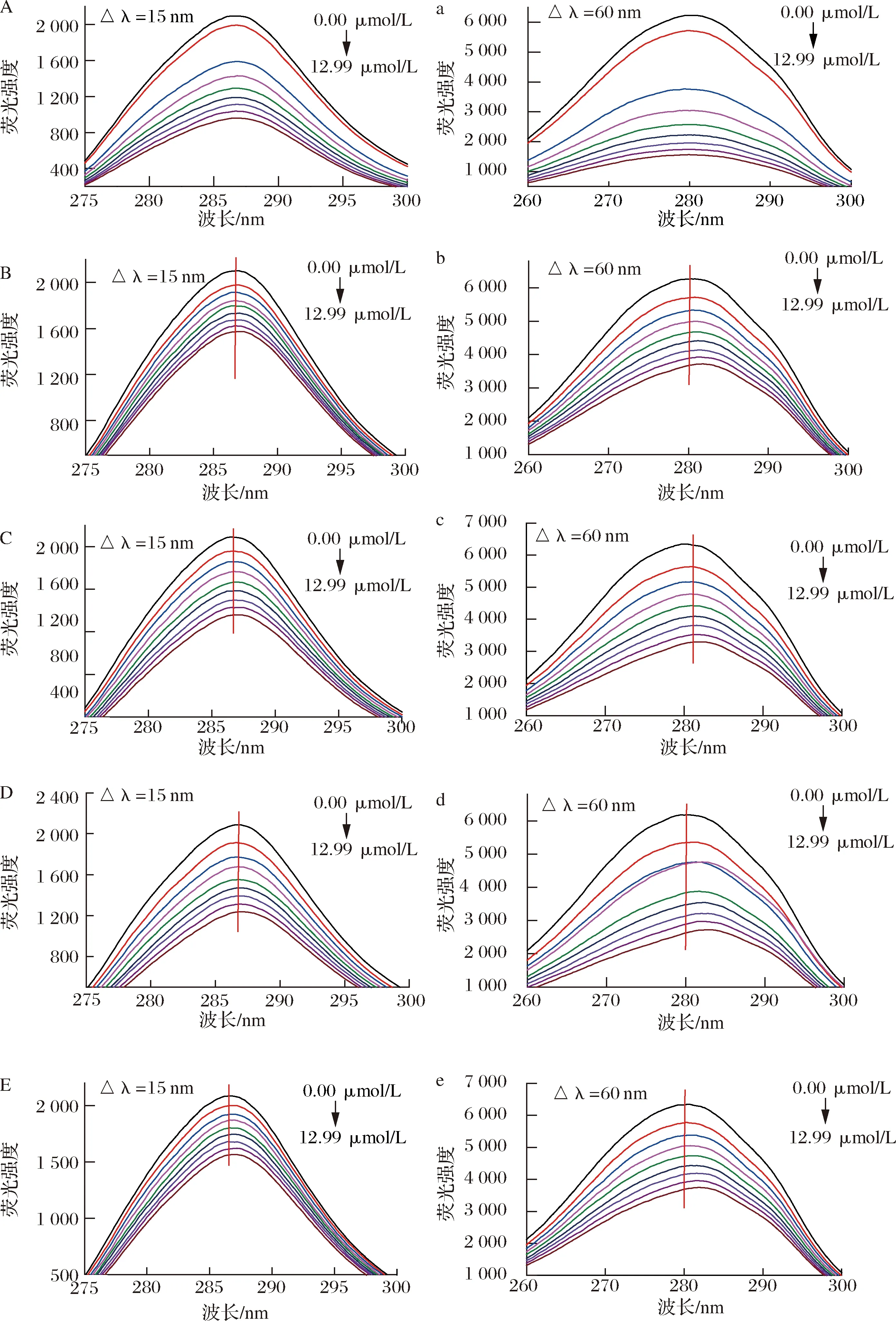
A,a-槲皮素;B,b-槲皮素-3-O-木糖苷;C,c-槲皮素-3-O-鼠李糖苷;D,d-異槲皮素;E,e-蘆丁圖3 五種黃酮對HSA在Δλ為15 nm(A~E)和60 nm(a~e)時同步熒光光譜的影響Fig.3 Effect of five flavonoids on the synchronous fluorescence spectra of HSA with Δλ at 15 nm(A-E) and 60 nm(a-e)注:黃酮濃度分別為0.00、1.66、2.48、3.29、4.1、4.9、5.7、6.49、12.99 μmol/L
3 結論
通過比較研究Que、Q3X、Q3Rh、Q3G和Q3Ru與HSA之間的相互作用,結果發現:(1)Que、Q3X、Q3Rh、Q3G和Q3Ru與HSA的結合會改變HSA的構象結構,并通過靜態方式淬滅HSA的內源熒光,3-羥基糖取代會降低Que對HSA的熒光淬滅效果;(2)Que、Q3X、Q3Rh、Q3G和Q3Ru與HSA按照1∶1的摩爾比通過自發的放熱過程結合形成穩定的復合物,氫鍵、疏水相互作用和范德華力為穩定復合物的主要作用力。木糖、鼠李糖、葡萄糖和蕓香糖取代均會降低其與HSA的結合能力,但對作用力類型無影響;(3)Que及其糖苷與HSA的結合使HSA上Tyr微環境的極性增加,但不會改變Trp殘基微環境的極性。3-羥基糖取代增強Que對HSA上色氨酸微環境的影響,其中葡萄糖的效果最強,木糖最小;(4)Que、Q3X、Q3Rh、Q3G和Q3Ru均結合在HSA亞區域IB的疏水腔中,糖取代不會明顯改變Que與HSA的結合區域和作用力類型,但會改變其相互作用氨基酸。
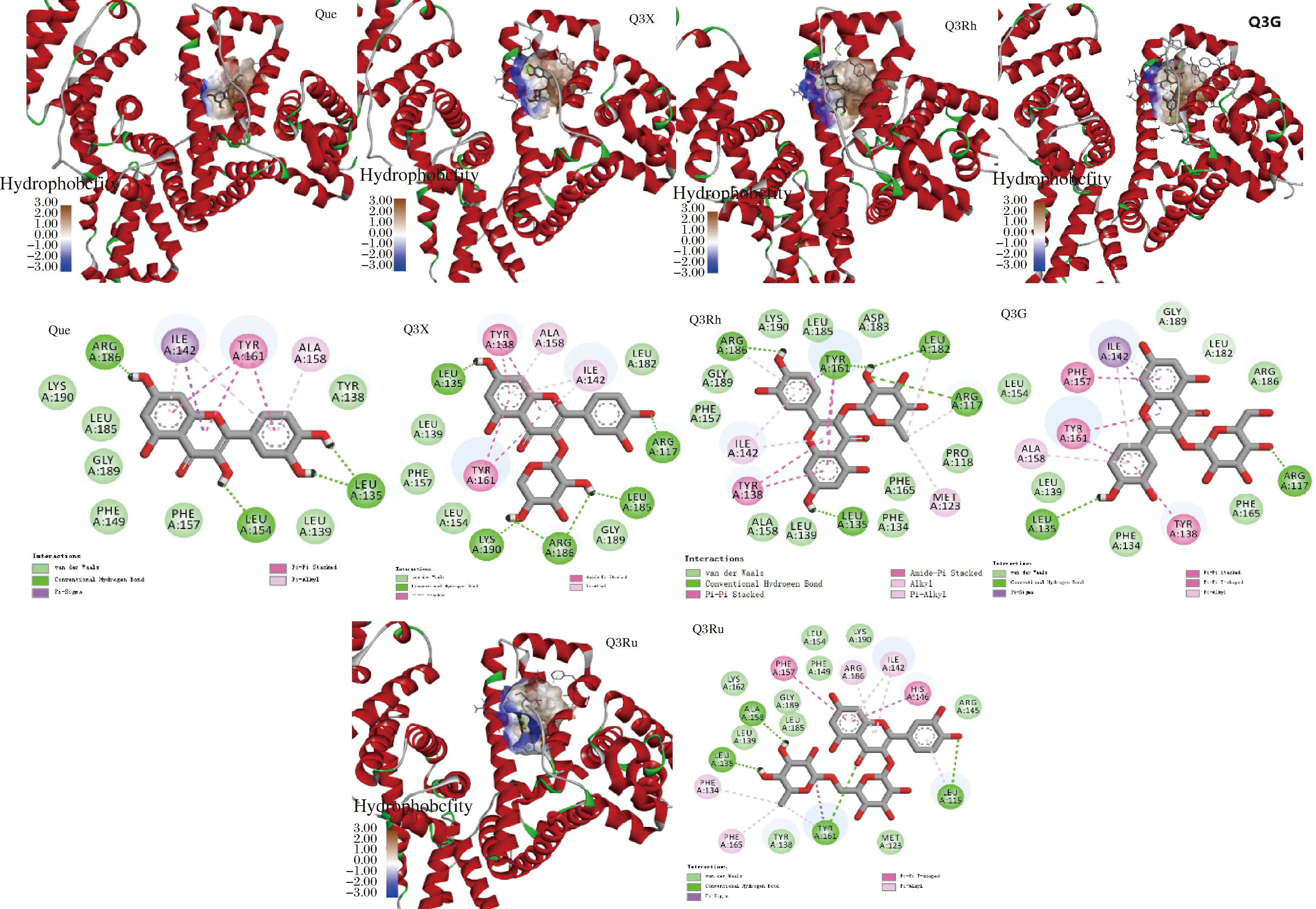
圖4 五種黃酮與HSA分子對接的3D和2D圖譜Fig.4 The 3D and 2D diagrams of molecular docking of five flavonoids with HSA
以上結果可為深入了解糖取代對黃酮類化合物體內生物活性影響提供理論參考,對其在功能性食品中的應用奠定基礎。

