川明參多糖在體外模擬消化過程中的結構變化及對消化酶活性的影響
高濤,羅黃洋,吳韌,閻睿,2,賀靈芝,2,程飛,唐華麗*
1(重慶三峽學院 生物與食品工程學院,重慶,404100) 2(重慶市萬州藥品檢驗所,重慶,404100)
川明參(ChuanminshenviolaceumSheh et Shan)作為一種具有藥食兩用潛力的傳統中藥,是傘形科多年生草本植物,主要分布于四川與湖北等地,富含多糖[1]、香豆素[2]、氨基酸[3]及脂肪酸等物質[4]。多糖作為川明參中活性物質的主要成分,具有較好的增強免疫[5]、抗病毒[6]、抗菌[7]和抗氧化[8-9]等生物活性。川明參作為一種潛在的食品資源,目前對其他營養素的消化吸收的影響還未見報道。α-淀粉酶、脂肪酶和胃蛋白酶是消化道中主要的消化酶,主要負責碳水化合物、脂肪和蛋白質等常見營養素的消化[10]。值得注意的是,消化酶不僅影響食物的消化吸收,還與一些疾病有關,例如糖尿病[11]、肥胖[12]、心血管疾病[13]、高血壓[14]、胃食管反流病[15]、扁桃體肥大等[16]。
絕大多數植物多糖不能完全被消化道降解,進而到達結腸,被腸道微生物發酵利用[17]。但也有數據表明,人體消化液對于多糖的結構依舊存在一定的影響[18]。川明參多糖作為一種葡聚糖,且含有較多的(1→4)-α-D-Glcp,故探究川明參多糖在消化過程中的結構變化顯得尤為重要。消化實驗最好的方式是直接在生物體內部進行,但由于消化系統的復雜性、道德約束及實驗成本等方面的原因,大多數情況都是選擇體外實驗模擬體內消化的方式進行的[19]。
本文采用超聲輔助水提醇沉法提取川明參粗多糖(Chuanminshenviolaceumpolysaccharides,CVPs),經纖維素柱和凝膠柱層析制備川明參多糖主要成分(CVPs-1-G)。采用體外模擬實驗結合凝膠滲透色譜和質譜探究川明參多糖在模擬消化過程中的結構變化以及寡糖生成情況,并測定各階段消化產物對消化酶活性的影響。此外,以結合自由能為指標,采用分子對接技術研究CVPs-1-G消化后生成的寡糖對消化酶活性的影響。
1 材料與方法
1.1 材料與試劑
川明參購自于重慶市萬州區中草藥市場,粉碎后過40目篩,于95%的乙醇中浸泡1 d后除去小分子物質,過濾收集沉淀,保存于45 ℃烘箱中;α-淀粉酶、脂肪酶、胃蛋白酶、牛血清蛋白(bovine serum albumin,BSA)、可溶性淀粉、三氯乙酸、4-硝基苯棕櫚酸酯,上海麥克林試劑有限責任公司;DNS試劑、PBS、Tris-HCl,飛凈生物科技有限公司;其余試劑均為國產分析純。
1.2 主要儀器及設備
UV-2450紫外可見光分光光度計,LC-10A型高效液相色譜儀,日本島津公司;Imark酶標儀,BIO-RAD公司;ALPH1-2/LD-Plus冷凍干燥機,德國CHRIST公司;LC-10A型高效液相色譜儀;TSQ Quantum質譜儀,美國賽默飛公司。
1.3 試驗方法
1.3.1 川明參粗多糖的提取
按文獻[8]的方法制備川明參粗多糖。稱取一定質量川明參粉置于2 000 mL錐形瓶中,按料液比1∶20(g∶mL)加入蒸餾水溶解。在300 Hz,60 ℃條件下,超聲提取90 min。過濾濃縮后,按4∶1的體積比向濃縮液中加入Sevag試劑[V(氯仿)∶V(正丁醇)=4∶1],劇烈振蕩20 min,收集水相,重復6次后,加入無水乙醇沉淀至乙醇體積分數至80%。靜置過夜,離心收集沉淀,真空冷凍干燥即可得到粗多糖粉末。
1.3.2 CVPs-1-G的制備
稱取500 mg川明參粗多糖粉末溶于10 mL去離子水中,8 000 r/min離心10 min,取上清液過0.45 μL水系濾膜后上樣。分別用0、0.1、0.2、0.3 mol/L的NaCl溶液進行梯度洗脫。色譜柱為DEAE-52纖維素柱(2.5 cm×60 cm),設置流速為1 mL/min,每10 min收集一管。收集NaCl濃度為0 mol/L的洗脫組分,按上述步驟操作進行Sephadex G-100凝膠柱(2.5 cm×60 cm)層析,洗脫曲線為單峰,收集峰并冷凍干燥即為CVPs-1-G。
1.3.3 CVPs-1-G的體外模擬消化
1.3.3.1 模擬口腔消化
模擬口腔消化實驗參考文獻[17]和[20]的方法進行。收集6名符合條件的志愿者的新鮮唾液,5 000 r/min離心10 min,收集上清液,按照RUTH等[21]的方法測定唾液淀粉酶活性,并于-20 ℃條件下保存待用。取5 mL唾液放置于37 ℃條件下預熱30 min,加入5 mL多糖溶液(10 mg/mL)于37 ℃條件下保持0、5、15、30 min后沸水浴10 min。測定分子質量與還原糖生成量。
1.3.3.2 模擬胃消化
參考文獻[17]的方法配制模擬胃液,并參考文獻[17]和[20]的方法進行模擬胃消化。首先將經唾液消化30 min的多糖溶液用0.1 mol/L的HCl調節pH至2.0,再進行模擬胃消化實驗。取5 mL胃液和5 mL調節好pH的唾液消化產物,放置于恒溫振蕩器中進行反應,調節溫度為37 ℃,振蕩速度為120 r/min。反應1、2、4、6 h后取出沸水浴10 min,消化產物經透析袋透析,再經Sevag法除蛋白質后冷凍干燥,測定分子質量及還原糖生成量。
1.3.3.3 模擬小腸消化
參考文獻[17]的方法配制模擬小腸液體,并參考文獻[17]和[20]的方法進行模擬小腸消化。首先將經模擬胃消化6 h后的多糖消化液用1 mol/L的NaHCO3調節pH至7.0,再進行模擬小腸消化實驗。取10 mL調好pH的多糖胃消化液和3 mL小腸液混勻,放置于恒溫振蕩器中,調節溫度為37 ℃,振蕩速度為120 r/min。反應1、2、4、6 h后取出沸水浴10 min,消化產物經透析袋透析,再經Sevag法除蛋白質后冷凍干燥,并測定分子質量及還原糖生成量。
1.3.4 分子質量、還原糖生成量及寡糖含量測定
1.3.4.1 分子質量測定
精密稱取5 mg樣品溶于1 mL超純水配制的0.05 mol/L的NaCl溶液中,超聲波溶解后于12 000 r/min條件下離心10 min,取上清液過0.22 μm水系濾膜后上機分析。上樣量20 μL;流速0.6 mL/min;柱溫40 ℃。流動相為0.05 mol/L的NaCl溶液。
1.3.4.2 還原糖生成量測定
精確稱取干燥后的多糖消化產物,以葡萄糖為對照,采用DNS法測定還原糖含量。
1.3.4.3 寡糖測定
稱取5 mg經唾液消化、胃消化和小腸消化的干燥樣品溶于10 mL去離子水,12 000 r/min離心10 min,取上清液經適當稀釋后過0.22 μm水系濾膜后進行上機分析。氣體流速為12 L/min,噴霧電壓為3.0 kV,離子源溫度為320 ℃,上樣速度為20 μL/min,掃描范圍為150~3 000 Da,數據記錄時間為10 min。
1.3.5 消化產物對消化酶活性的影響
1.3.5.1 α-淀粉酶抑制活性的測定
參照文獻[22]的方法測定α-淀粉酶抑制活性[22]。取1 mL的α-淀粉酶溶液(1 mg/mL,采用pH 7.2的0.1 mol/L的PBS配制)于37 ℃條件下預熱10 min,隨后加入1 mL不同濃度的樣品溶液和1 mL質量分數2%的可溶性淀粉溶液,于37 ℃條件下反應10 min。反應完成后,加入1 mL的DNS試劑于100 ℃條件下放置5 min。冷卻至室溫,加入5 mL蒸餾水,于540 nm處測定紫外吸收波長。以阿卡波糖為對照,α-淀粉酶抑制率按公式(1)計算:
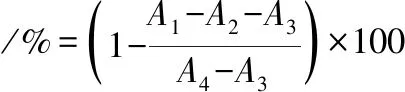
(1)
式中:A1,樣品組的吸光度值;A2,蒸餾水代替可溶性淀粉的吸光度值;A3,蒸餾水代替樣品和酶的吸光度值;A4,蒸餾水代替樣品的吸光度值。
1.3.5.2 脂肪酶抑制活性的測定
參考文獻[23]的方法測定脂肪酶抑制活性。于96孔酶標板中加入50 μL不同濃度的樣品溶液與50 μL的胰脂肪酶溶液(5 mg/mL,采用pH 7.0的0.2 mol/L的Tris-HCl配制),并于37 ℃條件下預熱10 min。隨后,加入200 μL濃度為2 mmol/L的4-硝基苯棕櫚酸酯(先溶于異丙醇,再以Tris-HCl進行稀釋)在37 ℃條件下反應15 min。反應完成后于405 nm處測定紫外吸收波長。以奧利司他為對照,胰脂肪酶抑制活性按公式(2)計算:
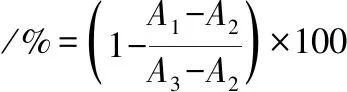
(2)
式中:A1,樣品組的吸光度值;A2,蒸餾水代替酶的吸光度值;A3,蒸餾水代替樣品的吸光度值;A4,蒸餾水代替樣品和酶的吸光度值。
1.3.5.3 胃蛋白酶抑制活性的測定
參考文獻[24]的方法測定川明參多糖的胃蛋白酶活性。取1 mL胃蛋白酶溶液(1 mg/mL,用pH 2的PBS進行配制)和1 mL不同濃度的樣品溶液于37 ℃條件下預熱20 min。隨后,加入2 mL質量濃度為0.5 mg/mL的BSA溶液于37 ℃條件下反應10 min。最后,加入2 mL 10%的三氯乙酸終止反應,于275 nm處測定紫外吸光度值。以抑肽素為對照,胃蛋白酶抑制活性按公式(3)計算:
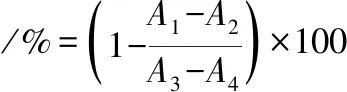
(3)
式中:A1,樣品組未反應的吸光度值;A2,樣品組反應后的吸光度值;A3,對照組(蒸餾水代替樣品)未反應的吸光度值;A4,對照組(蒸餾水代替樣品)反應后的吸光度值。
1.3.6 分子對接
采用Chem3D繪制CVPs-1-G消化產物中主要生成寡糖(二糖)的結構式,保存為mol2格式,再將其導入Autodock軟件保存為pdbqt格式。在PDB數據庫下載α-淀粉酶(https://www.rcsb.org/structure/3DHP)、脂肪酶(https://www.rcsb.org/structure/1LPB)和胃蛋白酶(https://www.rcsb.org/structure/3UTL)的PDB文件,將其導入Pymol軟件去除配體,去水加氫并保存為PDB格式文件,再將其導入Autodock軟件保存為pdbqt格式文件。最后采用Autodock vina軟件進行分子對接,計算其分子結合自由能。
1.4 數據處理
每組實驗至少重復3次,結果以平均值±標準差表示。采用SPSS 23.0對數據進行顯著性檢驗,方差齊性時,組間對比LSD檢驗,方差不齊性時,采用Tamhane’s T2檢驗。根據Probit回歸模型計算IC50。常規數據繪圖采用Origin 2018進行,分子對接繪圖采用Pymol進行。
2 結果與討論
2.1 CVPs-1-G的制備及基本結構
采用超聲波輔助水提醇沉法提取CVPs,并經DEAE-52纖維素柱和Sephadex G-100凝膠柱分離純化以制備CVPs-1-G。CVPs-1-G是一種分子質量為(8.1±0.5) kDa,Mw/Mn為1.19,主要由(1→4)-α-D-Glcp組成,并含有一定量的(1→6)-α-D-Glcp,支鏈通過→4)-α-D-Glcp-(1→與(1→3,6)-α-D-Glcp的O-3和O-6位相連的葡聚糖[25]。其精細結構如圖1所示。
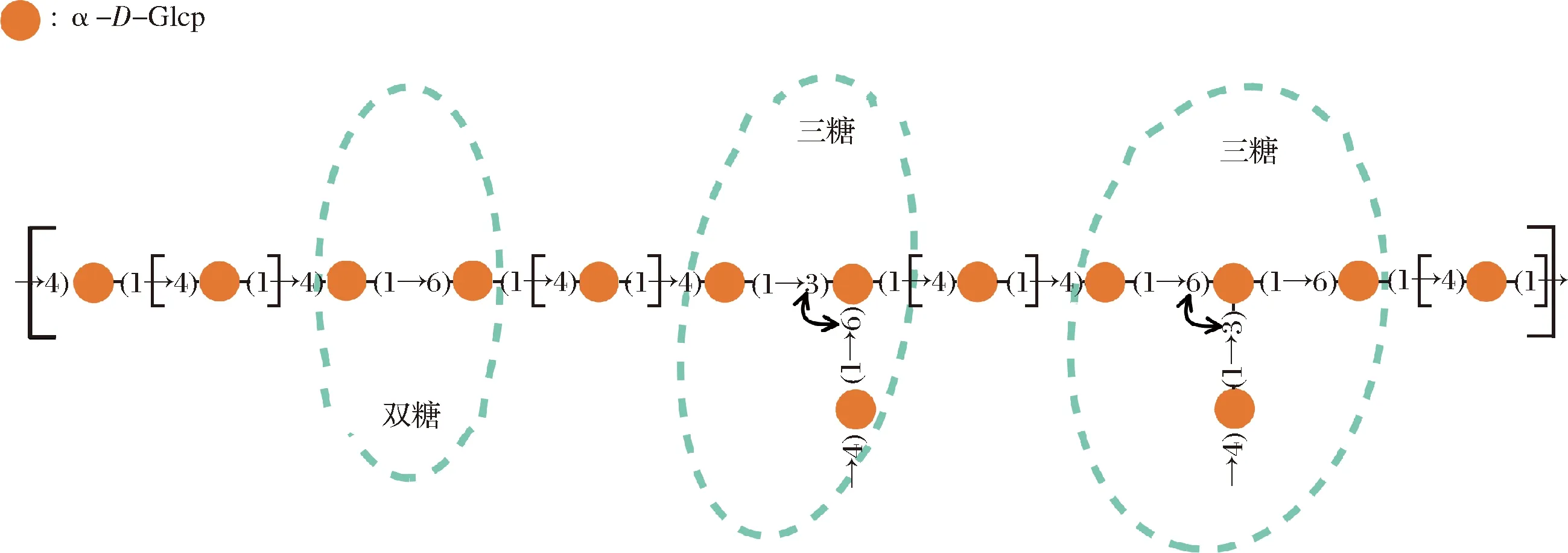
圖1 CVPs-1-G的精細結構Fig.1 The structure of CVPs-1-G
2.2 CVPs-1-G在模擬消化過程中的結構變化及寡糖生成情況
2.2.1 CVPs-1-G在唾液消化過程中的分子質量及還原糖生成量的變化
唾液作為與第一個與食物接觸的消化液,其中最重要的水解酶為淀粉酶,可水解碳水化合物中的α-1,4糖苷鍵[21,26]。前期的研究表明,CVPs-1-G是一種葡聚糖,并含有一定量的(1→4)-α-D-Glcp。所以,探究CVPs-1-G在唾液中的消化情況極有必要。經測定后發現,本實驗選用的唾液其唾液淀粉酶活性為(176±15) U/mL,此結果在RUTH等[21]報道的18~204 U/mL范圍內,符合實驗要求。
CVPs-1-G在唾液消化過程中分子質量及還原糖含量的變化如表1和圖2所示。CVPs-1-G隨著消化時間的延長其在高效凝膠滲透色譜(high performance gel permeation chromatography,HPGPC)圖上的保留時間也隨之延長,該結果表明CVPs-1-G隨著唾液消化時間的延長分子質量也隨之降低。經唾液消化30 min后,CVPs-1-G的分子質量從原來的7.86 kDa降低到5.16 kDa。此外,隨著唾液消化時間的延長,其還原糖含量也顯著增高,從最開始的0.005 mg/mL上升到0.216 mg/mL。綜上,CVPs-1-G在模擬唾液消化的過程中,結構可能發生了變化。
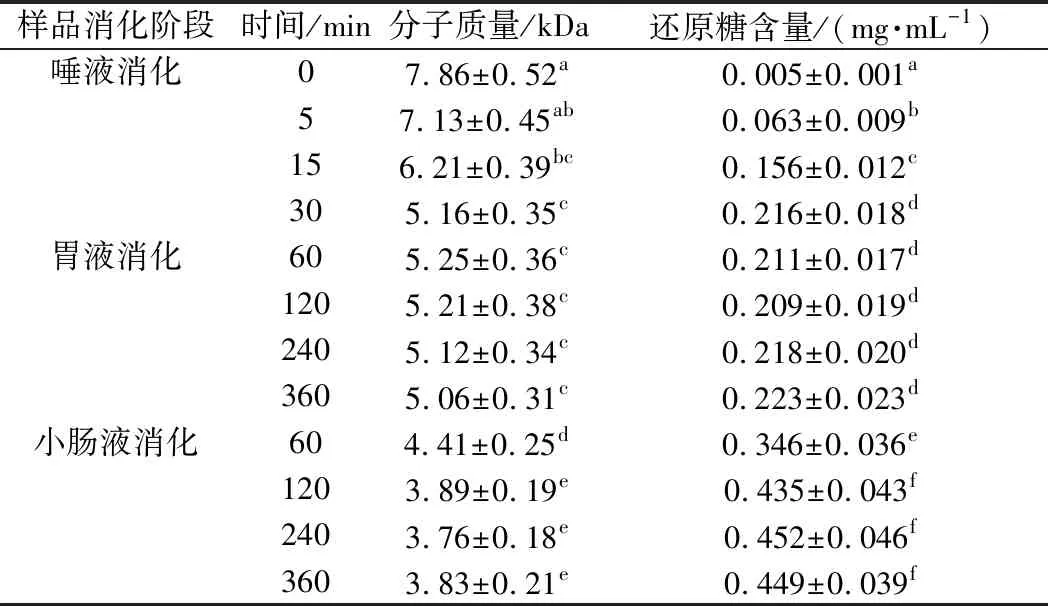
表1 不同消化時間下CVPs-1-G的分子質量及還原糖含量Table 1 Molecular weight and reducing sugar content of CVPs-1-G under different digestion conditions
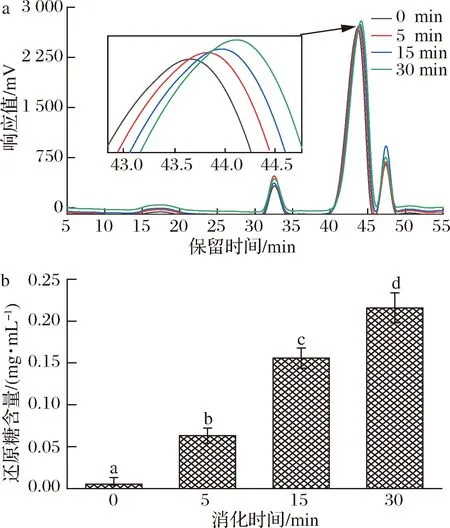
a-分子質量;b-還原糖生成量圖2 CVPs-1-G在模擬唾液消化過程中分子質量及還原糖生成量Fig.2 Molecular weight of CVPs-1-G and the content of reducing sugar during simulated salivary digestion
2.2.2 CVPs-1-G在胃消化過程中的分子質量及還原糖生成量的變化
食物經唾液初步消化后被送入胃中,在胃酸的作用及胃的蠕動下被消化,而唾液淀粉酶在胃酸的作用下失活[27]。CVPs-1-G經唾液模擬消化30 min后進行胃液模擬消化,其分子質量及還原糖含量變化如表1和圖3所示。隨著模擬胃消化時間的延長,CVPs-1-G在HPGPC中的保留時間無明顯變化,表1中的分子質量變化也無明顯差異。此外,通過DNS法測得的各消化時間段的還原糖含量也無顯著性差異。綜上,CVPs-1-G在模擬胃消化階段不會發生任何變化。
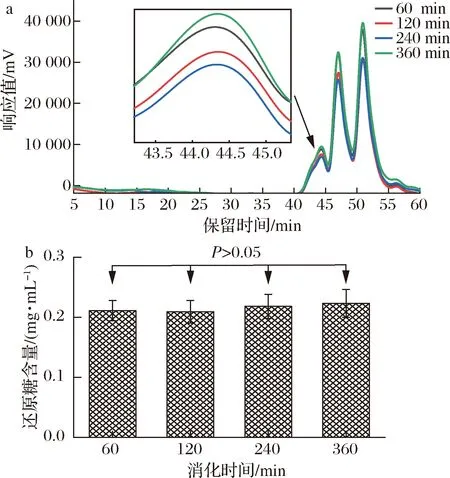
a-分子質量;b-還原糖生成量圖3 CVPs-1-G在模擬胃消化過程中分子質量及還原糖生成量Fig.3 Molecular weight of CVPs-1-G and the content of reducing sugar during simulated gastric digestion
2.2.3 CVPs-1-G在小腸消化過程中的分子質量及還原糖生成量的變化
小腸是碳水化合物消化吸收的重要場所,探究CVPs-1-G在小腸中的變化顯得很有必要。CVPs-1-G經唾液模擬消化30 min、胃消化6 h后進行小腸模擬消化如表1和圖4所示,與小腸消化60 min的HPGPC圖相比,小腸消化120 min的HPGPC圖中CVPs-1-G的保留時間被延長。但隨著小腸消化時間的延長,CVPs-1-G在HPGPC圖上的保留時間無明顯變化。與胃液消化360 min時CVPs-1-G的分子質量(5.06 kDa)相比,CVPs-1-G在小腸消化120 min以內的分子質量均顯現出下降的趨勢,于小腸消化120 min后達到穩定。其小腸消化360 min后的分子質量為3.93 kDa。此外,在小腸消化產物的還原糖含量上也表現出了相似的變化,小腸消化120 min后的消化產物的還原糖含量顯著高于消化60 min后的消化產物。小腸消化120 min后,隨著消化時間的延長,其還原糖含量未發生明顯改變。其結果表明,CVPs-1-G在經唾液消化和胃消化后在小腸消化階段會被部分降解后保持穩定。
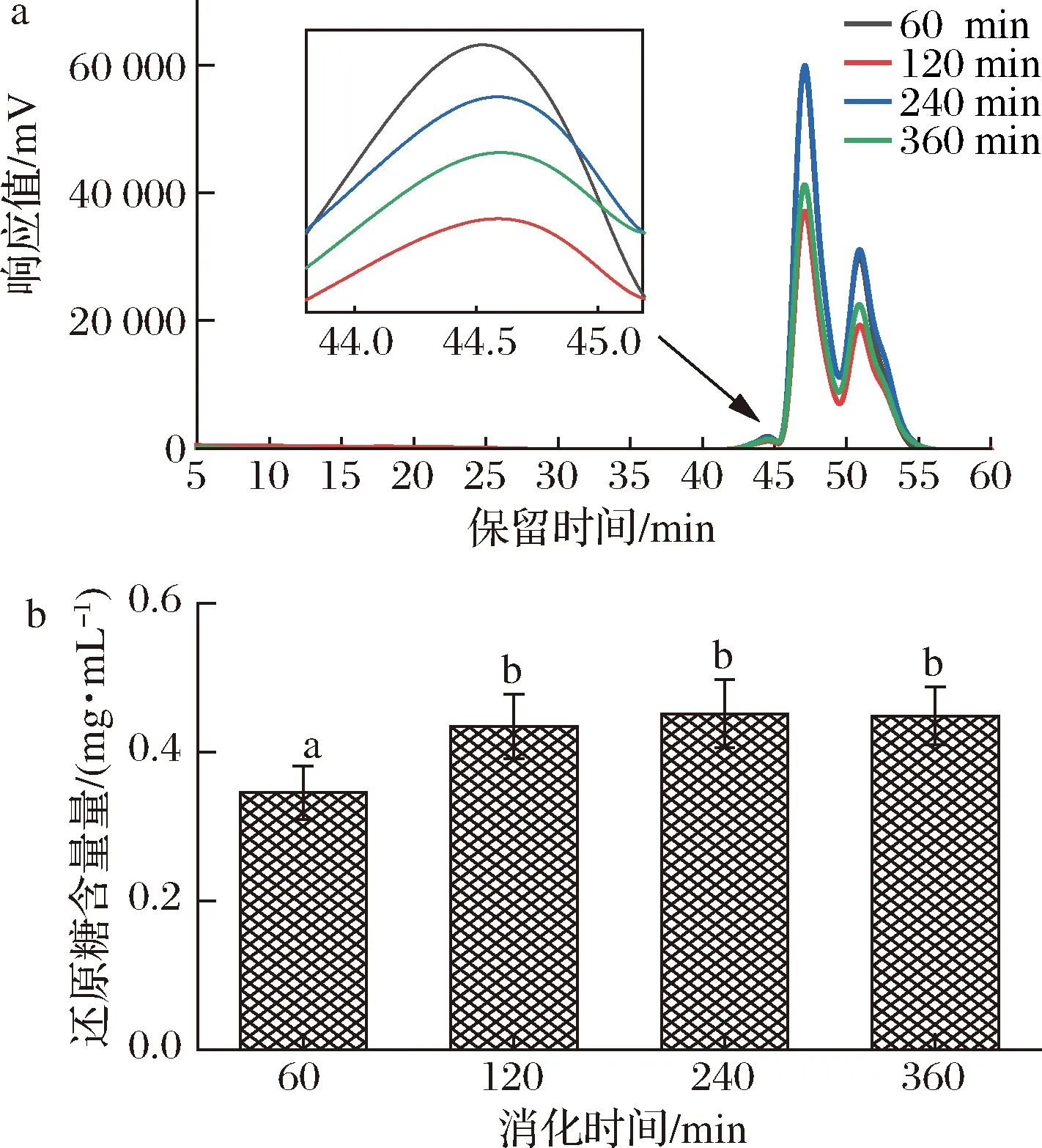
a-分子質量;b-還原糖生成量圖4 CVPs-1-G在模擬小腸消化過程中分子質量及還原糖生成量Fig.4 Molecular weight of CVPs-1-G and the content of reducing sugar during simulated intestinal digestion
2.2.4 CVPs-1-G在模擬消化過程中的寡糖生成情況
采用電噴霧質譜(electrospray ionization-mass spectrometry,ESI-MS)測定經唾液消化30 min、胃消化6 h和小腸消化6 h后的消化產物中的寡糖。消化產物經透析膜(100 Da)透析除去小分子物質,再經Sevag法除蛋白質后進行ESI-MS分析。CVPs-1-G模擬消化產物的ESI-MS如圖5所示,由于在消化的過程中使用大量的NaCl,使得產生的寡糖基本以[M+2 Na]+的形式存在。如圖5所示,CVPs-1-G經模擬消化后主要產生了單糖、二糖、三糖、四糖及五糖,其中二糖含量最高,其次是四糖,五糖含量最低。由于模擬消化過程中的碳水化合物水解酶均只能水解α-1,4-糖苷鍵,并結合圖1的CVPs-1-G的結構信息,推測模擬消化后產生的二糖為Glcp-α-1,4-Glcp(水解不完全形成的麥芽糖)和Glcp-α-1,6-Glcp。
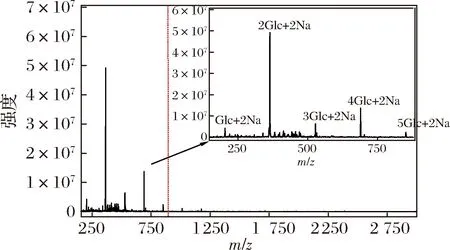
圖5 CVPs-1-G經模擬消化后的ESI-MS圖Fig.5 ESI-MS of CVPs-1-G after simulated digestion in vitro
2.3 CVPs-1-G在模擬消化產物對消化酶活性的影響
α-淀粉酶及脂肪酶主要在小腸消化階段發揮作用,胃蛋白酶主要在胃消化階段發生作用,故僅需考察CVPs-1-G的小腸消化產物對α-淀粉酶和脂肪酶活性的影響,胃消化產物對胃蛋白酶抑制活性的影響。如圖6所示,與CVPs-1-G相比,CVPs-1-G消化產物的α-淀粉酶、脂肪酶及胃蛋白酶抑制活性的IC50值均有顯著降低(P<0.05),其結果表明CVPs-1-G經模擬消化后其α-淀粉酶、脂肪酶和胃蛋白酶抑制活性均有一定程度的增強。
采用皮爾遜相關性分析考察CVPs-1-G消化產物與消化酶抑制活性之間的關系,結果如表2所示。CVPs-1-G消化產物的α-淀粉酶抑制活性、脂肪酶抑制活性和胃蛋白酶抑制活性與其分子質量大小顯著負相關,與其還原糖生成量顯著正相關。其結果表明,CVPS-1-G的消化產物對α-淀粉酶、脂肪酶和胃蛋白酶的抑制活性隨著其分子質量的降低和還原糖含量的升高而升高。
2.4 分子對接結果分析
根據寡糖分析的結果,采用分子對接考察CVPs-1-G消化產物中的寡糖對消化酶活性的影響。各二糖分子(Glcp-α-1,4-Glcp和Glcp-α-1,6-Glcp)與α-淀粉酶、脂肪酶和胃蛋白酶的分子對接結合自由能結果如表3所示,各二糖分子與α-淀粉酶、脂肪酶和胃蛋白酶的結合自由能均<-5 kJ/mol,表明各二糖分子與α-淀粉酶、脂肪酶和胃蛋白酶間具有較好的結合能力[28]。此外,在可能產生的這3種二糖分子中,Glcp-α-1,6-Glcp與α-淀粉酶、脂肪酶和胃蛋白酶的結合能力最強,表明該二糖分子可能具有更好的消化酶抑制活性。每個二糖分子與α-淀粉酶、脂肪酶和胃蛋白酶的具體結合情況采用Pymol軟件進行可視化分析,結果如圖7所示,每個二糖分子均能較好的通過氫鍵與α-淀粉酶、脂肪酶和胃蛋白酶結合在一起。

a-α-淀粉酶;b-脂肪酶;c-胃蛋白酶圖6 CVPs-1-G消化產物的α-淀粉酶、脂肪酶及胃蛋白酶抑制活性的IC50Fig.6 The IC50 of CVPs-1-G digestion products on α-amylase,lipase and pepsin inhibitory activities
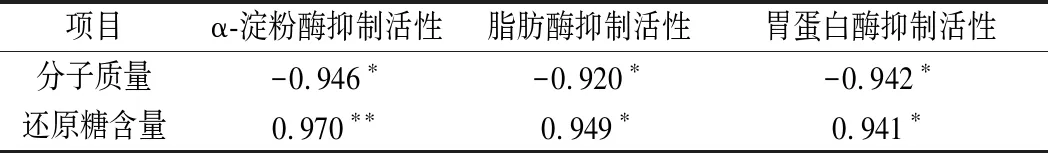
表2 CVPs-1-G消化產物的分子質量及還原糖生成量與α-淀粉酶、脂肪酶及胃蛋白酶抑制活性的皮爾遜相關性分析Table 2 Pearson correlation analysis of molecular weight and reducing sugar content of CVPs-1-G digestive products with α-amylase,lipase and pepsin inhibitory activities

表3 二糖組分與消化酶的分子對接結合自由能Table 3 Chemical shifts and coupling constant of residue A-G
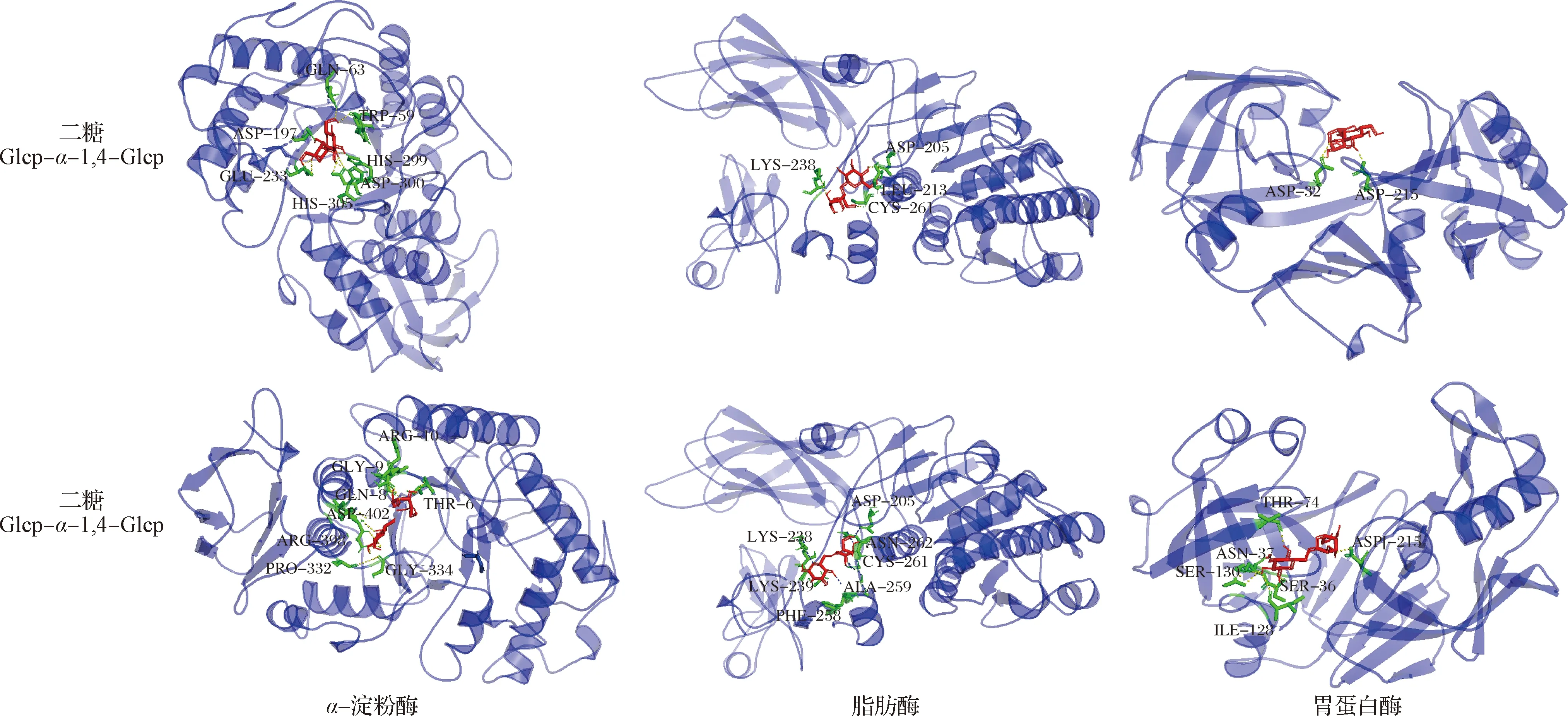
圖7 二糖分子與消化酶的分子對接Fig.7 Molecular docking of disaccharides with digestive enzymes
3 結論
本文以川明參為原料,采用超聲輔助水提醇沉法提取CVPs,經纖維素柱層析和凝膠柱層析分離純化得到CVPs-1-G。采用體外模擬實驗結合凝膠滲透色譜和質譜探究CVPs-1-G在模擬消化過程中的結構變化及寡糖生成情況,并測定各階段消化產物對α-淀粉酶、脂肪酶和胃蛋白酶抑制活性的影響。此外,采用分子對接技術探究CVPs-1-G消化后生成的寡糖對消化酶活性的影響。結果表明,CVPs-1-G在唾液消化階段與小腸液消化階段中存在一定降解,在胃消化階段較為穩定,經模擬消化后,主要產生的寡糖為二糖。此外,CVPs-1-G經模擬消化后,其α-淀粉酶、脂肪酶和胃蛋白酶抑制活性均有顯著增加,其α-淀粉酶、脂肪酶和胃蛋白酶抑制活性與其分子質量及還原糖生成量顯著相關。此外,分子對接結果顯示,CVPs-1-G經模擬消化后生成的二糖分子與α-淀粉酶、脂肪酶和胃蛋白酶的結合自由能均小于-5 kJ/mol,表明該二糖分子與α-淀粉酶、脂肪酶和胃蛋白酶均具有較好的結合能力。

