ARTP技術選育米曲霉氨肽酶高產菌株
張艷芳,孟廣超,2,王選年,2*
(1.新鄉學院 生物技術研究中心,河南 新鄉 453003;2.鄭州大學 生命科學技術學院,鄭州 450001)
對微生物進行高質量與高生產能力的改造,是當前發酵生產行業的核心,前人對米曲霉菌株的誘變方法主要有紫外誘變、DES復合誘變和離子注入誘變等,這些方法均能有效地提高米曲霉產各類蛋白酶的活性[1-3]。但是這些方法效率低、盲目性大、工作量高,不適合當今迅速發展的社會,正逐漸被社會淘汰。近幾年,新興起的常壓室溫等離子體(ARTP)誘變技術對米曲霉菌株進行誘變育種,與傳統的誘變方法相比,它具有操作簡便、可行性高、安全無污染等特點,逐漸取代傳統的育種方式,成為育種界新的傳統,國內的科研工作者利用ARTP技術進行誘變育種,且均取得了不錯的成績[4-5]。本實驗以米曲霉CICC2066為氨肽酶的來源菌株,因為該菌株性能穩定,產蛋、白酶活性高,廣泛運用于工業生產中。采用ARTP誘變技術,旨在獲得高產突變的產氨肽酶菌株。
1 材料與方法
1.1 材料
1.1.1 菌種
米曲霉(Aspergillusoryzae)CICC2066:本實驗室保存。
1.1.2 主要試劑與儀器
L-亮氨酸-4-硝基苯胺(分析純):索萊寶公司;72s分光光度計:美國IBAK公司;ARTP誘變育種儀:無錫天幕源生物有限公司;其他有機試劑:均為分析純。
1.1.3 培養基
米曲霉斜面培養基:PDA培養基,將土豆清洗干凈、切片、去皮,在沸水中煮20 min,用4層紗布過濾掉濾渣,加入15 g瓊脂,于121 ℃滅菌20 min。
初篩培養基:蔗糖30 g/L,L-亮氨酸對硝基苯0.5 g/L,七水硫酸鎂0.5 g/L,磷酸氫二鉀10 g/L,瓊脂粉17 g/L,無菌水1000 mL,pH 6.4,于121 ℃滅菌20 min。
制曲培養基:將16 g麩皮、4 g豆粕共20 g置于250 mL三角瓶中,加入16 g的水,用玻璃棒攪拌均勻,于121 ℃滅菌20 min。
1.2 方法
1.2.1 誘變材料的選擇
選取米曲霉培養72 h時嫩綠色的孢子為誘變材料,因為這個時期的孢子活躍度高,更易突變,且孢子為單倍體,與菌絲體相比更容易發生突變且能獲得穩定遺傳的突變菌株[6]。
1.2.2 孢子懸液的制備
用于誘變的米曲酶孢子數目要足夠多,因為誘變是不定向的,誘變以后的米曲霉孢子死亡率在70%以上,剩余的孢子中部分沒有突變,部分發生負突變,正突變孢子數目很少,所以孢子數目要足夠多,否則很難選擇需要的菌株[7]。將斜面保存的米曲酶CICC2066菌株置于35 ℃的培養箱中活化,用無菌水洗脫斜面上的孢子,用轉子將洗下的孢子振蕩打散,在顯微鏡下用血球計數板計數,將孢子液的濃度調整為1×107個/mL備用。
1.2.3 致死率的確定
將制備好的孢子液均勻地涂在ARTP誘變儀的玻片上,調整好功率為120 W 氣流量為10 SLM,以30 s為時間間隔在等離子誘變儀上分別處理0,30,60,90,120,150,180,210,240,270,300 s,將誘變后的菌落分別稀釋10-3,10-4,10-5進行涂布培養72 h,計算菌落的致死率。
致死率=(誘變前菌落數-誘變后菌落數)/誘變前菌落數×100%。
1.2.4 ARTP誘變后的篩選
LNA被氨肽酶水解生成pNA而留下黃色的水解圈,根據HE值(水解圈直徑/菌落直徑)的測定進行初次篩選,與對照組相比,HE值增大的菌株記為正突變株,做好標記,并移入PDA培養基,在35 ℃條件下培養,為復篩做準備。
復篩以氨肽酶活性為篩選標準,在初次篩選的基礎上將初篩獲得的菌株接種到制曲培養基中35 ℃培養72 h,分別檢測氨肽酶活性,與對照菌株比較,并記錄生長情況。
1.2.5 粗酶液的獲取
稱取1 g固體干曲,用pH為7.2的PBS浸泡,并于4 ℃過夜,用4層紗布過濾得到氨肽酶的粗酶液。
1.2.6 氨肽酶活性檢測
采用L-亮氨酸對硝基苯胺法檢測氨肽酶活性[8]:將獲得的粗酶液在4 ℃,8000×g的條件下離心5 min,取上清液,用pH值為7.2的PBS稀釋10倍。取100 μL稀釋后的氨肽酶粗液在100 ℃水浴滅活20 min,用作對照。分別取滅活的酶液與未滅活的酶液,加入1.5 mL的PBS,在40 ℃條件下恒溫10 min,使其溫度穩定,向EP管中加入濃度為25 mmol/L的對硝基苯胺乙醇溶液100 μL,在水浴中40 ℃反應10 min,在405 nm下測定其吸光值。
酶活定義:在40 ℃、pH 7.2時,氨肽酶每1 min水解亮氨酸對硝基苯胺生成1 μg對硝基苯胺(p-NA)所需的酶量為一個酶活力單位。
酶活力計算公式:U=A×V1×D÷(K×t×V2)。
式中:U為氨肽酶活性(U/mL),A為405 nm下的吸光值,V1為反應總體積1.7 mL,D為酶液的稀釋倍數10,t為反應時間10 min,K為消光系數倍數,V2為酶液體積100 μL。
亮氨酸對硝基苯胺標準曲線的制作:以無水乙醇為空白對照,配制濃度梯度為0,0.5,1.5,2.5,3.5,4.5,5.5,6.5,7.5 μg/mL的對硝基苯胺溶液,用紫外分光光度計在405 nm波長下測定其吸光值,以對硝基苯胺的濃度(μg/mL)為橫坐標,以不同濃度對硝基苯胺的吸光值為縱坐標,建立標準曲線。
1.2.7 誘變后菌株的遺傳穩定性檢測
將篩選得到的誘變后的米曲霉菌株在PDA斜面培養基上連續傳代5次,每代都檢測其氨肽酶活性,并記錄其菌落生長狀況(菌落顏色、菌落大小、產孢子時間等)并與對照菌株(CICC2066)進行對比。
2 結果與分析
2.1 L-亮氨酸對硝基苯胺標準曲線
根據1.2.6中不同濃度的對硝基苯胺吸光值的檢測建立L-亮氨酸的標準曲線,見圖1。
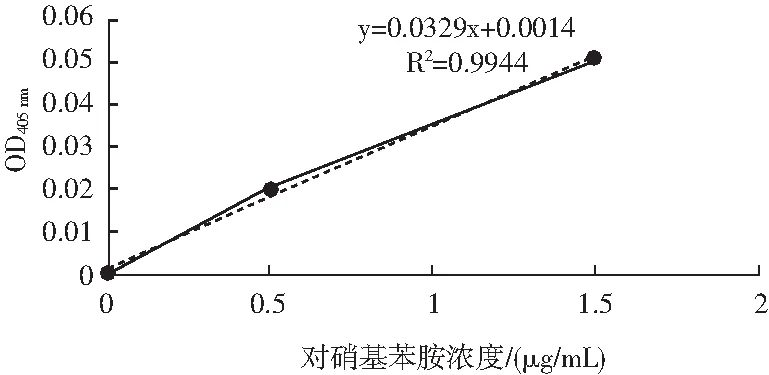
圖1 對硝基苯胺標準曲線Fig.1 The standard curve of p-NA
由圖1可知,L-亮氨酸標準曲線的方程為y=0.0329x+0.0014,其中R2為0.9944,證明該曲線可用,同時根據標準曲線可以求得消光系數K=0.0329。
2.2 ARTP誘變條件的確定
2.2.1 ARTP誘變時間的確定
在ARTP誘變功率為120 W、氣流量為10 SLM、孢子液濃度為1×107個/mL的條件下對米曲霉孢子進行誘變處理,將誘變過后的孢子梯度稀釋并涂布培養,通過確定菌落的致死率進而確定誘變時間,菌落致死率隨時間變化的關系見圖2。
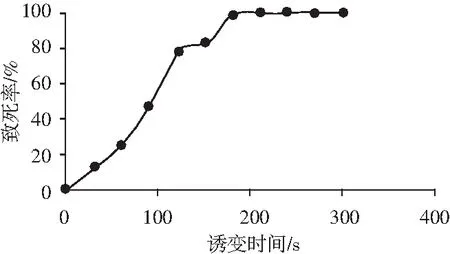
圖2 誘變時間與致死率的關系Fig.2 The relationship between mutagenesis time and lethality rate
由圖2可知,隨著誘變時間的增加,米曲霉菌落的致死率也逐漸增加,在時間為0~120 s時,菌落致死率增加較快,120~160 s時菌落致死率增加較慢,在誘變時間達到200 s時,致死率達到100%,查閱文獻可知,米曲霉在致死率達到75%左右時正突變率最高[9],在實驗中120~150 s以后菌落致死率曲線較為平緩,因此本實驗采用的誘變時間為120 s,在此條件下菌落的致死率為75%。
2.2.2 ARTP孢子濃度的確定
為確定ARTP誘變技術中孢子液的濃度(初始孢子液的濃度為1×107個/mL),采用梯度稀釋法對初始孢子液的濃度分別稀釋10-3,10-4,10-5倍,將稀釋后的孢子懸液在35 ℃下培養72 h,根據平板菌落計數法確定菌落數量,進而確定ARTP技術中孢子液的濃度。
由表1可知,在誘變時間為120 s時,當稀釋倍數為10-3時,菌落生長太過密集,無法計數,在稀釋倍數為10-5時,經誘變后菌落數只有8個,在稀釋倍數為10-4時,經誘變后菌落數為33個,參考GB 4789.2-2016 《食品衛生微生物學檢驗 菌落總數測定》菌落數在30~100具有計數意義[10],所以最終確定稀釋倍數為10-4,即ARTP誘變技術中孢子液的濃度為1×103個/mL。

表1 不同稀釋倍數下的菌落計數Table 1 The colony count under different dilution multiples
2.3 ARTP篩選結果
在誘變時間120 s、儀器氣流量10 SLM、功率120 W、孢子懸液濃度為1×103個/mL時,對米曲霉CICC2066進行ARTP誘變處理,將處理過的孢子懸液均勻涂布到氨肽酶活力篩選培養基上,以CICC2066為對照,挑取HE值較CICC2066增大的20菌株進行培養,誘變菌株HE值見表2。
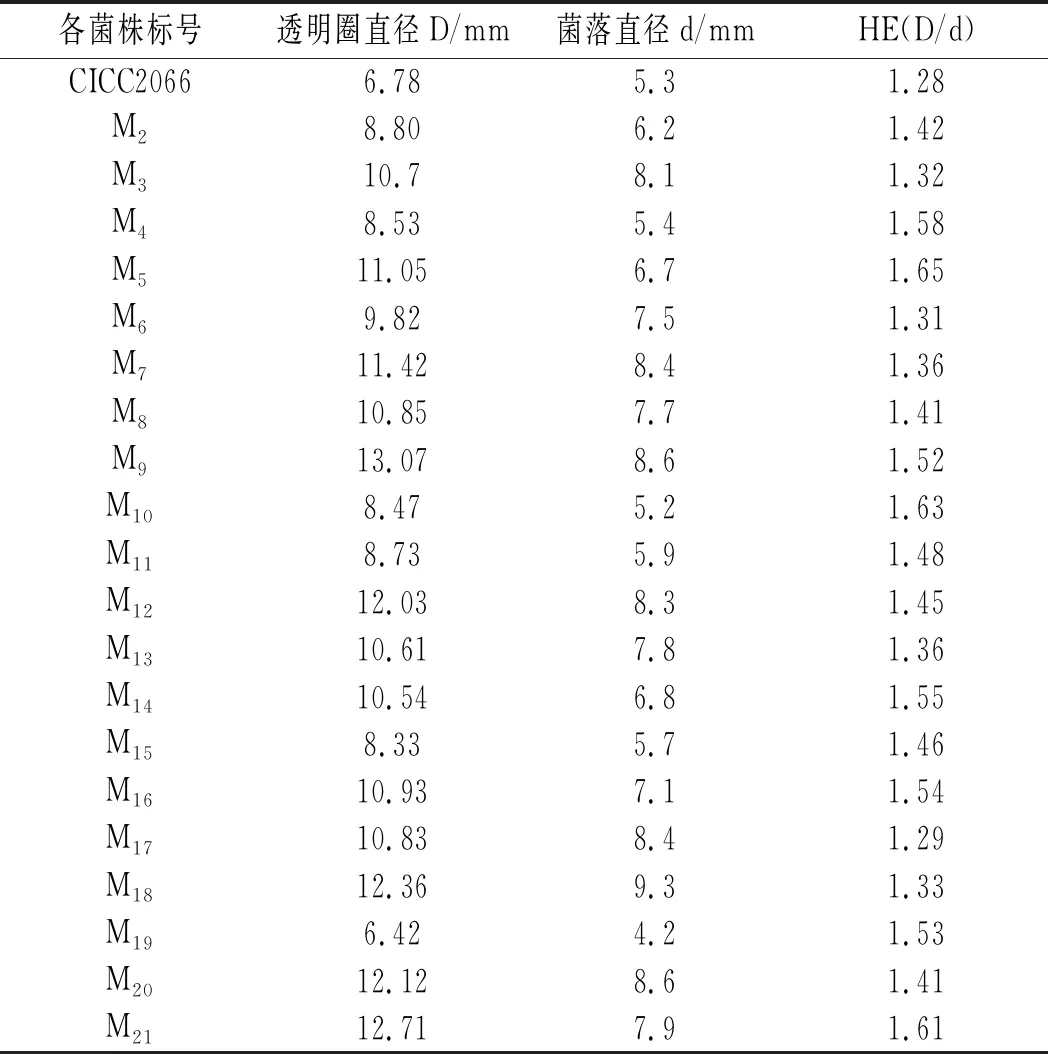
表2 出發菌株和各誘變菌株的HE值Table 2 The HE values of original strains and mutagenic strains
由表2可知,CICC2066的HE值為1.28,M5的HE值最大,為1.65,比CICC2066高1.23倍,初步說明該菌株的產酶能力較其他菌株強,在培養過程中,M5菌株在48 h左右菌落顏色就變成黃綠色,產生大量孢子,此時其他菌落為白色,或者剛有孢子出現,說明M5菌株較其他菌株生長更快。將初次篩選得到的20株誘變菌株保存到PDA斜面上備用以及進行下一步的復篩實驗。
將初篩得到的20株米曲霉菌株接種到制曲培養基中,在培養溫度35 ℃、接種量1%(濃度為1×107個/mL)的條件下制曲62 h時分別檢測其氨肽酶的活性,結果見圖3。
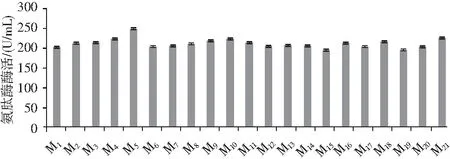
圖3 復篩時氨肽酶在62 h的活性Fig.3 The aminopeptidase activity at 62 h during rescreening
由圖3可知,CICC2066氨肽酶活性為201.4 U/mL,在誘變處理后的菌株中,M5菌株氨肽酶的活性最大,達到246.3 U/mL,較出發菌株提高了1.21倍,其他誘變菌株中,比CICC2066氨肽酶活性高的菌株有M2、M3、M4、M5、M8、M9、M10、M11、M12、M13、M14、M16、M17、M18、M20、M21,比CICC2066氨肽酶活性低的有M6、M7、M15、M19。在ARTP誘變的初次篩選中,選取的HE值均大于CICC2066,制曲培養結果表明米曲霉產氨肽酶的穩定性存在差異,造成氨肽酶活性降低的原因可能是在培養過程中培養條件對米曲霉代謝能力產生影響,導致米曲霉產氨肽酶的活性發生變化,而M5菌落在初篩時HE值最大,制曲培養后氨肽酶活性也最大,說明M5菌株不僅產氨肽酶能力高,而且具有一定的產酶穩定性。將M5菌株培養一段時間后,用凍存管收集其孢子并用20%的甘油于-80 ℃保存。
2.4 ARTP技術誘變后遺傳穩定性檢測
生產菌種容易出現退化、連續傳代引起菌株產酶能力下降等問題,因此檢測菌種遺傳穩定性很有必要。將M5菌株連續培養5代,在溫度35 ℃、接種量1%(濃度為1×107個/mL)、制曲培養62 h的條件下檢測其遺傳穩定性,結果見圖4。
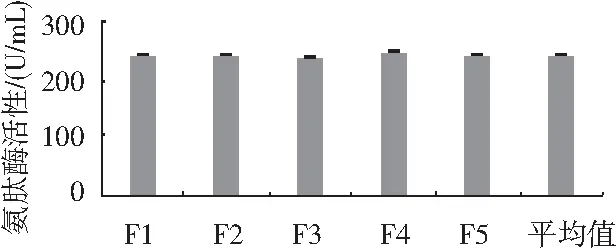
圖4 誘變菌株遺傳穩定性檢測Fig.4 The detection results of genetic stability of mutagenic strains
由圖4可知,第1代M5產氨肽酶活性為243.1 U/mL,第5代氨肽酶活性為245.3 U/mL,最高氨肽酶活性為249.3 U/mL。氨肽酶活性維持在241.2~249.3 U/mL,氨肽酶活性差異不大,表明M5菌株具有遺傳的穩定性。
2.5 常壓室溫等離子誘變篩選的M5菌株與出發菌株CICC2066的對比
將M5菌株與CICC2066菌株在培養溫度為35 ℃、接種量為1%(濃度為1×107個/mL)的條件下接種到制曲培養基中,分別測定不同時間段的氨肽酶活性,檢測結果見圖5。

圖5 不同時間段M5菌株與CICC2066菌株的氨肽酶活性Fig.5 The aminopeptidase activity of M5 and CICC2066 strains at different time periods
由圖5可知,M5菌株在培養時間24~50 h內氨肽酶活性上升平緩,在64 h時氨肽酶活性達到峰值,為246.1 U/mL,隨著發酵時間的繼續上升,氨肽酶活性開始下降,在培養72 h時發酵結束,氨肽酶活性為220.3 U/mL。CICC2066菌株在培養時間24~42 h內氨肽酶活性變化平緩,在42~62 h內氨肽酶活性上升快,在60 h時氨肽酶活性達到峰值190.1 U/mL,隨后開始下降,在72 h發酵結束時氨肽酶活性為171.2 U/mL。
孢子指標的檢測是考察米曲霉菌株優良性的一項重要指標,孢子的生長決定米曲霉長勢進而影響其代謝能力,在培養條件為時間62 h、培養溫度35 ℃、孢子液濃度1×107個/mL、PDA平板培養條件下對M5和CICC2066孢子的生長情況進行比較,結果見圖6。

圖6 CICC2066和M5的孢子掃描電鏡對比圖(250×)Fig.6 The scanning electron microscope comparison of spores of CICC2066 and M5(250×)
由圖6可知,M5菌株孢子直徑Δd=4.02 μm,CICC2066直徑Δd=3 μm,M5孢子直徑比CICC2066大1.02 μm,從外觀來看,經ARTP技術處理后孢子生理形態發生變化,M5孢子中間較為凹陷,形狀多接近于橢球形,孢子生理形態的變化對米曲霉代謝能力是否存在關聯還需進一步研究。
在培養溫度為35 ℃,孢子液濃度為1×107個/mL,PDA平板培養62 h后,對M5菌株和CICC2066菌株的菌落生長狀況進行對比,見圖7。

圖7 CICC2066和M5的菌落生長對比圖Fig.7 The colony growth comparison of CICC2066 and M5
由圖7可知,在相同培養的條件下,M5菌株菌落更大,顏色為黃綠色,說明有大量孢子產生,菌落密集且連續,而同時期培養的CICC2066菌落較小,顏色多為白色,少數為黃綠色或者淺黃色,說明M5菌株生長更快,表明ARTP技術對米曲霉菌落生長速度產生影響。
在培養溫度為35 ℃,孢子接種量為1%(濃度為1×107個/mL)的條件下制曲培養62 h,對M5和CICC2066成曲進行比較,結果見圖8。由圖8可知,M5菌株所成的成曲較CICC2066蓬松,成曲顏色為黃綠色,表明有大量孢子產生,同時期CICC2066多為白色,少數成曲呈淡黃色,且CICC2066存在大量白色的菌絲體,表明M5比CICC2066生長更快,與平板培養結果一致。

圖8 CICC2066和M5成曲對比圖Fig.8 The comparison of CICC2066 and M5 finished kojis
3 結論
采用ARTP誘變技術,通過平板初篩、制曲復篩等方法成功篩選到一株氨肽酶酶活提高的米曲霉菌株,其氨肽酶活性比出發菌株CICC2066高1.21倍。將M5菌株傳代5次,其氨肽酶活性在241.2~249.3 U/mL,表明該菌株具有良好的遺傳性。M5在產酶能力上相比于CICC2066,在64 h時其酶活性達到峰值246.1 U/mL,比CICC2066酶活性峰值190.1 U/mL高出1.21倍,在72 h發酵結束后,其氨肽酶的活性仍比CICC2066高1.13倍,說明ARTP技術提高了CICC2066的產酶能力。經掃描電鏡檢測,M5菌落的孢子直徑較CICC2066更大,且孢子生理形態發生變化,經過PDA平板培養和制曲培養發現,M5較CICC2066在生長狀態上存在差異,表明孢子生理形態對菌落生長產生一定影響,但孢子生理形態的改變對產酶能力是否有影響還需進一步研究。

