溫度與觸覺感受器的發現與研究進展
——2021年諾貝爾生理學或醫學獎解讀
解恒昌,付小雨,沈偉
上海科技大學 生命科學與技術學院,上海 201210
北京時間2021年10月4日,2021年諾貝爾生理學或醫學獎評選結果揭曉。諾貝爾獎委員會宣布將今年的諾貝爾生理學或醫學獎授予戴維·朱利葉斯(David Jay Julius)和阿登·帕塔普蒂安(Ardem Patapoutian)以表彰他們在“發現溫度和觸覺感受器”方面作出的巨大貢獻。本文對辣椒素受體TRPV1和機械力受體PIEZO的發現過程及最新進展作以綜述。
1 TRPV1與PIEZO的發現
感知和適應環境的能力對于所有生物體的生存都是必不可少的,觸覺、本體感覺、溫度感覺使生物體能夠感受外界環境和自身狀態,在復雜的自然環境中存活。發現介導這些感覺的受體,是解碼這些感覺的基礎,并可促進人們對痛覺和本體感覺異常疾病的理解。
戴維·朱利葉斯出生于1955年,先后在麻省理工學院和加州大學伯克利分校獲得本科和博士學位,隨后在哥倫比亞大學諾貝爾生理學或醫學獎獲得者理查德·阿克塞爾(Richard Axel)實驗室進行博士后訓練。朱利葉斯在博士后期間利用表達克隆技術鑒定了5-羥色胺1C受體。他將體外克隆的候選cDNA導入非洲爪蟾的卵母細胞中進行異源表達,驗證表達細胞對5-羥色胺的敏感性,最終發現了5-羥色胺1C受體[1]。
1989年,朱利葉斯在加州大學舊金山分校建立了自己的實驗室。由于對“自然界中的天然物質如何與人類受體相互作用”這一科學問題的興趣,朱利葉斯逐漸從對5-羥色胺受體研究轉向克隆辣椒素受體。他認為對辣椒素受體作用的深入探究有助于科學家對痛覺更深入地了解。朱利葉斯與他的博士后研究員邁克爾·凱瑟琳(Michael J. Caterina)進行了候選文庫的克隆表達和篩選。他們用嚙齒動物的背根神經節制作了cDNA文庫,使用這些cDNA分批次轉入對辣椒素不敏感的細胞,最終分離出單個的cDNA克隆,將它轉入細胞可以使原本對辣椒素沒有反應的細胞對辣椒素產生反應,并將其命名為香草素受體1(VR1)[2](圖1)。隨后的功能實驗中,朱利葉斯等發現該受體對溫度敏感,高熱量導致表達該受體的細胞鈣離子內流,其激活閾值大于40°C,接近于熱痛。至此,朱利葉斯鑒定出辣椒素受體TRPV1,并建立起該受體與溫度感受和痛覺的聯系。在小鼠中,TRPV1在傷害性神經元中表達,并被證實參與感受傷害性疼痛及炎癥性痛覺過敏[3]。隨后,朱利葉斯實驗室通過類似的方法還鑒定了薄荷醇受體TRPM8,并發現其同時也是感應冷刺激(<15°C)的受體[4]。
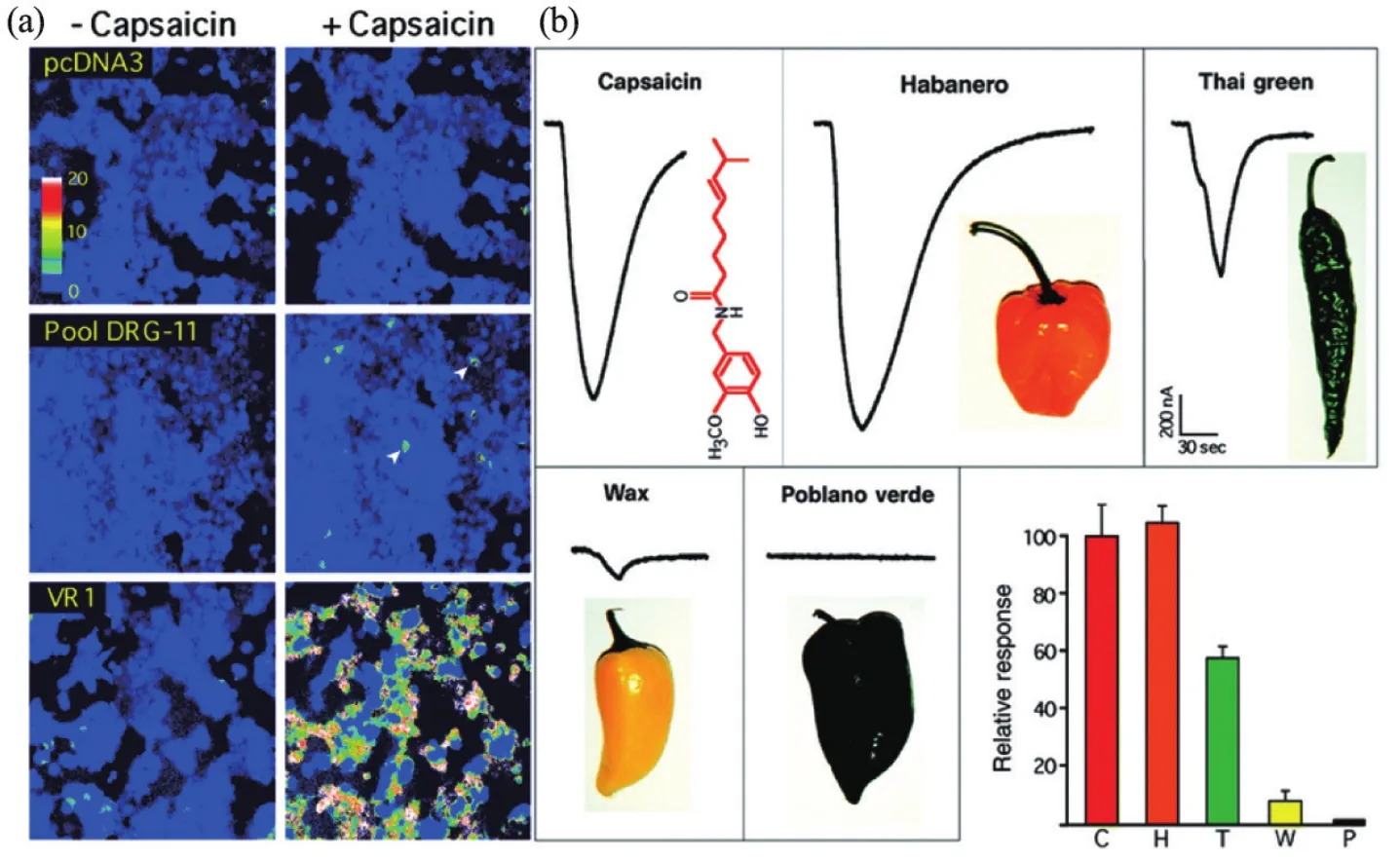
圖1 辣椒素受體TRPV1的發現[2]。(a)用cDNA克隆庫轉染的HEK293細胞。在DRG-11池中,一些細胞對辣椒素有反應。經過反復實驗,鑒定了一個對應于TRPV1(VR1)的克隆。(b)表達VR1的卵母細胞對辣椒素(10 μmol/L)和4種辣椒提取物的反應
阿登·帕塔普蒂安出生于1967年,曾在黎巴嫩的貝魯特美國大學學習化學,而后在加州大學洛杉磯分校獲得細胞和發育生物學學士學位,在加州理工學院獲得發育生物學博士學位。他在加州大學舊金山分校完成了博士后階段的工作后,于2000年加入斯克里普斯研究所(The Scripps Research Institute)。
帕塔普蒂安在事業發展的早期也加入溫度受體的研究,曾與朱利葉斯實驗室同時分別發現了冷覺受體TRPM8[5]。隨后,帕塔普蒂安開始關注更為復雜的機械力感受機制。他和他的博士后伯特蘭·科斯特(Bertrand Coste)首先篩選確定Neuron2A細胞系可以感受機械壓力,并對其表達基因進行分析。他們確定了72個候選基因,并對候選基因進行RNA干擾以分別沉默這些基因的表達,對沉默后的細胞系進行壓力測試并使用膜片鉗記錄其電流。最終,他們發現使用RNA沉默的辦法敲除FAM38A基因可以消除機械力激活的電流,該基因表達的蛋白被命名為PIEZO1(希臘語為壓力的意思)[6](圖2)。將PIEZO1表達在人胚胎腎細胞細胞系(HEK-293)中,可以使原本對機械力不敏感的細胞產生機械力敏感電流。隨后根據PIEZO1同源分析又發現了第二個機械力敏感通道PIEZO2[6]。PIEZO2在背根神經節感覺神經元中表達,隨后在轉基因小鼠中發現敲除PIEZO2的小鼠缺乏輕觸感覺。此外,PIEZO2還參與小鼠本體感受,缺失會導致小鼠運動不協調和肢體位置異常。至此,帕塔普蒂安等鑒定出了一種全新的脊椎動物機械力敏感通道,并確認它們在機體觸覺和本體感覺中的關鍵性作用。
自此,以朱利葉斯和帕塔普蒂安兩位科學家為首的科研團隊發現了溫度感覺和觸覺的關鍵受體,其中TRP通道是介導溫度感覺和相關痛覺的核心,PIEZO通道是機體具有觸覺和本體感覺的關鍵。兩位科學家的工作拓展了感覺神經生物學的維度,揭示了機體感知世界的生物學基礎,解開了軀體感覺如何讓我們感受物理世界并與之互動的未解之謎。在朱利葉斯和帕塔普蒂安的工作基礎上,科學家對機體溫度感覺和觸覺的了解不斷加深,在這一領域涌現出大量的研究成果。現在已經發現,除了作為光、溫度和疼痛的感受器外,擁有7個亞族的TRP通道家族也在呼吸系統和心血管系統疾病如哮喘、心衰等方面發揮關鍵作用,并在前列腺癌等多種癌癥的遷移以及中風、皮膚病等多種疾病中被報道有所參與[7]。而PIEZO家族在終端觸覺、本體感覺中發揮重要作用,并通過分布在血管和肺部的神經末梢感知壓力,影響紅細胞體積和血管生理功能,引發多種人類遺傳疾病[8](詳見第2部分)。此外,科學家還依據TRP和PIEZO的結構和功能開展了痛覺和本體感覺失調疾病的藥物研發[8-9](詳見第3部分)。
2 TRP蛋白與PIEZO蛋白的研究進展
TRP家族首次在果蠅光感受突變體中被鑒定,都由6個跨膜結構域組成,它們組成四聚體復合物發揮功能,可分為TRPC、TRPV、TRPM、TRPN、TRPA亞家族及進化距離更遠的TRPP及TRPML亞家族[10-11]。TRP蛋白家族進化上保守,在果蠅、線蟲、斑馬魚、嚙齒類動物及靈長類動物中,對視覺、味覺、機械感覺、溫度感覺都有重要的作用。TRPV1蛋白結構是使用冷凍電鏡解析的第一個膜蛋白結構,由朱利葉斯和程亦凡實驗室在2013年合作完成[12-13]。冷凍電鏡解析蛋白結構表明,TRPV1有兩個離子通過位點,在陽離子傳導孔的兩端形成兩個突出的物理結構,辣椒素的結合位點位于靠近細胞質側的膜深處的口袋。最近的一項結構研究表明,有害熱量會在辣椒素結合的TRPV1通道中產生兩種構象門控轉變:第一個過渡態為通道打開做好準備,而第二個過渡態導致通道打開[14]。
除TRPV1外,其中至少7種TRP蛋白被證明在哺乳動物溫度感應中發揮作用,展現出不同的溫度閾值,被稱為thermoTRP[15]。TRPV1表達在背根神經節和所發出的C類神經纖維中,還表達于支配膀胱和氣道的感覺纖維和下丘腦中[10,16-20]。敲除TRPV1的小鼠可以完全抑制辣椒素引起的傷害性痛覺,但是對低度熱的響應基本完整,只有傷害性高熱才存在差異。因此TRPV1并不能完全解釋熱感受現象,必然還存在著其他的熱感應機制。Vriens等人[21]報道了TRPM3作為有害熱量的感受器之一,然而在敲除TRPV1和TRPM3的小鼠中,有害熱的反射并沒有完全消除。最終,Vandewauw等人[22]發現TRPM3/TRPV1/TRPA1的三敲除小鼠基本失去了對傷害性熱刺激的響應。與TRPV1形成鮮明對比的是,TRPM8敲除小鼠完全失去了辨別中等低溫(10~26°C)的能力,說明此單一通道足以介導此溫度范圍的感受現象[23]。此外,另外的幾個thermoTRP被認為也可以感受熱:TRPV2在高熱環境下被激活(52°C),TRPV3和TRPV4在溫暖環境中激活(33°C和27~42°C)[24-27](圖3)。thermoTRP在外周及中樞神經中如何參與溫度感應和反饋性調節體溫也是當前神經生物學和生理學關注的重要焦點問題。
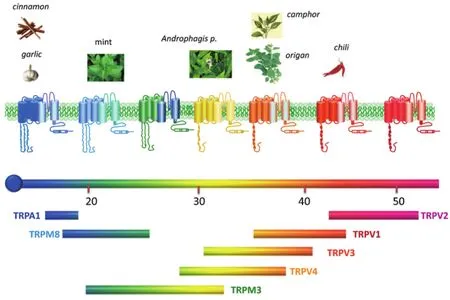
圖3 溫度瞬時受體電位(TRP)通道[27]。從結構上講,thermoTRP是四聚體,每個亞基包含6個跨膜結構域(S1~S6)、1個連接跨膜S5和S6的疏水孔環,以及細胞質側的N-和C-末端。除了TRPM8,所有thermoTRP在N端都具有可變數量的錨蛋白重復結構域。thermoTRP顯示出從有害的寒冷(TRPA1)到有害高溫(TRPV2)的不同熱閾值。每個thermoTRP也被特定的天然或合成化合物激活,會誘導人類產生相關的熱感和疼痛感
PIEZO1是迄今為止鑒定出的最大的跨膜離子通道亞基。帕塔普蒂安、楊茂君、肖百龍、李雪明、羅德里克·麥金農(Roderick MacKinnon)等實驗室的工作揭示了PIEZO1和PIEZO2的高分辨率結構,并表明這些通道形成具有中心離子傳導孔和三個外圍大型機械傳感螺旋槳形葉片的同三聚體結構[28-29]。當對膜施加機械力時,彎曲的葉片變平并導致中心孔的開口,帶有彎曲葉片的螺旋槳狀結構產生較大的平面內膜面積膨脹,從而感知到精細機械力[30-31]。
帕塔普蒂安的實驗室在發現PIEZO1與PIEZO2之后的10年里,在小鼠與人中對這兩個機械力敏感的離子通道蛋白的功能進行了多方面的研究。PIEZO1在血管發育與重塑以及血壓調節中有重要作用,參與淋巴瓣形成,調節角質形成、細胞遷移和傷口愈合。PIEZO1將機械力與紅細胞體積聯系起來,非洲人群中常見的piezo1等位基因E275del可導致紅細胞脫水并減輕瘧原蟲感染。PIEZO1的功能獲得性突變會導致脫水遺傳性口型紅細胞增多癥,并且個體可能會隨著年齡增長出現鐵過載癥狀。PIEZO1的功能喪失性突變與常染色體隱性遺傳淋巴管發育不良有關。PIEZO2在膀胱尿路上皮和支配感覺神經元中都充當傳感器。PIEZO2是一種氣道拉伸傳感器,它所介導的氣道支配感覺神經元內的機械轉導對于在出生時建立有效的呼吸和維持成人的正常呼吸至關重要。若PIEZO2發生功能獲得性突變,會導致一種遠端關節彎曲疾病亞型。PIEZO蛋白的詳細功能介紹及突變可能導致的疾病見表1。如何以PIEZO分子為突破口理解人類本體等多種復雜機械力的感受機制,以及如何利用結構生物學理解PIEZO相關突變的致病機制是當前研究的重要熱點。
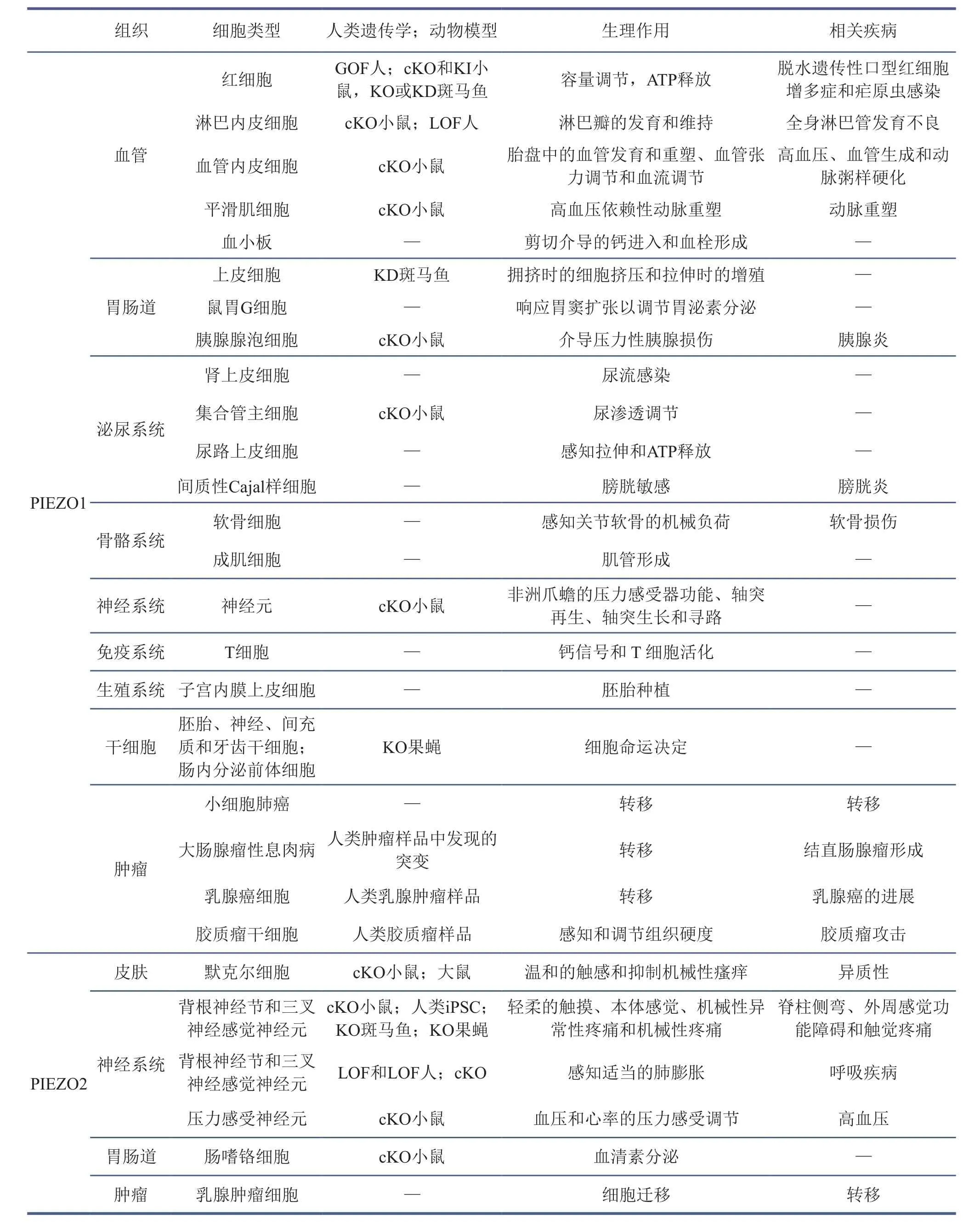
表1 PIEZO蛋白的表達與功能[8]
3 TRPV1和PIEZO的藥物研發
當前治療疼痛的藥物市場仍然由已經存在了幾十年的藥物主導,慢性疼痛的治療常常不能令人滿意。如阿片類藥物雖然是有效的止痛藥,但作用于中樞神經系統,也會使人上癮。避免阿片類藥物副作用的合理策略是針對疼痛通路的起點——產生疼痛的傷害感受器研發新藥[32]。因此,制藥公司對響應有害刺激的TRP通道表現出極大的興趣。高劑量的辣椒素和位點特異性注射被臨床證明在骨關節炎患者、帶狀皰疹后神經痛和糖尿病多發性疼痛患者中有緩解疼痛的作用。但由于辣椒素會引發強烈的初始疼痛反應,并會引起體溫改變[33],限制了患者的耐受劑量[34]。為了減少這種不利影響,已經開發了“非刺激性”TRPV1激動劑,如olvanil (NE19550)和MRD-652,它們在受體的激活動力學方面與辣椒素不同[35-36]。這些化合物顯示在疼痛的動物模型中是有效果的,但其臨床價值仍有待證明。此外,TRPV1、TRPA1及TRPV4在呼吸系統中廣泛表達,被認為參與哮喘、慢性阻塞性肺病(COPD)的病理過程[37-38]。一種口服的、生物可利用的小分子TRPA1選擇性拮抗劑GDC-0334在呼吸系統疾病的臨床前模型中可以抑制幾種物種的咳嗽反應、氣道平滑肌高反應性和水腫形成,但其臨床效果有待試驗驗證[39]。此外,TRPV1拮抗劑PAC-14028(現處于III期臨床試驗階段)可改善皮膚屏障功能并緩解特應性皮炎患者的瘙癢[40]。遺傳失活(Trpv1-/-小鼠)或小分子拮抗劑BCTC291對TRPV1的藥理阻斷,均可使口服葡萄糖耐量和葡萄糖刺激的胰島素分泌得到改善。TRPV1拮抗劑XEN-D0501目前正在2型糖尿病(T2DM)患者中進行II期臨床試驗,具有良好的耐受性和安全性[41]。
PIEZO1和PIEZO2的非特異性阻滯劑包括RR、釓(Gd3+)以及肽毒素 GsMTx-4。2015年,帕塔普蒂安實驗室篩選到了PIEZO1的第一個激動劑Yoda1[42]。3年后,肖百龍實驗室篩選到了PIEZO1的另外兩種激動劑Jedi1和Jedi2[43]。而PIEZO2因為其快速失活的動力學特性仍未找到特異性激動劑。總的來說,當前機械力敏感受體的藥理學研究仍處于起步階段,缺乏高特異性的激動劑和拮抗劑,然而這對于機械力敏感受體相關的藥物開發是至關重要的。鑒于PIEZO1在各種組織和細胞類型中廣泛的生物學作用,一個明顯的挑戰是如何在實現理想治療效果的同時限制副作用。至于PIEZO2,雖然目前的研究表明它在外周感覺系統中的作用相對有限,但它參與多種基本的體感功能,這也可能對實現機械性異常性疼痛的特異性抑制提出挑戰。識別PIEZO2介導其特定功能的感覺神經元類型可能會提高細胞靶向的特異性,而外用PIEZO2拮抗劑可能是專門治療機械性異常性疼痛的一種選擇。
4 結語
2021年度諾貝爾生理學或醫學獎的工作是繼1914年“前庭器官的生理和病理方面工作”、1967年“視黃醛參與視覺形成機制的詮釋”、2004年“人體氣味受體和嗅覺系統組織方式的研究”后,又一次獲得諾貝爾獎的感覺神經生物學領域的研究。兩位科學家的出色工作發現了溫度感覺與觸覺這兩種極為重要但又“非經典的”(不依賴于某一特定器官)感覺受體。其鑒定出的分子如TRPV1、TRPM8、PIEZO1、PIEZO2等蛋白作為分子開關,打開了解碼人類溫度、痛覺和機械力感覺等相關生理過程的大門。它們所介導的生理和病理功能正在被一一闡釋。其他相關的重要科學問題,如人體的體溫如何穩定在37°C、冬眠的生物學機制、本體感覺的產生及神經環路等也將有望解決。

