莪術二酮通過VEGF/VEGFR2信號通路對肝癌HepG2細胞微環境下HHSEC增殖的影響
曹如柔 周堅 王其美 章茜 王容容 陳茂
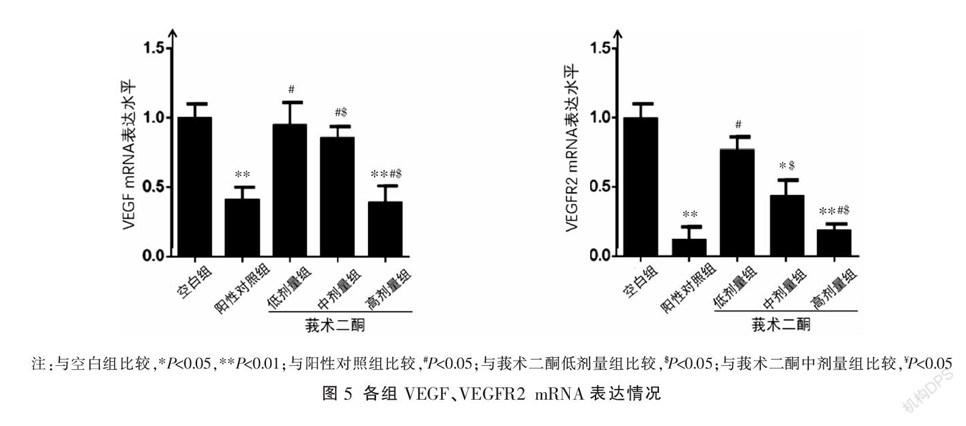
〔摘要〕 目的 探討莪術二酮對肝癌HepG2細胞微環境下的人肝竇內皮細胞(human hepatic sinusoidal endothelial cells, HHSEC)增殖的抑制作用,并闡明其可能機制。方法 CCK-8法檢測不同濃度(0.5%、1%、2%、4%、8%)的HepG2細胞上清液處理HHSEC后的細胞增殖率;HHSEC分為空白組、陽性對照組及莪術二酮低、中、高劑量組,分別予以M199培養基、含1 μg/L順鉑注射液的M199培養基、0.5、1、2 μg/L濃度的莪術二酮工作液培養。應用RT-PCR法和Western blot法檢測不同濃度莪術二酮干預后HHSEC內的VEGF、VEGFR2 mRNA及蛋白表達情況。結果 2%、4%及8%的HepG2細胞上清液可促進HHSEC的增殖(P<0.05);在4% HepG2細胞上清液作用下,0.5、1、2 μg/L莪術二酮均可抑制HepG2細胞上清液對HHSEC的增殖作用(P<0.05),隨著濃度的增加,HHSEC增殖率降低明顯,不同濃度組間差異均有統計學意義(P<0.05)。在HepG2細胞微環境下,與空白組相比,莪術二酮高劑量組HHSEC中VEGF mRNA和蛋白表達明顯降低(P<0.01),莪術二酮中、高劑量組VEGFR2 mRNA和蛋白的表達均明顯降低(P<0.01)。結論 莪術二酮對HepG2細胞微環境下的HHSEC具有抗增殖活性,其作用機制可能與抑制HepG2細胞微環境下HHSEC中VEGF和VEGFR2的表達有關。
〔關鍵詞〕 肝癌;莪術二酮;VEGF/VEGFR2;HepG2細胞;人肝竇內皮細胞
〔中圖分類號〕R285.5 ? ? ? 〔文獻標志碼〕A ? ? ? ?〔文章編號〕doi:10.3969/j.issn.1674-070X.2021.12.004
The Effect of the Curdione on the Proliferation of HHSEC Under the Microenvironment of
HepG2 Cells via VEGF/VEGFR2 Signaling Pathway
CAO Rurou1, ZHOU Jian2*, WANG Qimei2, ZHANG Xi2, WANG Rongrong2, CHEN Mao2
(1. Hunan University of Chinese Medicine, Changsha, Hunan 410208, China; 2. Department of Oncology,
The Affiliated Hospital of Hunan Academy of Chinese Medicine, Changsha, Hunan 410006, China)
〔Abstract〕 Objective To explore the inhibitory effect of curdione on the proliferation of human hepatic sinusoidal endothelial cells (HHSEC) in the microenvironment of liver cancer HepG2 cells, and to clarify its possible mechanism. Methods CCK-8 method was used to detect the cell proliferation rate of HepG2 cells supernatants of different concentrations (0.5%, 1%, 2%, 4%, 8%) after HHSEC treatment; HHSEC was divided into blank group, positive control group and curdione low, medium, and high-dose groups, and were cultured with M199 medium, M199 medium containing 1 μg/L cisplatin injection, and working solution of curdione at 0.5, 1, and 2 μg/L. RT-PCR and Western blot were used to detect the expression of VEGF and VEGFR2 mRNA and protein in HHSEC after the intervention of different concentrations of curdione. Results 2%, 4% and 8% of HepG2 cells supernatants can promote the proliferation of HHSEC (P<0.05); under the action of 4% HepG2 cells supernatants, 0.5, 1, 2 μg/L curdione can inhibit the proliferation effect of HepG2 cells supernatant on HHSEC (P<0.05). With the increase of concentration, the proliferation rate of HHSEC decreased significantly, and the differences between groups of different concentrations were statistically significant (P<0.05). In the microenvironment of HepG2 cells, compared with the blank group, the expression of VEGF mRNA and protein in HHSEC of the curdione high-dose group was significantly reduced (P<0.01), and the expression of VEGFR2 mRNA and protein in curdione middle and high-dose group were both decreased (P<0.01). Conclusion Curdione has anti-proliferative activity on HHSEC in HepG2 cells microenvironment, and its mechanism of action may be related to inhibiting the expression of VEGF and VEGFR2 in HHSEC in HepG2 cells microenvironment.
〔Keywords〕 hepatic carcinoma; curdione; VEGF/VEGFR2; HepG2 cells; human hepatic sinusoidal endothelial cells
原發性肝癌是一種常見的惡性消化道腫瘤,我國每年約有40萬以上的原發性肝癌患者,占世界肝癌總人數的一半以上[1-2]。莪術二酮作為莪術中含量最高的倍半萜類物質,其藥理作用廣泛,具有抗血小板聚集、減輕化療不良反應等活性,還能降低人乳腺癌HCC1937細胞的遷移和侵襲能力[3-5],但其抗癌機制尚未明確。血管內皮生長因子(vascular endothelial growth factor, VEGF)是促進血管生成的調節因子[6],其高表達對誘導腫瘤血管生成,加速肝癌的發生、增殖、轉移起重要作用[7-8]。VEGF基因沉默可抑制肝癌細胞HepG2的遷移和侵襲的能力[9],提示了腫瘤微血管生成對肝細胞癌發生和發展的重要意義。故課題組推測莪術二酮抑制肝癌細胞生長的作用可能也與抑制腫瘤微血管生成有關,因此,本研究主要就莪術二酮干預肝癌細胞促進人肝竇內皮細胞(human hepatic sinusoidal endothelial cells, HHSEC)增殖的機制進行初步探討。
1 材料
1.1 ?細胞株
人肝癌細胞株HepG2由湖南中醫藥大學中西醫結合心腦疾病防治實驗室贈予;HHSEC購自北京裕恒豐科技有限公司。
1.2 ?藥物、試劑與儀器
莪術二酮(上海雅吉生物科技有限公司,批號:13657-68-6,純度>98%);DMEM培養基(批號:AF29494674)、青鏈霉素(批號:J200029)、胰酶(批號:25200072)、胎牛血清(批號:SAG-01U-02)、M199培養基(批號:11875093)、BCA蛋白測定試劑盒(批號:SF249041)均購自美國Thermo Fisher公司;RT-PCR試劑盒(美國ABI公司,批號:A1A1169)。
SW-CJ-2F型垂直超凈工作臺(中國蘇州安泰空氣技術有限公司);HERAcell 240i型CO2培養箱(美國Thermo Fisher公司);EIX808U型全自動酶標儀(美國BioTek公司);powerpac型電泳儀、Mini Trans-Blot C型轉膜儀(美國Bio-Rad公司);G:BOX Chemi XRQ型化學發光成像系統(美國Syngene公司)。
2 方法
2.1 ?細胞培養
人肝癌細胞株HepG2采用10%胎牛血清、100 IU/mL青霉素和 100 g/L鏈霉素的高糖DMEM培養基置于37 ℃、5% CO2培養箱中培養,隔天傳代1次。
HHSEC采用5%胎牛血清、1%內皮細胞生長因子的M199培養基置于37 ℃、5% CO2的培養箱中培養,隔天換液1次,3天傳代1次。
2.2 ?藥物處理
將匯合度達95%以上的HepG2細胞培養基吸出,通過截留分子量為5000 Da的超濾管3000 r/min,離心半徑5 cm,離心15 min,濃縮回收細胞上清液,每10 mL上清液濃縮成100 μL,用M199培養基稀釋配制成含0.5%、1%、2%、4%、8% HepG2細胞上清液的M199工作液培養基。以10 mL M199培養基濃縮成100 μL作為空白組工作液,用不同濃度M199工作液培養基培養HHSEC,選取最佳濃度。將莪術二酮單體溶于DMSO,配制成1 μg/mL的母液,無菌微孔濾膜過濾,-20 ℃保存。實驗時用2%的M199工作液培養基稀釋成0.5、1、2 μg/L濃度的藥液。
2.3 ?CCK-8檢測莪術二酮對HHSEC增殖的影響
取對數生長期的HHSEC,制成單細胞懸液,均勻接種于96孔板,每孔1×104個細胞,于37 ℃、5% CO2培養箱中培養6 h后,棄舊培養基,HHSEC分為空白組、陽性對照組及莪術二酮低、中、高劑量組,每孔分別加入100 μL M199培養基、含1 μg/L順鉑注射液的M199培養基、0.5、1、2 μg/L濃度的莪術二酮工作液,每組設置5個復孔,置于37 ℃、5% CO2培養箱中培養24 h。按說明書每孔加入10 μL CCK-8試劑,37 ℃孵育2 h,用酶標儀測定450 nm波長處吸光度。
2.4 ?建立非接觸式細胞共培養模型
參照非接觸式體外血腦屏障模型[10],建立HepG2-HHSEC共培養模型。運用transwell 3412細胞培養池,在上孔中接種2.5×105個HepG2細胞,下孔中接種1×105個HHSEC,37 ℃、5% CO2培養箱中共培養24 h,進行后續實驗。
2.5 ?RT-PCR法檢測莪術二酮對HHSEC中VEGF、VEGFR2 mRNA表達的影響
細胞分組及培養同“2.3”項,按試劑盒說明書分別提取transwell 3412細胞培養池下孔中HHSEC總RNA、逆轉錄cDNA,RT-PCR分別檢測VEGF、VEGFR2 mRNA的相對表達量。引物序列由華大基因公司合成,VEGF引物為:正向引物5'-GTGGACATCCGCAAAGAC-3',反向引物5'-AAAGGGTGTAACGCAACTAA-3';VEGFR2引物為:正向引物 5'-AAGAGATTTGT?TCCGGATGG-3',反向引物5'-CGGCAGATAGCT?
CAATTTCA-3'。
2.6 ?Western blot法檢測莪術二酮對HHSEC中VEGF、VEGFR2蛋白表達的影響
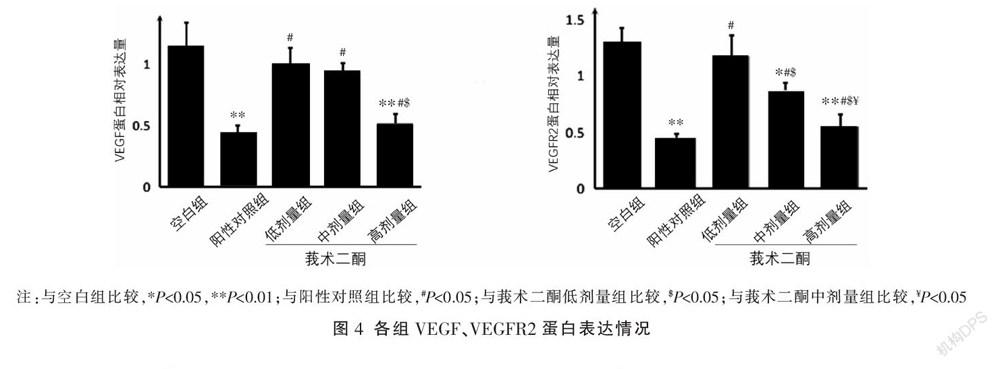
細胞分組及培養同“2.3”項,按試劑盒說明書提取transwell 3412細胞培養池下孔中HHSEC的總蛋白,BCA法檢測蛋白濃度。Western blot進行蛋白電泳、轉膜及成像,經凝膠成像分析系統分析結果。
2.7 ?統計學分析
所有數據使用SPSS 18.0分析,結果以“x±s”表示,數據符合正態分布及方差齊性時,多組均數間比較采用單因素方差分析,組間兩兩比較采用LSD方法。數據不滿足正態性時,使用非參數檢驗進行分析。P<0.05表示差異有統計學意義。
3 結果
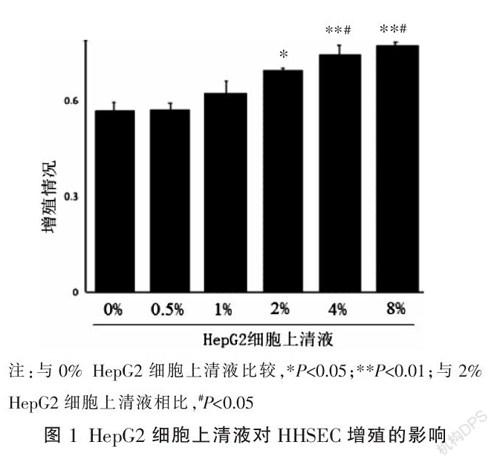
3.1 ?HepG2細胞對HHSEC增殖的影響
在相同培養條件下,與0% HepG2相比,2%~8%的HepG2細胞上清液促進了HHSEC的增殖(P<0.05)。與2% HepG2細胞上清液相比,4%、8% HepG2細胞上清液均明顯促進HHSEC的增殖(P<0.05)。選取4% HepG2細胞上清液加入M199培養基以促進HHSEC增殖。見圖1。
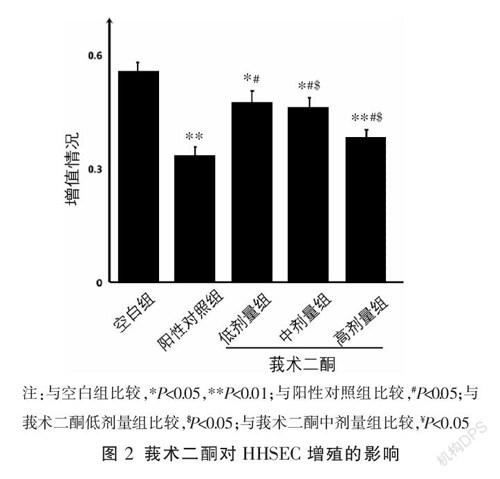
3.2 ?莪術二酮對HepG2細胞微環境下的HHSEC增殖的影響
在相同的作用條件下,與空白組相比,陽性對照組及莪術二酮低、中、高劑量組均可抑制HHSEC的增殖(P<0.05);隨著莪術二酮濃度的增加,HHSEC抑制率增加,不同濃度組間差異均有統計學意義(P<0.05)。與陽性對照組比較,莪術二酮低、中劑量組HHSEC抑制率升高(P<0.05),莪術二酮高劑量組抑制率差異無統計學意義(P>0.05)。見圖2。
3.3 ?莪術二酮對HepG2細胞微環境下HHSEC中VEGF、VEGFR2 mRNA及蛋白表達的影響
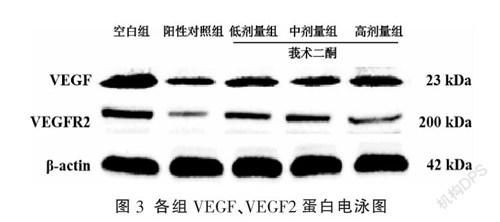
在HepG2細胞微環境下,與空白組比較,陽性對照組、莪術二酮高劑量組的HHSEC中VEGF、VEGFR2 mRNA和蛋白表達明顯降低(P<0.01),莪術二酮中劑量組中VEGFR2 mRNA和蛋白表達降低(P<0.05),莪術二酮低劑量組中VEGF、VEGFR2 mRNA和蛋白表達輕度降低,差異無統計學意義(P>0.05);與陽性對照組比較,莪術二酮低、中劑量組VEGF mRNA及蛋白表達、莪術二酮低劑量組VEGFR2 mRNA及蛋白表達、莪術二酮中劑量組VEGFR2蛋白表達升高(P<0.05),莪術二酮高劑量組VEGF、VEGFR2 mRNA及VEGF蛋白表達降低差異無統計學意義(P>0.05),莪術二酮高劑量組VEGFR2蛋白表達升高(P<0.05)。隨著莪術二酮濃度的增加,HHSEC中VEGF、VEGFR2 mRNA和蛋白表達均明顯降低,除莪術二酮低劑量組與中劑量組VEGF蛋白表達比較無差異外,其余組間差異均有統計學意義(P<0.05)。見圖3-5。
4 討論
肝癌作為世界第四大惡性腫瘤,肝內血管豐富,新生血管形成能促進瘤體的生長,從而導致腫瘤組織增生及轉移,引起疾病惡化[11]。目前,針對肝癌的治療主要是通過外科或局部放化療,損傷腫瘤組織的同時也嚴重影響了自身細胞,中藥作為中醫學的瑰寶,其在肝癌的防治中發揮著十分重要的作用,研究[12]表明,臭牡丹提取物可能通過提高Bax/Bcl-2蛋白表達水平而促進肝癌細胞凋亡。
中藥莪術味辛、苦,性溫,歸肝、脾經,具有破血行氣、消積止痛、活血化瘀等功效。多應用于癥瘕痞塊、瘀血經閉、胸痹心痛、食積氣滯等病癥。其藥用活性成分主要為揮發油類成分、姜黃素類及多糖,具有抗腫瘤、抗炎鎮痛、抗血小板聚集、抗血栓等作用[13],用于腫瘤的治療療效確切。莪術二酮作為其含量最高的倍半萜類物質,研究[14-15]表明其對肝癌HepG2細胞的增殖、凋亡有顯著影響,而其是否引起腫瘤組織微環境的改變,降低血管生成目前并不明確。本研究探討莪術二酮對HepG2肝癌細胞干預下HHSEC增殖作用的影響,試圖闡明其對肝癌細胞微環境中血管新生的影響及其可能的作用機制。
本研究首先證實2%~8%的肝癌HepG2細胞的上清濃縮液均可促進HHSEC增殖,提示肝癌細胞可生成促進內皮細胞增殖的物質,該物質可能起到促進肝內血管生成的作用,而0.5、1、2 μg/L的莪術二酮明顯抑制了該增殖效應,藥物濃度越高,抑制效應越明顯,呈正相關趨勢。
VEGF是生理和病理情況下血管生成的主要調節者,VEGF與其受體VEGFR2的相互作用在肝癌微血管新生過程中均扮演著重要角色,是機體中最重要且最直接的促血管生成通路。通過復雜的信息傳導通路直接促進腫瘤新生血管的生成,為腫瘤組織增殖、轉移提供適合的微環境[16-20]。本研究結果顯示莪術二酮抑制了HHSEC自身對VEGF的合成并降低了HHSEC中VEGFR2的表達,莪術二酮濃度越高,抑制作用越明顯,并且莪術二酮高劑量組的抑制作用接近于順鉑,提示莪術二酮對HHSEC具有直接抑制作用,降低了肝癌微環境下HHSEC的增殖。
綜上所述,莪術二酮對HepG2細胞微環境下的HHSEC具有抗增殖活性,其作用機制可能是直接抑制了HHSEC中VEGF和VEGFR2的表達。此外,該體外實驗不僅為莪術二酮用于肝癌治療提供了實驗基礎,同時也為肝癌臨床藥物研究提供了新的方向。
參考文獻
[1] WALLACE M C, PREEN D, JEFFREY G P, et al. The evolving epidemiology of hepatocellular carcinoma: A global perspective[J]. Expert Review of Gastroenterology & Hepatology, 2015, 9(6): 765-779.
[2] BRAY F, FERLAY J, SOERJOMATARAM I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA: A Cancer Journal for Clinicians, 2018, 68(6): 394-424.
[3] FANG H, GAO B B, ZHAO Y L, et al. Curdione inhibits thrombin-induced platelet aggregation via regulating the AMP-activated protein kinase-vinculin/talin-integrin αIIbβ3 sign pathway[J]. Phytomedicine, 2019, 61: 152859.
[4] WU Z M, ZAI W J, CHEN W, et al. Curdione ameliorated doxorubicin-induced cardiotoxicity through suppressing oxidative stress and activating Nrf2/HO-1 pathway[J]. Journal of Cardiovascular Pharmacology, 2019, 74(2): 118-127.
[5] 孫學然,鄭 ?嵐.莪術二酮對乳腺癌HCC1937細胞遷移和侵襲的影響及機制[C]//第十七屆全國中西醫結合腫瘤學術大會論文集,上海,2019:125.
[6] 張大紅,朱衛國,岳 ?順.血管內皮生長因子在原發性肝癌組織中的表達及臨床意義[J].細胞與分子免疫學雜志,2011,27(2):199-200,202.
[7] CHOI S H, CHUNG A R, KANG W, et al. Silencing of hypoxia-inducible factor-1β induces anti-tumor effects in hepatoma cell lines under tumor hypoxia[J]. PLoS One, 2014, 9(7): e103304.
[8] ASADA N, TANAKA Y, HAYASHIDO Y, et al. Expression of fibroblast growth factor receptor genes in human hepatoma-derived cell lines[J]. In Vitro Cellular & Developmental Biology Animal, 2003, 39(7): 321-328.
[9] 宋向芹,司秀文,張 ?芳,等.VEGF基因沉默對肝癌HepG2細胞侵襲和遷移的影響[J].山東醫藥,2012,52(46):42-43.
[10] 張樂裕,劉晨陽,于顧然.黃芪甲苷對Aβ1-42誘導的體外血腦屏障模型損傷的影響及機制探究[J].中草藥,2018,49(17):4099-4105.
[11] 石鑫林,王繼洲,姜洪池,等.影響肝癌患者肝移植術后復發的血管因素研究進展[J].器官移植,2019,10(6):727-730.
[12] 胡 ?琦,蔣佳紅,李 ?游,等.臭牡丹含藥血清對人肝癌MHCC97-H細胞周期和凋亡的影響[J].湖南中醫藥大學學報,2019,39(12): 1444-1448.
[13] 陳曉軍,韋 ?潔,蘇 ?華,等.莪術藥理作用的研究新進展[J].藥學研究,2018,37(11):664-668,682.
[14] LI J, BIAN W H, WAN J, et al. Curdione inhibits proliferation of MCF-7 cells by inducing apoptosis[J]. Asian Pacific Journal of Cancer Prevention, 2014, 15(22): 9997-10001.
[15] KONG Q, SUN F Y, CHEN X P. Impact of fixed-dose combination of germacrone, curdione, and furanodiene on breast cancer cell proliferation[J]. Cell Journal, 2013, 15(2): 160-165.
[16] 孫 ?曉,夏 ?蕾,何流漾,等.中性粒細胞在腫瘤免疫中的研究進展[J].中國免疫學雜志,2018,34(4):609-612.
[17] 張 ?琳,高 ?勇.復方紅豆杉膠囊對Walker-256移植性肝癌大鼠HIF-1α、VEGF及PCNA表達的影響[J].陜西中醫,2019,40(2):148-151,155.
[18] 陳蘭羽,馬繼征,劉詠梅,等.基于HIF-1α介導的VEGF mRNA表達探討膈下逐瘀湯抗肝纖維化血管新生的機制[J].中草藥,2019,
50(2):449-456.
[19] 張雅莉,刁云云,張春澤.雷公藤甲素對人子宮頸微血管內皮細胞活性的抑制[J].中國腫瘤生物治療雜志,2019,26(2):196-199.
[20] PEINADO H, ZHANG H, MATEI IR, et al. Pre-metastatic niches: organ-specific homes for metastases[J]. Nature Reviews Cancer, 2017, 17(5):302-317.
〔收稿日期〕2020-10-24
〔基金項目〕湖南省中醫藥研究院科研課題(201711)。
〔作者簡介〕曹如柔,女,在讀碩士研究生,研究方向:中西醫結合防治惡性腫瘤。
〔通信作者〕*周 ?堅,男,副主任醫師,碩士,E-mail:15973124870@163.com。

