甘蔗間作不同豆科作物對甘蔗植株內生細菌多樣性的影響
肖健 陳思宇 孫妍 楊尚東 譚宏偉

摘 ?要:解析甘蔗間作不同豆科作物對甘蔗植株內生細菌多樣性的影響,旨在評價甘蔗間作不同豆科作物對甘蔗植株健康狀況及抗性的作用效果。結果發現,與單作的甘蔗(CK)相比,甘蔗間作黃豆顯著提高甘蔗內生細菌的多樣性和豐富度;間作綠豆雖然有助于提升甘蔗植株內生細菌多樣性與豐富度,但與CK之間無顯著差異;間作花生導致甘蔗植株內生細菌多樣性與豐富度顯著降低。門分類水平,與CK相比,間作處理甘蔗植株中變形桿菌門(Proteobacteria)內生細菌豐度占比急劇下降,放線菌門(Actinobacteria)以及屬于其他(others)分類的內生細菌豐度占比上升;屬分類水平,與CK相比,間作處理甘蔗植株中泛菌屬(Pantoea)和Burkholderia-Paraburkholderia屬豐度占比下降,紅球菌屬(Rhodococcus)內生細菌豐度占比上升;另一方面,unclassified_f__Micrococcaceae和Pseudarthrobacter是間作甘蔗植株中特有的內生細菌優勢屬,但同時草螺菌屬(Herbaspirillum)和Williamsia屬內生細菌缺失。此外,Rubrobacter、norank_f__MSB-1E8、類諾卡氏菌屬(Nocardioides)、norank_c__Actinobacteria、norank_f__Euzebyaceae、Gaiella、Defluviicoccus、norank_f__Elev-16S-1332、norank_o__Acidimicrobiales、norank_f__Propionibacteriaceae、norank_o__Gaiellales、norank_f__Gemmatimonadaceae是甘蔗/黃豆間作(A)處理中甘蔗植株特有的內生細菌優勢屬;鏈霉菌屬(Streptomyces)、馬賽菌屬(Massilia)、分枝桿菌屬(Mycobacterium)、甲基桿菌屬(Methylobacterium)、Sinomonas、羅思河小桿菌屬(Rhodanobacter)、金黃色桿菌屬(Chryseobacterium)、根霉菌屬(Rhizomicrobium)是甘蔗/綠豆間作(B)處理中甘蔗特有的內生細菌優勢屬。甘蔗/花生間作模式下,甘蔗植株根系中不存在特有的內生細菌優勢屬;而草螺菌屬(Herbaspirillum)和Williamsia是甘蔗單作模式下甘蔗植株根系中特有的內生細菌優勢屬。甘蔗間作黃豆和綠豆不僅有助于提升甘蔗植株根系內生細菌的多樣性與豐富度,而且改善了甘蔗植株根系內生細菌群落結構組成,尤其間作黃豆效果更佳;與之相反,甘蔗間作花生無助于提高甘蔗植株根系內生細菌的多樣性與豐富度,亦不利于改善甘蔗植株根系內生細菌群落結構組成。
關鍵詞:甘蔗;豆科作物;間作;內生細菌
中圖分類號:S566.1 ? ? ?文獻標識碼:A
Abstract: To evaluate the effects of intercropping with different legume crops on the health and resistance of sugarcane plants,endophytic bacterial diversity in the roots of sugarcane were analyzed. The diversity and richness of endophytic bacteria in the roots of sugarcanes under sugarcane / soybean intercropping system were significantly increased than those of monoculture (CK). Even though the diversity and richness of endophytic bacteria in the roots of sugarcanes under sugarcane / mung bean system were higher than those of CK, there was no significant differences between each other. Moreover, they were significantly decreased under sugarcane / peanut systems compared to CK. At the phylum level, the abundances of Proteobacteria, Actinobacteria and the phylum of other were all increased under sugarcane intercropping systems compared to CK. At the genus level, the abundances of Pantoea and Burkholderia- Paraburkholderia were decreased, but that of Rhodococcus was increased under sugarcane intercropping systems compared to CK. In addition, compared to CK, the unclassified_f__Micrococcaceae and Pseudarthrobacter were the specific dominant endophytic bacterial genera, but also lost the Herbaspirillum and Williamsia in roots of sugarcanes under different intercropping systems. Moreover, the Rubrobacter, norank_f__MSB-1E8, Nocardioides, norank_c__Actinobacteria, norank_f__Euzebyaceae, Gaiella, Defluviicoccus, norank _f__Elev-16S-1332, norank_o__Acidimicrobiales, norank_f__Propionibacteriaceae, norank_o__Gaiellales, norank_f__Gemmatimonadaceae were the specific dominant endophytic bacterial genera in roots of sugarcanes under sugarcane/soybean intercropping (A) system. The Streptomyces, Massilia, Mycobacterium, Methylobacterium, Sinomonas, Rhodanobacter, Chryseobacterium and Rhizomicrobium were the specific dominant endophytic bacterial genera in roots of sugarcanes under sugarcane/mung bean intercropping (B) system. And there were no specific dominant endophytic bacterial genera in roots of sugarcanes under sugarcane/peanut intercropping (C) system. However, the Herbaspirillum and Williamsia were the specific dominant endophytic bacterial genera in roots of sugarcanes under monoculture (CK) system. The diversity and richness of endophytic bacteria were not only promoted, but also the composition of endophytic bacterial communities in roots of sugarcanes was improved by intercropping with soybean and mung bean. In particularly, the better effect was intercropping with soybean. By contrast, not only the diversity and richness, but also the composition of endophytic bacterial communities in roots of sugarcanes was all deceased under sugarcane/peanut intercropping system.
Keywords: sugarcane (Saccharum spp. hybrids); legume crops; intercropping; endophytic bacteria
DOI: 10.3969/j.issn.1000-2561.2021.11.018
甘蔗(Saccharum spp. hybrids)是一種重要的糖料作物,在世界各地被用作生物燃料和可再生生物能源[1]。中國是世界上僅次于巴西和印度的第三大產糖國家。中國甘蔗大約90%種植于華南與西南地區,包括廣西、廣東和云南。特別是廣西,自1993年以來,是中國最大的甘蔗生產和制糖省份,占全國糖產量的65%以上[2]。然而,與世界產糖大國相比,我國甘蔗單位面積產量偏低仍然是制約我國蔗糖產業國際市場競爭力的一大問題。為了提高甘蔗產量,我國蔗民盲目使用化肥。例如,我國甘蔗生產中年均氮肥用量高達600~800 kg/hm2,而產糖大國巴西,相應的施用量僅為60 kg/hm2,即使是宿根蔗的用量亦僅為80~120 kg/hm2[3]。另一方面,過度施用化肥不僅土壤生態系統失衡,亦會破壞水生生態系統功能[4]。因此,甘蔗生產中,如何減少化肥,尤其是氮肥的投入,提高單位面積甘蔗產量,是廣西甘蔗可持續發展的迫切需求。
間作是在同一塊地里同時種植兩種或兩種以上的作物,雖然是一種古老的種植制度,但至今仍在世界各地廣泛實施[5]。間作模式不僅為種植系統帶來了有計劃的植物多樣性,而且提升了種植系統應對環境壓力和病蟲害的能力[6]。唐秀梅等[7]發現,現階段國內外甘蔗間作種植模式主要包括甘蔗/豆科作物(甘蔗/大豆、豌豆、花生)、甘蔗/禾本科(甘蔗/玉米、小麥)、甘蔗/蔬菜(甘蔗/馬鈴薯、芥菜、洋蔥、大蒜)等;至今的研究已發現,間作模式不僅可以提高作物對光、水、土、肥的利用效率,改善土壤狀況,而且顯著提高了土壤微生物數量和微生物多樣性;但大部分涉及甘蔗間作的研究主要集中在甘蔗產量效益、光合品質、土壤肥力以及病蟲草害等方面[8-9]。
另一方面,植物內生細菌是指在其生活史的一定階段或全部階段,生活于健康植物的各種組織和器官的細胞間隙或細胞內的細菌[10]。植物內生細菌與宿主植物關系密切,內生細菌還具有溶磷、解鉀、固氮等作用以及產生鐵載體、抗菌活性物質和植物生長激素來促進宿主植物生長、營養物質積累和提高抗逆性(抗病蟲害、高溫、鹽堿或干旱等)[11],內生細菌群落結構一定程度上具有指示甘蔗植株健康生長與否以及抗性大小的作用。然而,至今,甘蔗間作對指示甘蔗植株健康生長狀況以及抗性大小的內生細菌群落結構影響的研究鮮見報道。
為此,本文基于高通量測序技術,分析甘蔗與不同豆科作物間作模式下,甘蔗植株內生細菌物種組成、群落結構及多樣性的變化規律,旨在為改良甘蔗產區土壤環境、改進栽培管理技術措施以及開發利用內生細菌抗逆和促生等功能提供理論依據。
1 ?材料與方法
1.1 ?試驗地概況
試驗于2017年和2018年在廣西壯族自治區崇左市龍州縣西郊的廣西南亞熱帶農業科學研究所農場(106°47′34″ E,22°19′42″ N)進行。試驗地屬南亞熱帶季風氣候,熱量豐富,雨量充沛,日照充足,冬春微寒,夏炎多雨,秋季溫涼,干濕季分明,濕熱、干冷同季;年無霜期為350 d,有霜期13 d,年平均溫度約22 ℃,年降水量約1273.6 mm;第四紀紅壤土,前作為甘蔗。采樣地土壤理化性質如下:土壤pH 6.2,有機質含量23.3 g/kg,土壤全氮含量1.77 g/kg,速效磷含量12.4 mg/kg,速效鉀含量66.1 mg/kg。
1.2 ?試驗設計
以甘蔗品種‘新臺糖22’為試驗材料,采用隨機區組設計4種種植模式,以甘蔗單作作為對照(CK),以甘蔗/黃豆間作(A),甘蔗/綠豆間作(B),甘蔗/花生間作(C)為處理進行田間試驗。每種種植模式為一個試驗處理,共4個處理,每個處理設3個重復,共12個小區,每個小區5行,行長7 m,甘蔗栽培行距1.8 m,小區面積63 m2。試驗地用大型拖拉機犁耙整地開行后于2018年3月30日種植。甘蔗行間分別栽種黃豆(‘桂春10號’)、綠豆(‘中綠8號’)和花生(‘桂花1026’),所有間作處理均按相同常規田間管理。
1.3 ?樣品采集
2018年5月30日,于甘蔗栽培區隨機采集甘蔗植株樣品。采集甘蔗植株樣品時,先用75%乙醇噴灑鐵鏟進行消毒,在每種間作模式下隨機選取3株長勢一致的甘蔗植株,然后以蔗莖為中心(直徑約60 cm)挖深度約40 cm,形成疏松、環形的根際圈,然后手握植株莖基部用力將整個植株連根帶土拔起,并抖掉附著在根部的土壤,整個蔗兜放入無菌密封袋后,裝入放有冰袋的冰盒中標記并帶回實驗室[12]。植株樣品用無菌水沖洗表面的泥土和附屬物并用無菌濾紙吸干,然后采用75%酒精噴灑消毒后的剪刀采集植株根部樣品,待測。
1.4 ?土壤細菌多樣性分析
根系內生細菌總DNA提取、PCR擴增和序列測定均由上海美吉生物醫藥科技有限公司完成。測序具體類型與引物序列[13-14]如表1所示。具體測序流程:DNA抽提和PCR擴增:根據FastDNA? Spin Kit for Soil試劑盒(MP Biomedicals,USA)說明書進行總DNA抽提,使用NanoDrop2000分光光度計(Thermo Fisher Scientific,USA)檢測DNA濃度和純度,用1%瓊脂糖凝膠電泳檢測DNA提取質量;進行PCR擴增;PCR產物鑒定、純化及定量。IlluminaMiseq測序:回收PCR產物(2%瓊脂糖凝膠),使用AxyPrep DNA Gel Extraction Kit(Axygen,USA)純化,Tris-HCl洗脫,電泳檢測,并用Quantus? Fluorometer (Promega,USA)對回收產物進行檢測定量,構建PE2*300的文庫。使用NEXTFLEX? Rapid DNA-Seq Kit進行建庫,具體流程如下:接頭鏈接;使用磁珠篩選去除接頭自連片段;利用PCR擴增進行文庫模板的富集;磁珠回收PCR產物得到最終的文庫。利用Illumina測序公司MiseqPE300平臺進行測序(上海美吉生物醫藥科技有限公司)。本研究以Shannon和Simpson指數指示內生細菌的多樣性,Chao1和Ace指數指示內生細菌的豐富度。參考Chao等[15]的方法計算Chao1指數,參考Grice等[16]的方法計算Ace指數和Shannon指數:參考Simpson[17]的方法計算Simpson指數,Chao1、Ace和Shannon指數越大,Simpson指數越小,說明樣品的物種豐富度和多樣性越高。
1.5 ?數據處理
數據采用Excel 2019軟件進行計算,采用IBM SPSS Statistics 21統計軟件進行方差分析,采用鄧肯(Duncan’s)法進行顯著性檢驗(P< 0.05),并利用上海美吉生物醫藥科技有限公司的I-sanger云數據分析平臺進行在線數據分析。平均數據以“平均數±標準差(SD)”表示。
2 ?結果與分析
2.1 ?不同間作模式下甘蔗內生細菌OTU聚類分析
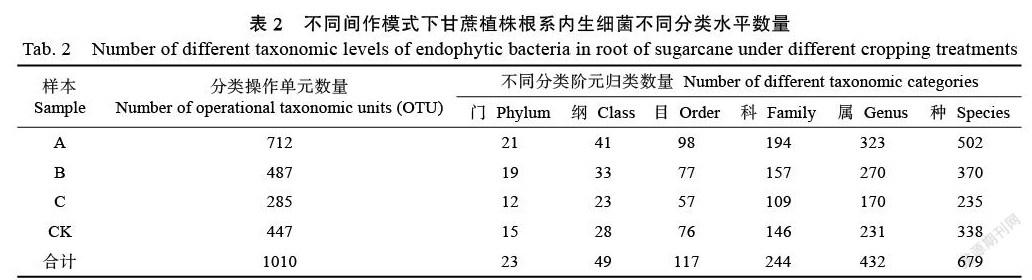
基于高通量測序技術分析,在97%相似度水平對樣品序列進行OTU聚類。由表2可知,不同間作模式下,甘蔗植株根系內生細菌群落隸屬于23門、49綱、117目、244科、432屬、679種、1010 OTU(分類操作單元)。其中,甘蔗/黃豆間作模式(A)下,甘蔗植株根系內生細菌群落隸屬于21門、41綱、98目、194科、323屬、502種和712 OTU;甘蔗/綠豆間作模式(B)下,甘蔗根系內生細菌群落隸屬于19門、33綱、77目、157科、270屬、370種和487 OTU;甘蔗/花生間作模式(C)下,甘蔗根系內生細菌群落隸屬于12門、23綱、57目、109科、170屬、235種和285 OTU,甘蔗單作模式(CK)下,甘蔗根系內生細菌隸屬于15門、28綱、76目、146科、231屬、338種和447 OTU。上述結果表明:甘蔗與黃豆、綠豆間作有助于提高甘蔗根系內生細菌的分類數量,但甘蔗與花生間作不僅無助于提高甘蔗根系內生細菌的分類數量,反而導致根系內生細菌分類數量降低。
2.2 ?不同種植模式下甘蔗內生細菌Alpha分析
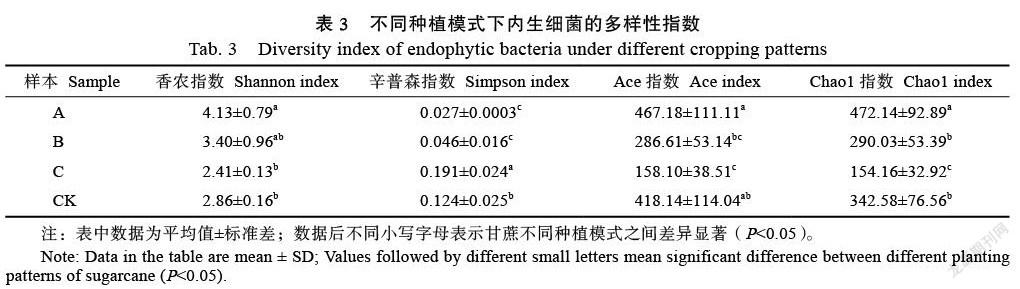
基于美吉云分析平臺,計算不同間作模式下,甘蔗內生細菌的豐富度和多樣性指數。以Shannon和Simpson指數指示細菌的多樣性,Chao1和Ace指數指示細菌的豐富度。由表3可知,與CK相比,A模式下,甘蔗植株根系指示內生細菌多樣性的香農指數顯著高于相應的CK,辛普森指數顯著低于相應的CK;而指示內生細菌豐富度的Chao1指數同樣顯著地高于相應的CK,Ace指數雖然高于相應的CK,但差異不顯著;B模式下,甘蔗植株根系中指示內生細菌多樣性的香農指數雖然高于相應的CK,但差異不顯著,辛普森指數則顯著低于相應的CK;指示內生細菌豐富度的Ace指數和Chao1指數均低于相應的CK,但差異均不顯著;C模式下,甘蔗植株根系中指示內生細菌多樣性的香農指數低于相應的CK,但差異不顯著;但辛普森指數顯著高于相應的CK;同時,指示內生細菌豐富度的Ace指數和Chao1指數均顯著低于相應的CK;另一方面,不同間作處理之間,A模式下,甘蔗植株根系中指示內生細菌多樣性的香農和辛普森指數雖然與B模式之間無顯著差異,但均顯著高于或低于相應的C模式間作處理;此外,指示甘蔗植株根系內生細菌豐富度的Ace和Chao1指數亦以甘蔗間作黃豆處理為最高,依次分別為B和C處理,且不同間作處理間除Ace指數在B和C處理之間無顯著差異外,其余間作處理間均存在顯著差異。上述結果表明,甘蔗和黃豆間作提升甘蔗植株根系內生細菌多樣性和豐富度的效果最佳,其次為甘蔗/綠豆;甘蔗與花生間作不僅無助于提升甘蔗植株根系中內生細菌的多樣性和豐富度,反而導致甘蔗植株根系中內生細菌多樣性和豐富度降低。
2.3 ?群落組成分析
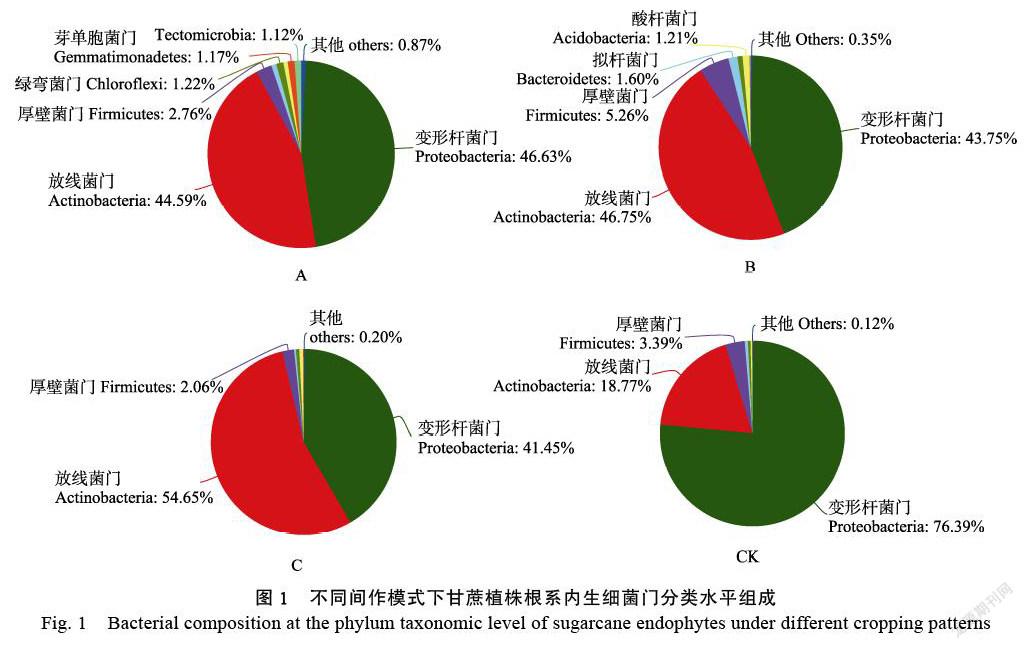
2.3.1 ?不同間作模式下甘蔗內生細菌門分類水平優勢群落分析 ?門分類水平,不同間作模式甘蔗植株根系中,占比大于1%的優勢內生細菌門分類水平數量及占比如圖1所示。A、B、C和CK中,甘蔗植株根系中優勢內生細菌門分類數量分別為6、5、3和3個。其中,A間作模式下,甘蔗植株根系內生細菌優勢細菌門豐度占比順序分別為:變形桿菌門(Proteobacteria,46.63%)>放線菌門(Acti?nobacteria,44.59%)>厚壁菌門(Firm-icutes,2.76%)>綠彎菌門(Chloroflexi,1.22%)>芽單胞菌門(Gemmatimonadetes,1.17%)>Tectom?icro?bia(1.12%)和其他(others,0.87%)。B間作模式下,甘蔗植株根系內生細菌優勢細菌門豐度占比順序分別為:放線菌門(Acti?nobacteria,46.75%)>變形桿菌門(Proteobacteria,43.75%)>厚壁菌門(Firmicutes,5.26%)>擬桿菌門(Bacteroidetes,1.60%)>酸桿菌門(Acidob?acteria,1.21%)和其他(others,0.35%);C間作模式下,甘蔗植株根系內生細菌優勢細菌門豐度占比順序分別為:放線菌門(Actinobacteria,54.65%)>變形桿菌門(Proteo?bacteria,41.45%)>厚壁菌門(Firmicutes,2.06%)和其他(others,0.20%);CK模式下,甘蔗植株根系內生細菌優勢細菌門豐度占比順序分別為:變形桿菌門(Proteobacteria,76.39%)>放線菌門(Actinobacteria,18.77%)>厚壁菌門(Firmicutes,3.39%)和其他(others,0.12%)(圖1)。
與CK相比,甘蔗間作黃豆和綠豆不僅引起變形桿菌門(Proteoba?cteria)細菌豐度占比下降,放線菌門(Actino?bacteria)細菌豐度占比上升,而且還改變了甘蔗植株根系中優勢內生細菌的組成,富集了諸如綠彎菌門(Chloroflexi)、芽單胞菌門(Gemmat?imo?nadetes)、擬桿菌門(Bacteroidetes)和Tectomicrobia門細菌。與之相反,甘蔗間作花生模式缺乏間作黃豆、綠豆類似的效果,甘蔗間作花生模式中,甘蔗植株根系內生細菌優勢群落組成與對照相仿,均由放線菌門(Actinobacteria)、變形桿菌門(Proteobacteria)和厚壁菌門(Firmicutes)組成,僅改變了放線菌門和變形桿菌門的豐度占比。由此推斷,并非所有的甘蔗間作模式均有助于提升甘蔗植株根系內生細菌的多樣性、豐富度和改變內生細菌優勢群落結構組成。
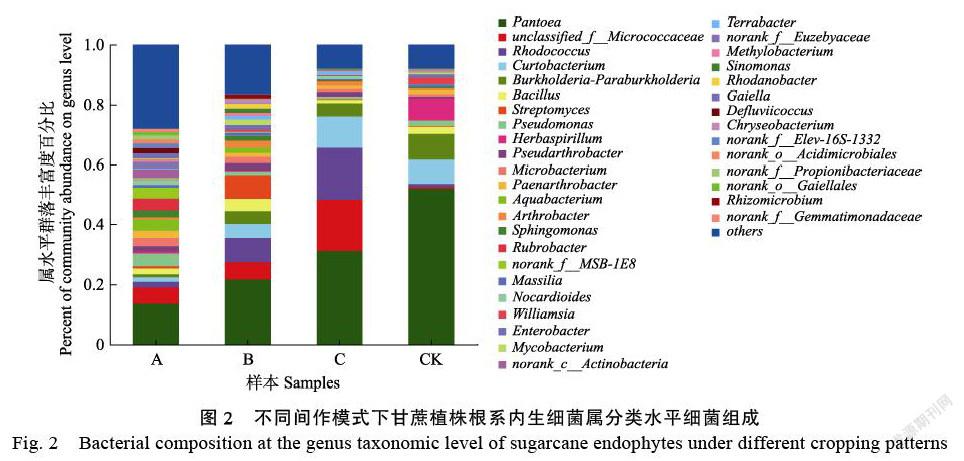
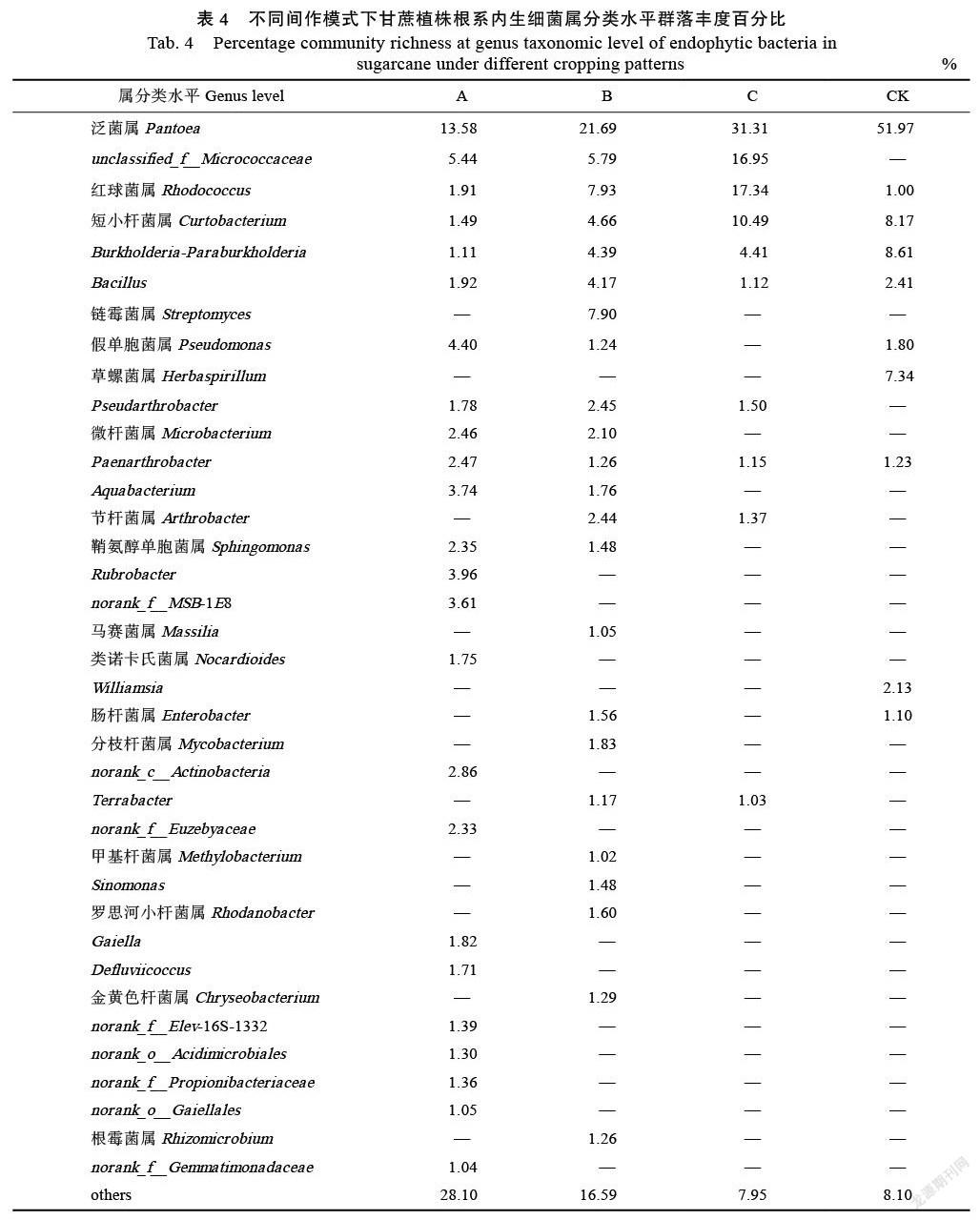
2.3.2 ?不同間作模式下甘蔗植株根系內生細菌屬分類水平優勢菌群分析 ?屬分類水平,不同間作模式下,甘蔗植株根系內生細菌豐度占比大于1%的優勢細菌屬數量及占比如圖2所示。A、B、C和CK處理中,甘蔗植株根系中優勢內生細菌屬分類數量分別為24、23、10和10個。
與對照的甘蔗單作相比,甘蔗間作不同豆科作物后,甘蔗植株根系中泛菌屬(Pant?oea)、Burkholderia-Paraburkholderia屬細菌豐度占比下降,紅球菌屬(Rhodococcus)豐度占比上升;另一方面,unclassified_f__Micrococca?ceae和Pseudarthrobacter富集成為間作模式下甘蔗植株根系特有的優勢內生細菌屬;而草螺菌屬(Herbaspirillum)和Williamsia成為單作模式下甘蔗植株根系中特有的優勢細菌屬。此外,Rubrobacter、norank_f__MSB-1E8、類諾卡氏菌屬(Nocardioides)、norank_c__Actinobacteria、no-ra?nk_f__Euzebyaceae、Gaiella、Defluviicoccus、nora?nk_f__Elev-16S-1332、norank_o__Acidimi?cr?ob-iales、norank_f__Propionibacteriaceae、nor?ank_o__Gaiellales、norank_f__Gemmatimonadac?eae是A模式下,甘蔗植株根系中特有的優勢內生細菌屬;鏈霉菌屬(Stre?ptomyces)、馬賽菌屬(Massilia)、分枝桿菌屬(Mycobacterium)、甲基桿菌屬(Methylob?acterium)、Sinomonas、羅思河小桿菌屬(Rhodano?bacter)、金黃色桿菌屬(Chryseobacterium)、根霉菌屬(Rhizomicrobium)是B模式下,甘蔗植株根系中特有的優勢內生細菌屬;此外,C模式下,甘蔗植株根系中不存在豐度占比大于1%的特有優勢內生細菌屬類(表4)。
2.4 ?物種Venn分析
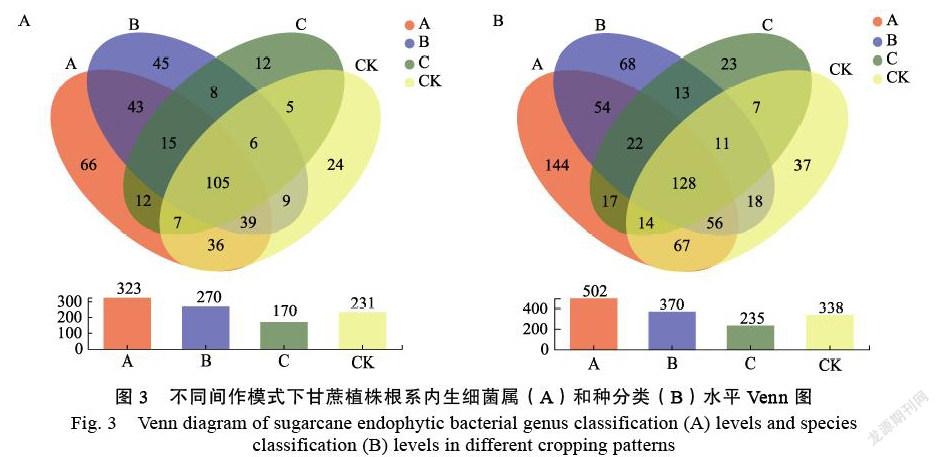
基于屬分類水平(圖3A)和種分類水平(圖3B)Venn圖可知,與對照相比,不同間作模式導致甘蔗植株根系內生細菌的優勢細菌屬和種分類組成發生顯著變化。其中,A、B、C和CK處理中,甘蔗植株根系內生細菌屬的總數量分別為323、270、170和231個,特有的內生細菌屬數量分別為66、45、12和24個。
另一方面,種分類水平,A、B、C和CK模式下,甘蔗植株根系中特有的內生細菌種的數量分別為144、68、23和37個。
上述結果表明:無論是屬亦或是種分類水平, A和B間作模式下,甘蔗植株根系中特有的優勢內生細菌數量均高于相應的CK處理;與之相比,C間作模式下,甘蔗植株根系中特有的優勢內生細菌數量遜色于相應的CK模式。由此推斷,甘蔗間作黃豆和綠豆均有助于富集和提升甘蔗植株根系中內生細菌的優勢菌屬、種水平,但甘蔗間作花生不僅無提升效果,反而導致甘蔗植株根系內生細菌屬、種分類水平數量降低。這一現象可能是甘蔗與花生各自根系分泌物的相互作用有關,有待進一步研究。
2.5 ?群落Heatmap圖分析
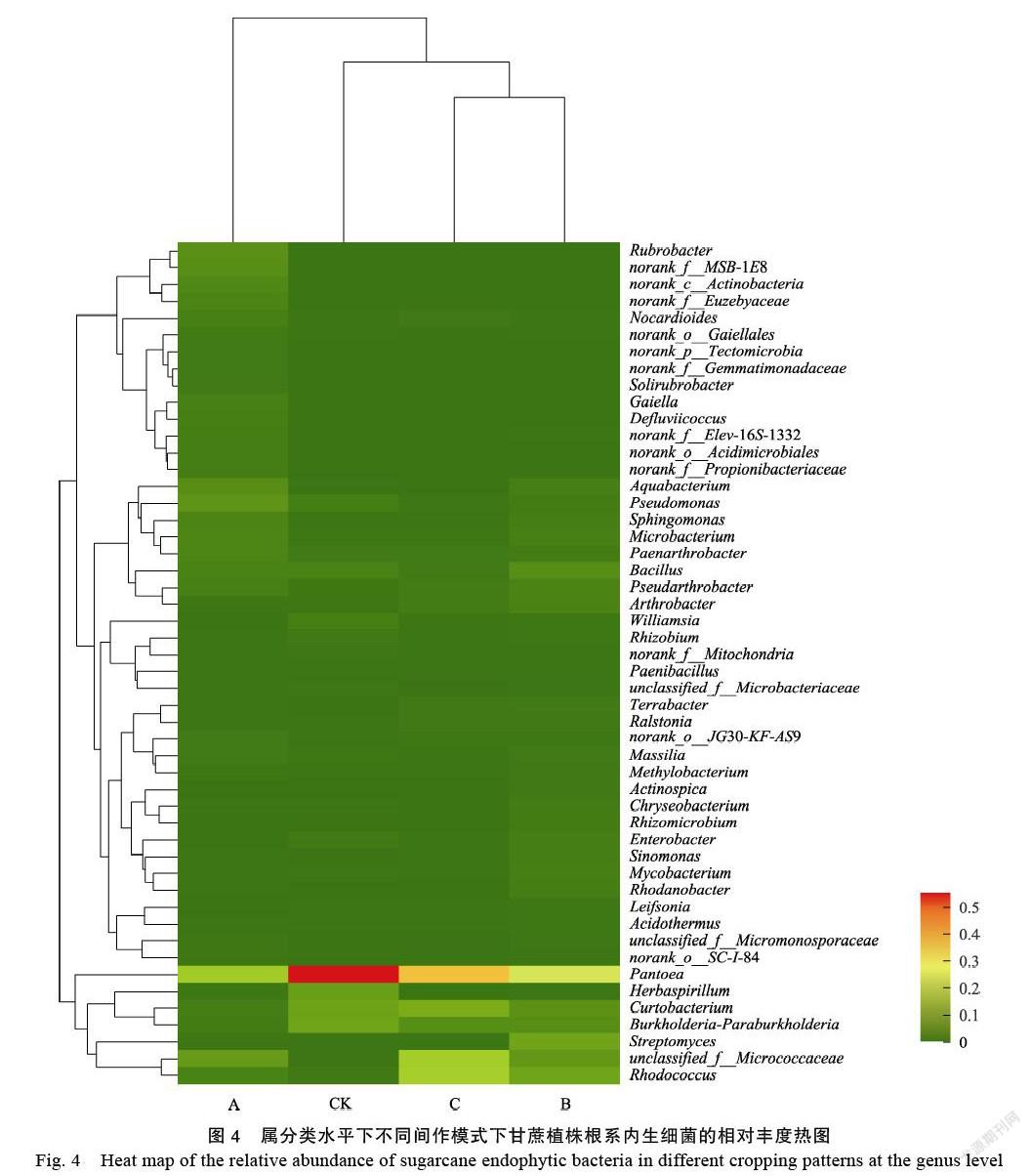
選取不同間作模式下,甘蔗植株中根系內生細菌豐度占比居前50的屬繪制豐度熱圖(圖4)。由圖4上方的樣本層級聚類樹顯示,甘蔗/綠豆和甘蔗/花生間作模式下,甘蔗植株根系內生細菌群落組成更為相似,獨自聚為一個分支;并分別與甘蔗/黃豆以及對照處理(CK)之間存在差異。其中,甘蔗/黃豆間作模式處理改變甘蔗植株根系內生細菌群落組成的效果最強。
3 ?討論
甘蔗是我國乃至世界最重要的糖料及能源作物,也是廣西壯族自治區的主要經濟作物之一[18]。蔗糖業為廣西重要經濟支柱產業之一,是廣西重點發展的“千億元產業”[19]之一。
間作制度對作物產量和土壤礦物有效性呈正相關。研究已表明,間作比相應的單作更有利于植株生產力和養分的獲取[20-21],如我國科研人員在撒哈拉以南非洲地區等不利于作物生長的環境下通過谷物/豆類間作讓作物取得了良好的產量與品質[22]。
微生物是生態系統中功能活躍,開發潛力最大、最寶貴、最豐富的生物資源庫[23]。植物內生細菌除了具有防治病害的發生之外,還具有促進植物生長的作用[24]。至今的研究已發現,植物根際及內生微生物群落結構越豐富,物種越均勻,多樣性越高時,植物抵御病原菌的綜合能力就越強[25-26]。
本文基于高通量測序技術發現,與甘蔗單作(CK)相比,甘蔗間作黃豆顯著提高了甘蔗植株根系內生細菌的多樣性和豐富度;但甘蔗間作綠豆提升甘蔗植株根系內生細菌多樣性和豐富度的效果遜于間作黃豆;同時,甘蔗間作花生不僅無助于提升甘蔗植株根系內生細菌的多樣性與豐富度,反而導致甘蔗植株根系內生細菌多樣性和豐富度下降。實際生產中,甘蔗與許多豆科作物間套作均能獲得良好的經濟收益[27-28]。研究發現,禾本科作物與豆科作物間作可通過豆科作物生物固氮而提高禾本科作物產量[29-34]。楊建波[35]亦研究發現,甘蔗/大豆間作系統中,特別是間作共生期,通過根瘤的衰老解體以及根系分泌物的增加,增加了根際細菌、根瘤菌等的遷移,從而使得甘蔗根系內生細菌、根瘤菌的數量增大。由此推測,與甘蔗單作相比,甘蔗和黃豆和綠豆間作通過促進根際細菌的富集與遷移來使根系內生細菌的數量升高,但甘蔗與花生間作可能缺乏同樣的效果,從而無助于提升甘蔗根系的內生細菌多樣性與豐富度。
與甘蔗單作(CK)相比,門分類水平,甘蔗間作其它作物不僅改變了甘蔗植株根系中內生細菌組成的豐度占比,如:變形桿菌門(Proteo?ba-cteria)細菌占比下降,放線菌門(Actinobacteria)細菌占比上升,而且改變了甘蔗植株根系中內生細菌的群落組成。與甘蔗單作(CK)相比,綠彎菌門(Chloroflexi)、芽單胞菌門(Gemm?atim?onadetes)和Tectomicrobia門細菌是甘蔗/黃豆間作(A)模式下甘蔗植株根系中特有的內生細菌優勢門類;擬桿菌門(Bacteroidetes)和酸桿菌門(Acidobacteria)細菌則是甘蔗/綠豆間作(B)模式下甘蔗植株根系特有的內生細菌優勢門類;甘蔗/花生間作模式下甘蔗植株根系中不存在特有的內生細菌優勢門類。
同樣與甘蔗單作(CK)相比,屬分類水平,甘蔗間作其他作物亦改變了甘蔗植株根系中內生細菌組成的豐度占比,如:泛菌屬(Pantoea)、Burkholderia-Paraburkholderia占比下降,紅球菌屬(Rhodococcus)占比上升;同時亦改變了甘蔗植株根系中內生細菌群落組成。其中,unclassif-ied_f__Micrococcaceae和Pseudarthrobacter是間作模式下甘蔗植株根系中特有的內生細菌優勢屬,而草螺菌屬(Herbaspirillum)和Williamsia是甘蔗單作模式下甘植株根系中特有的內生細菌優勢屬類。另一方面,Rubrobacter、norank_ f__MSB-1E8、類諾卡氏菌屬(Nocardioides)、norank_c__Actinobacteria、norank_f__Euzebyac-eae、Gaiella、Defluviicoccus、nora?nk_f__Elev-16S- 1332、norank_o__Acidimicrobiales、norank_f__Pr-opionibacteriaceae、norank_o__Gaiellales、nor-ank_f__Gemmatimonadacea為是甘蔗/黃豆間作(A)中甘蔗植株根系中特有的內生細菌優勢屬類;鏈霉菌屬(Streptomyces)、馬賽菌屬(Mas-silia)、分枝桿菌屬(Mycobacterium)、甲基桿菌屬(Methylobacterium)、Sinomonas、羅思河小桿菌屬(Rhodanobacter)、金黃色桿菌屬(Chryseobacterium)和根霉菌屬(Rhizomi-crobium)是甘蔗/綠豆間作(B)中甘蔗植株根系中特有的內生細菌優勢屬類;甘蔗間作花生(C)模式下,甘蔗植株根系中不存在豐度占比大于1%的特有優勢內生細菌屬類。
植物內生細菌不僅可以拮抗宿主植物的病原菌,而且可以產生植物激素和鐵載體促進宿主植物生長,并進一步影響植物體內的物質代謝,提高植物對營養物質的利用率研究發現,泛菌屬(Pantoea)細菌具有產多糖、溶磷、IAA、鐵載體、拮抗病原真菌等特性,具有促進植物生長發育[36]的功能;紅球菌屬(Rhodococcus)具有產類胡蘿卜素、各種酶制劑、維生素、有機酸等活性物質,并具有代謝多樣性和提升對多變環境條件的獨特適應能力,在生物修復、生物轉化和生物催化中具有潛在的應用前景[37]。而Pseudarthr-obacter屬細菌從沙漠中分離出來,具有較強的耐旱、耐紫外線照射等的抗逆能力[38]。此外,類諾卡氏菌屬、鞘氨醇單胞菌屬等細菌具有溶磷、產鐵載體以及固氮功能[39],對植物生長具有良好的促生功能。
綜上所述,甘蔗間作黃豆和綠豆不僅有助于提升甘蔗植株根系內生細菌的多樣性與豐富度,而且改善了甘蔗植株根系內生細菌群落結構組成,尤其間作黃豆效果更佳;與之相反,甘蔗間作花生不僅無助于提高甘蔗植株根系內生細菌的多樣性與豐富度,而且不利于改善甘蔗植株根系內生細菌群落結構組成。
參考文獻
[1] Chandel A K, Silva S S D, Carvalho W, et al. Sugarcane bagasse and leaves: Foreseeable biomass of biofuel and bio-products[J]. Journal of Chemical Technology and Bio-technology, 2012, 87(1): 11-20.
[2] Li Y R. China: An emerging sugar super power[J]. Sugar Tech, 2004, 6(4): 213-227.
[3] Li Y R, Yang L T. Sugarcane agriculture and sugar industry in China[J]. Sugar Tech, 2015, 17(1): 1-8.
[4] Robertson G P, Vitousek P M. Nitrogen in agriculture: ba-lancing the cost of an essential resource[J]. Annual Review of Environment and Resources, 2009, 34(1): 97-125.
[5] Solanki M K, Wang Z, Wang F Y, et al. Intercropping in sugarcane cultivation influenced the soil properties and en-hanced the diversity of vital diazotrophic bacteria[J]. Sugar Tech, 2017, 19(2): 136-147.
[6] Brooker R W, Bennett A E, Cong W F, et al. Improving intercropping: a synthesis of research in agronomy, plant physiology and ecology[J]. New Phytologist, 2015, 206(1): 107-117.
[7] 唐秀梅, 蒙秀珍, 蔣 ?菁, 等. 甘蔗間作花生對不同耕層土壤微生態的影響[J]. 中國油料作物學報, 2020, 42(5): 713-722.
[8] 段媛媛, 劉曉洪, 吳佳奇, 等. 間作模式對黃連生理生長性狀及根際土壤理化性質的影響[J]. 生態學雜志, 2020, 39(11): 3676-3685.
[9] 鄭亞強, 張立敏, 楊進成, 等. 甘蔗間作玉米對甘蔗根際微生物代謝功能多樣性的影響[J]. 中國生態農業學報,2016, 24(5): 618-627.
[10] 茍 ?琪, 呂 ?燕, 張 ?濤, 等. 寧夏枸杞葉不同生長時期內生細菌群落動態及其影響因素[J]. 生態學雜志,2020, 39(8): 2593-2601.
[11] 顧美英, 古麗尼沙·沙依木, 張志東, 等. 黑果枸杞不同組織內生細菌群落多樣性[J]. 微生物學報, 2021, 61(1): 152-166.
[12] 楊尚東, 任奎瑜, 譚宏偉. 甘蔗宿根矮化病感病與非感病植株養分含量、根系生長及內生細菌群落的差異[J]. 植物營養與肥料學報, 2020, 26(9): 1591-1599.
[13] Lundbery D S, Lebeis S L, Paredes S H, et al. Defining the core Arabidopsis thaliana root microbiome[J]. Nature, 2012, 488(7409): 86-90.
[14] Davide B, Ruben G, Philipp C, et al. Structure and function of the bacterial root microbiota in wild and domesticated barley[J]. Cell Host and Microbe, 2015, 17(3): 392-403.
[15] Chao A, Wang W H, Chen Y C, et al. Estimating the number of shared species in two communities[J]. Statistica Sinica, 2000, 10(1): 227-246.
[16] Grice E A, Kong H H, Conlan S, et al. Topographical and temporal diversity of the human skin microbiome[J]. Science, 2009, 324(5931): 1190-1192.
[17] Simpson E H. The measurement of diversity[J]. Nature, 1949, 163: 688.
[18] 李楊瑞. 現代甘蔗學[M]. 北京: 中國農業出版社, 2010: 18-20.
[19] 李楊瑞, 楊麗濤, 譚宏偉, 等. 廣西甘蔗栽培技術的發展進步[J]. 南方農業學報, 2014, 45(10): 1770-1775.
[20] Zhang F, Li L. Using competitive and facilitative inter-actions in intercropping systems enhances crop productivity and nutrient-use efficiency[J]. Plant and Soil, 2003, 248(1-2): 305-312.
[21] Wang Z G, Jin X, Bao X G, et al. Intercropping enhances productivity and maintains the most soil fertility properties relative to sole cropping[J]. PLoS One, 2014, 9(12): e113984.
[22] Mucheru-Muna M, Pypers P, Mugendi D, et al. A staggered maize-legume intercrop arrangement robustly increases crop yields and economic returns in the highlands of Central Kenya[J]. Field Crops Research, 2010, 115(2): 132-139.
[23] 韋朝海, 肖美蘭. 水生生態調控及水污染治理中微生物的應用[J]. 應用基礎與工程科學學報, 1999(4): 3-5.
[24] 石晶盈, 陳維信, 劉愛媛. 植物內生菌及其防治植物病害的研究進展[J]. 生態學報, 2006(7): 2395-2401.
[25] 張志紅, 彭桂香, 李華興, 等. 生物肥與甲殼素和惡霉靈配施對香蕉枯萎病的防治效果[J]. 生態學報, 2011, 31(4): 1149-1156.
[26] 喬 ?鵬, 湯 ?利, 鄭 ?毅, 等. 不同抗性小麥品種與蠶豆間作條件下的養分吸收與白粉病發生特征[J]. 植物營養與肥料學報, 2010, 16(5): 1086-1093.
[27] 馮天祥, 王 ?玲, 陳海敏, 等. 植物內生放線菌功能及生物活性物質研究進展[J]. 中國生物工程雜志, 2015, 35(4): 98-106.
[28] Gana A K, Busari L D. Intercropping study in sugarcane[J]. Sugar Tech, 2003, 5(3): 193-196.
[29] 楊曉麗. 甘蔗地間作春花生栽培技術[J]. 中國糖料, 2006(4): 46-47.
[30] 孟慶寶, 方鋒學, 劉海斌, 等. 甘蔗間種菜用大豆對甘蔗產量、品質及間種后綜合經濟效益的影響[J]. 中國農學通報, 2011, 27(24): 169-173.
[31] 吳建明, 李楊瑞, 楊麗濤, 等. 甘蔗間種大豆的試驗[J]. 作物雜志,2011(5): 103-105.
[32] 李志賢, 王建武, 楊文亭, 等. 甘蔗/大豆間作減量施氮對甘蔗產量、品質及經濟效益的影響[J]. 應用生態學報, 2011(3): 713-719.
[33] Gooding M J, Kasyanova E, Ruske R, et al. Intercropping with pulses to concentrate nitrogen and sulphur in wheat[J]. The Journal of Agricultural Science, 2007, 145(5): 469-479.
[34] 余常兵, 孫建好, 李 ?隆. 種間相互作用對作物生長及養分吸收的影響[J]. 植物營養與肥料學報, 2009, 15(1): 1-8.
[35] 楊建波. 間作大豆對甘蔗生長及內生細菌、固氮細菌多樣性的效應[D]. 南寧: 廣西大學, 2014.
[36] Ansari F A, Ahmad I. Isolation, functional characterization and efficacy of biofilm-forming rhizobacteria under abiotic stress conditions[J]. Antonie van Leeuwenhoek, 2019, 112(12): 1827-1839.
[37] 張 ?帝. 紅球菌產類胡蘿卜素代謝通路的探究[D]. 上海: 上海海洋大學, 2016.
[38] Elizabeth B, Kevin C L, Colleen M H, et al. Whole-genome sequences of one Arthrobacter strain and three Pseudarth-robacter strains isolated from the Namib Desert[J]. Microbiology Resource Announcements, 2019, 43(8): 1-2.
[39] 劉冰冰. 烤煙K326與香料植物間作下原核微生物多樣性及部分菌株功能酶篩選研究[D]. 哈爾濱: 東北農業大學, 2014.
責任編輯:白 ?凈

