茶葉斑病病原菌高粱附球菌Epicoccumsorghinum的鑒定及生物學特性
黃鈜琳 尹橋秀 江仕龍 包興濤 武嫻 王德爐 陳卓



摘 ?要:為有效控制貴州省獨山縣茶葉斑病的發生與危害,本文研究了該區域茶葉斑病的病原和生物學特性。結果表明,從該地區茶葉斑病組織中分離的代表性菌株GZDS2018BXT10的菌落形態、分生孢子器、分生孢子和厚垣孢子等形態與高粱附球菌(Epicoccum sorghinum)一致。對ITS、RBP2、TUB、rDNA-LSU核酸或基因進行測序,采用PAUP軟件及最大簡約法構建多基因系統發育樹,結果表明,GZDS2018BXT10菌株與高粱附球菌模式菌株CBS179.80在系統發育樹上聚為一支,自舉支持率為100%。致病性試驗表明,在室內和自然條件下,GZDS2018BXT10菌株可通過損傷方式導致茶樹葉部產生病斑,符合柯赫氏法則。因此,確認該區域葉斑病病原為高粱附球菌(E. sorghinum)。菌株可在PDA、OA和MEA培養基上生長,GZDS2018BXT10菌株在OA培養基上生長速率最快,為(0.76±0.01) cm/d,顯著高于MEA和PDA培養基(P<0.05),在PDA上最適生長溫度為22 ℃,最適pH為6.0。碳素營養和氮素營養均可影響菌絲的生長。
關鍵詞:茶樹;高粱附球菌;鑒定;致病性;生物學特性
中圖分類號:S435.711 ? ? ?文獻標識碼:A
Abstract: In order to effectively control the occurrence and damage of tea leaf spot in Dushan County, Guizhou Prov-ince, this paper studied the pathogen and biological characteristics of tea leaf spot in the region. The results showed that the colonies, pycnidia, conidia and chlamydospores of the representative strain GZDS2018BXT10 were identical with the strain Epicoccum sorghinum. The gene or nucleic acid of ITS, RPB2, TUB and LSU were sequenced, then the phy-logenetic analysis was conducted by PAUP software with the method of Maximum parsimony based on multi-locus sequences. The strain GZDS2018BXT10 and E. sorghinum model strain CBS179.80 were grouped together in the phylogenetic tree, and the clade was supported by 100%. The pathogenicity test showed that the strain GZDS2018BXT10 could induce the lesion on tea leaves using wound mode under the conditions of laboratory and field, in accordance with Koch’s rule. Therefore, the pathogen of tea leaf spot was identified as E. sorghinum. The strain GZDS2018BXT10 could grow on PDA, OA and MEA medium. The strain GZDS2018BXT10 grew quickly on OA medium, and the growth rate was (0.76±0.01) cm/d, which was significantly higher than that on MEA and PDA medium (P<0.05). The optimum growth temperature and pH value on PDA medium were 22 ℃ and 6.0. Both carbon and nitrogen nutrition can affect the growth of mycelia.
Keywords: Camellia sinensis; Epicoccum sorghinum; identification; pathogenicity; biological characteristics
DOI: 10.3969/j.issn.1000-2561.2021.11.028
近年來,貴州大力發展茶產業,茶樹的種植面積達3.5萬hm2,位居我國第一[1-4]。由于貴州茶區海拔落差大、氣候多樣、早春氣溫偏低、倒春寒天氣頻發、茶樹品種多樣,導致茶樹病害發生頻次較高,對茶葉安全生產有一定影響[4]。目前關于貴州茶樹病害的研究主要集中在茶輪斑病、茶炭疽病等病害[5-6]。本課題組近年來先后對貴州惠水茶輪斑病的病原菌Pseudopestalotiopsis camelliae-sinensis[7]和茶葉斑病的病原菌可可毛色二孢菌(Lasiodiplodia theobromae)[1, 8]、貴州石阡葉斑病的病原菌Phoma segeticola var. camelliae[9]、余慶茶葉斑病的病原Didymella bellidis[3]和茶褐枯病的病原Colletotrichum camelliae[10]、貴州開陽茶葉斑病茶擬盤多毛孢(Pseudopestalotiopsis theae)[11]等進行了鑒定。針對上述茶樹病害的病原菌,為篩選高效藥劑、合理劑型、研究病原致病的分子機理等,課題組研究了病原菌在體外的生物學特性,如適宜的溫度、pH、氮素和碳素等,建立了病原在體外生長的數據模型[9-13]。2018年9—11月,課題組在貴州省獨山縣的茶區發現由Epicoccum sorghinum等病原菌所致的茶樹葉斑病[2]。經田間調查發現,茶樹葉斑病發病率較高,部分茶園發病率達85%,病情指數達74,幾乎達到了毀園的程度。為進一步明確該地區的病原,并為下一步深入研究該病害的發生和流行規律、藥劑體外活性篩選等奠定基礎,并提出有針對性的可持續的防治措施,本文在原有病原菌初步鑒定的基礎上,繼續深入開展了獨山縣茶樹葉斑病菌的形態學特征和分子生物學等病原菌的鑒定、致病性分析和生物學特性的研究。
1 ?材料與方法
1.1 ?材料
2018年9—11月,在貴州省獨山縣百泉鎮井橋村朵朝組(107°30′ E,25°48′ N,海拔1100 m)6個茶園的茶樹病害枝條上采集了20余個具有典型葉斑病癥狀的茶樹葉片樣本,并對其病害特征進行了拍照記錄。茶樹品種安吉白茶(Camellia sinensis cv. Anjibaicha)、黃金芽(Camellia sinensis cv. Huangjinya)、貴定鳥王種(Camellia sinensis cv. Guiding Niaowang),樹齡3~5 a。
1.2 ?方法
1.2.1 ?病原菌分離和純化 ?采用組織分離法對菌株進行分離[8-9]。具體方法如下:采集具有典型葉斑病癥狀的茶樹葉片,用無菌手術刀剪取病健交界處3 mm × 3 mm的葉部組織,先用75%酒精消毒30 s,5%的次氯酸鈉消毒3 min,再用無菌水清洗4次,并置于滅菌紙上干燥后,接種至PDA培養基(potato dextrose agar,北京索萊寶科技有限公司),置于25 ℃培養箱中黑暗培養。待葉片組織長出少量菌絲時,挑取菌落邊緣的菌絲至PDA培養基上進行多次純化,獲得代表性菌株GZDS2018BXT10,該菌株保存于本課題組的菌種保藏室,同時,菌株送中國普通微生物菌種保藏中心保藏,菌株保藏號為CGMCC3.20150。
1.2.2 ?形態學觀察 ?參照課題組前期的研究報道方法[14-15],將純化菌株分別接種于PDA、OA(燕麥片瓊脂培養基)和MEA(麥芽浸粉瓊脂培養基)平板和山梨糖培養基上,25 ℃避光培養7~11 d。觀察菌落和菌絲形態,待產生分生孢子后,挑取分生孢子并在奧林巴斯顯微鏡(Olympus, BX43和FVMPE-RS)下觀察病原菌的產孢結構、分生孢子等形態。
1.2.3 ?致病性測定 ?采用本課題組方法對分離菌株進行室內和田間致病性測定[1-3]。室內致病性試驗采用福鼎大白茶(Camellia sinensis cv. Fu-dingdabaicha),常年種植于大棚溫室,茶樹樹齡為5 a,茶樹葉齡為30 d。田間致病性試驗的茶樹品種為福鼎大白茶,分別在貴州省湄潭縣抄樂鄉銅鼓井村茶園(107°57′ E,27°67′ N,海拔868 m)和貴州省惠水縣七里沖茶場(106°61′ E,N26°8′ N,海拔966 m)完成。接種方式采用損傷方式和無損方式,損傷采用無菌針頭針刺4~5個相鄰的孔。接種病原采用經PDA上培養6 d的直徑約8 mm的菌碟或分生孢子懸浮液(106 conidia/mL)。同時,采用無菌PDA或無菌水作為對照。田間致病性試驗在貴州省惠水縣七里沖果樹場。湄潭實驗地的樹齡為30 a,葉齡平均為40 d。惠水實驗地的樹齡為12 a,葉齡平均為30 d。田間致病性試驗前30 d,茶園未采用農藥進行防治。田間試驗采用分生孢子懸浮液和菌碟進行接種,接種是以損傷和無損傷的方式進行,每種處理方法至少設3個重復。
1.2.4 ?分子鑒定 ?用無菌刀片在培養了7 d的PDA培養基上刮取菌絲0.1 g,采用Ezup柱式真菌基因組DNA抽提試劑盒提取病原菌菌絲DNA。采用ITS序列及RPB2、TUB和rDNA-LSU等基因進行擴增[2],引物分別采用V9G/ITS4、LR0R/LR7、RPB2-5F2/fRPB2-7cR、TUB2Fd/ TUB4Rd[14]。采用HS Taq酶(Takara,寶生物工程大連有限公司)試劑進行PCR檢測。反應程序:94 ℃預變性2 min;98 ℃變性10 s,55 ℃退火30 s,72 ℃延伸40 s,35個循環;72 ℃再延伸5 min。結合所得ITS序列的BLAST比對結果,選擇參比序列。利用DNAMAN 8.0軟件進行拼接及序列多重比對。利用PAUP v4.0b10(Swofford 2003)及最大簡約法(maximum parsimony, MP)構建加和進化樹。
1.2.5 ?病原菌生物學特性生長的測定 ?不同培養基處理:將菌株GZDS2018BXT10分別接種至OA、PDA、MEA培養基上,待菌落長滿后,用微距相機觀察菌落形態和菌絲色素。
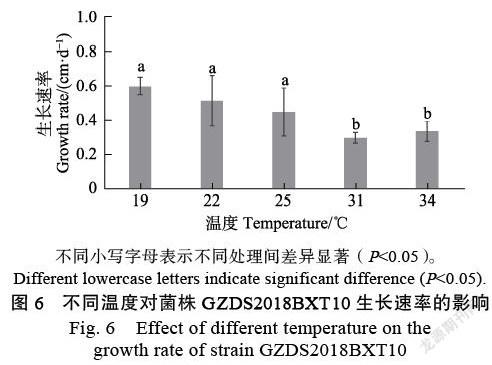
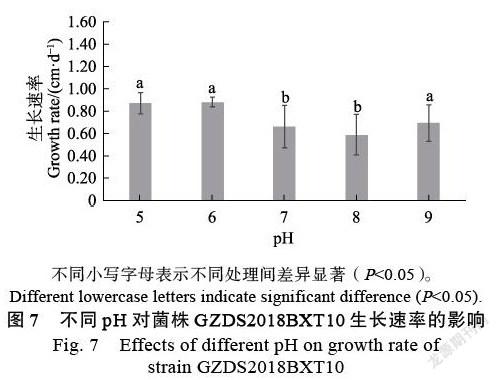
不同溫度和pH處理:參照課題組前期研究方法[13-14]。將活化的菌株GZDS2018BXT10接種到滅菌醋酸纖維膜上(孔徑0.45 μm,北京索萊寶科技有限公司)的PDA培養基上,培養溫度設19、22、25、31、34 ℃共5個溫度梯度;pH設5、6、7、8、9共5個梯度。待其中生長速率最快的一組剛長滿時,收集所有處理組樣品,刮取菌絲稱重。
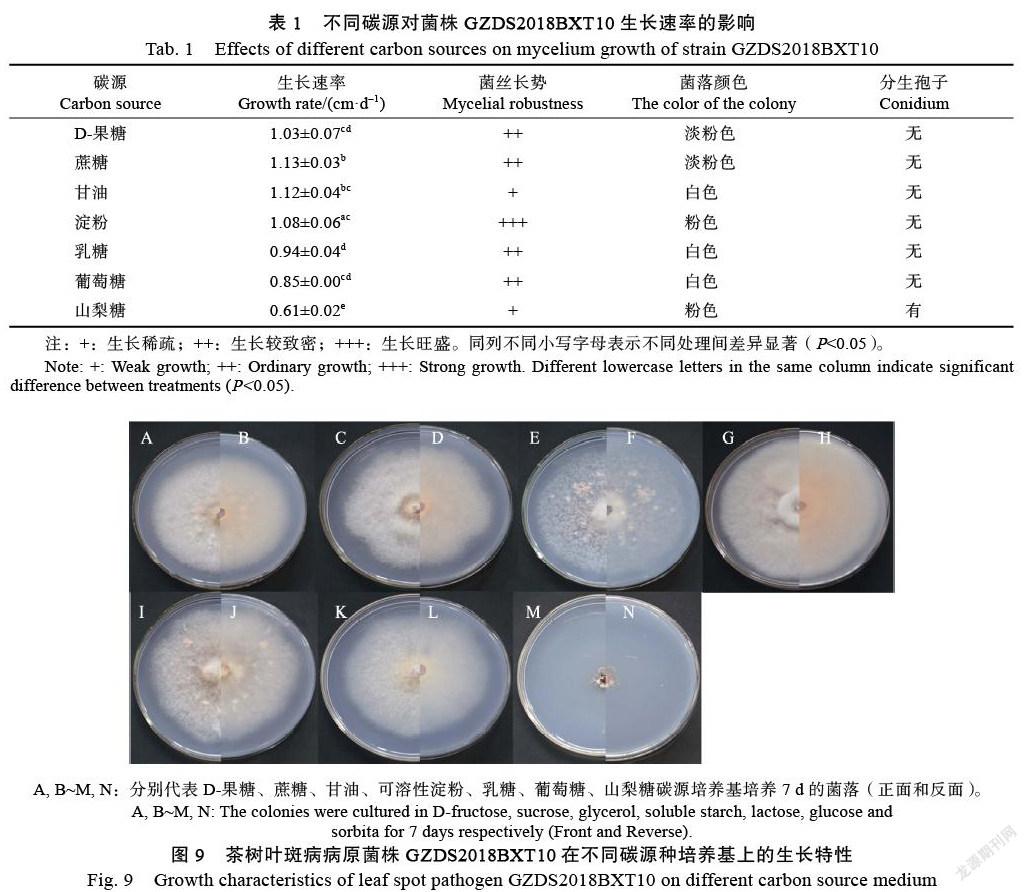
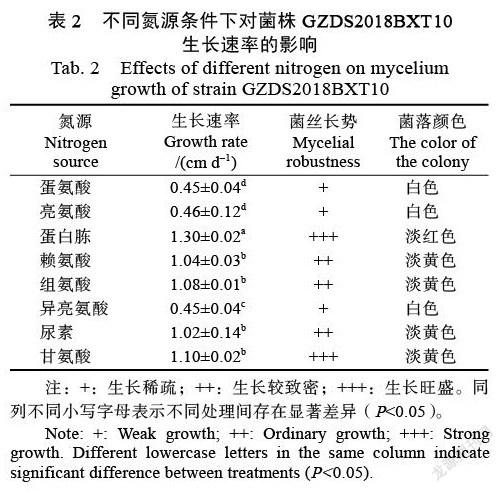
不同氮源和碳源處理:參照課題組前期研究方法[12],選擇察氏(Czapek)培養基為基礎培養基。分別用相同質量的不同氮源或碳源化合物代替其中的硝酸鉀或蔗糖。2種處理均在生長2 d后開始測菌落直徑。
所有處理培養條件為25 ℃,黑暗培養。設5次重復,試驗獨立重復3次。
1.3 ?數據處理
采用SPSS 19.0軟件、ANOVA及LSD方法對組間數據進行方差分析。統計學差異采用順序字母標注法標注。
2 ?結果與分析
2.1 ?茶葉斑病的田間癥狀
據田間調查顯示,葉斑病從葉片邊緣開始產生,隨后病斑面積逐漸擴大。葉面出現淡褐色或者深褐色病斑,病斑邊緣有深褐色邊界線。病害發生后期,病斑初始侵染點逐漸產生壞死。染病茶樹表現出樹勢衰弱,新梢和新芽形成減少,茶葉產量明顯降低。幼齡茶園發生重于成齡茶園,葉斑病多發于海拔較高的茶園,偏施氮肥的茶園發生較重。
2.2 ?病原菌分離
從采集的20余個樣本中,采用組織分離法成功分離出18個菌株,其中,Epicoccum sorghinum菌株分離率達79.4%。此外,也分離到莖點霉屬(Phoma sp.)、鏈格孢屬(Alternaria spp.)、亞隔孢殼屬(Didymella sp.)等真菌的菌株。
2.3 ?茶葉斑病病原鑒定
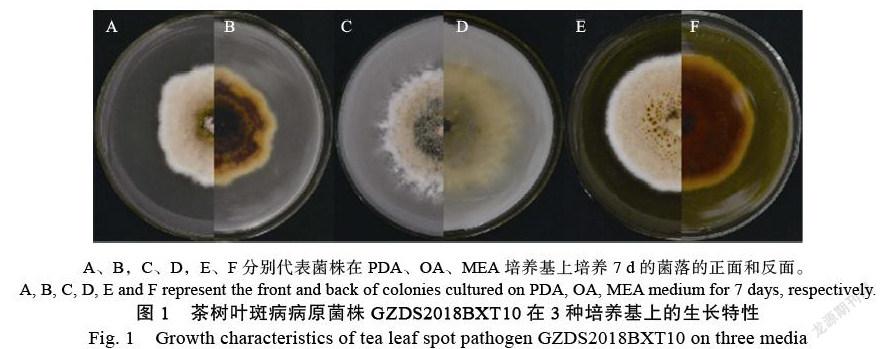
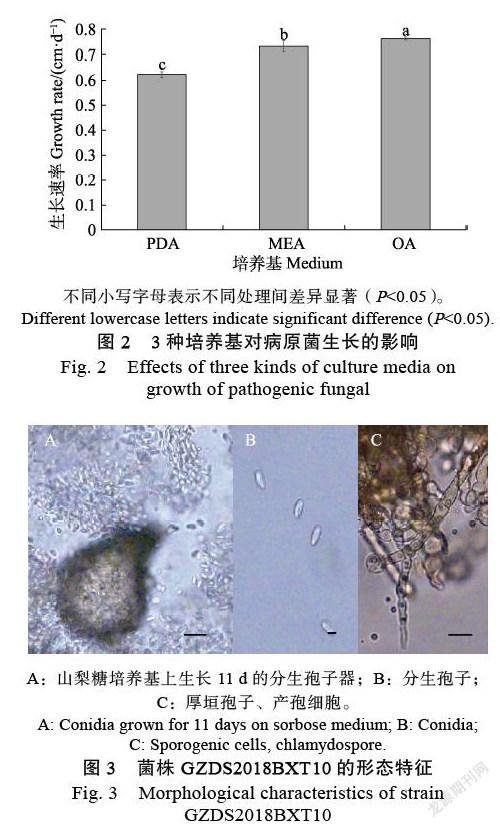
2.3.1 ?形態學鑒定 ?菌株GZDS2018BXT10可在PDA(圖1A,圖1B)、OA(圖1C,圖1D)和MEA(圖1E,圖1F)培養基上生長,進行形態學觀察和分析。其中,在PDA上接種7 d后,菌落顏色逐漸加深。隨著時間延長,菌絲開始分泌色素,正面為粉白色,背面變為褐紅色(圖1A,圖1B)。在OA上接種7 d后,菌落呈淡黃色,邊緣白色,有氣生菌絲產生(圖1C,圖1D)。在MEA上接種7 d后,菌落呈淡黃色,蓬松狀,菌株分泌出的黃褐色分泌物在菌落中央的表面;菌落正面顏色為褐色,反面呈黃褐色(圖1E,圖1F)。病原菌在這3種不同培養基上的生長速率表現為OA>MEA>PDA,生長速率依次為(0.76±0.01) cm/d、(0.73±0.02) cm/d、(0.62±0.01) cm/d(P<0.05)(圖2)。
菌株在25 ℃和黑暗條件下,接種菌株在山梨糖培養基上培養11 d后,觀察到山梨糖培養基上產生了分生孢子器并伴隨有大量的分生孢子,分生孢子器顏色為褐色或者深褐色。而在其他碳源培養基上沒有產生分生孢子器,大小約43.8~ 597.9 μm(圖3B)。分生孢子為單細胞,呈卵形,大小約2.8 (1.8~4.2) μm×5.0 (2.6~6.8) μm(n=50)(圖3A)。產孢細胞透明,光滑,形狀呈圓形(圖3C)。厚垣孢子為單細胞或多細胞,大小約10.0 (3.8~21.1) μm×15.5 (6.16~29.2) μm,呈灰黃色,表面有疣狀突起(圖3C)。
2.3.2 ?病原菌的致病性測定 ?自然條件下,茶葉斑病始發于葉片邊緣,病斑面積逐漸擴大,形成不規則病斑,病斑邊緣有邊界線。后期,病斑中央逐漸開始出現壞死。發病的茶樹樹勢衰弱,新葉抽發較少(圖4A)。室內致病性試驗表明,健康茶樹離體葉片經針刺方法接種病原菌株的菌碟(d=6 mm)或用無菌水配制分生孢子懸浮液,噴灑在處理后的茶葉片上并套袋保濕。在接種2 d后,發現以菌碟接種方式可產生明顯病斑,病斑直徑約4~6 mm(圖4B);接種4 d后,發現菌碟接種方式產生的病斑擴大不明顯(圖4C)。與菌碟接種方式的癥狀相比較,發現采用分生孢子懸浮液接種方式的癥狀較輕。惠水和湄潭兩地的田間致病性試驗表明,健康茶樹離體葉片經針刺方法接種菌株GZDS2018BXT10菌碟或分生孢子懸浮液接種后,均可產生病斑。隨著時間的延長,在接種20 d后,發現病斑在不斷擴大(圖4D,圖4E)。其癥狀與室內條件所致癥狀有相似之處,但也存在差異,推測產生這種差異可能與茶樹的生理生化狀態、茶樹葉片的葉齡、接種試驗的氣候條件有關。
2.3.3 ?分子生物學鑒定 ?GZDS2018BXT10菌株的ITS、RPB2、LSU、TUB基因或核酸序列的登錄號分別為MK516206、MK852278、MK516207和MK516208。采用BLAST進行比對表明,MK516206與E. sorghinum(MG969856.1)的序列等同值為100%,LSU與E. sorghinum(GU237978.1)的序列等同值為100%,RPB2與E. sorghinum(MH824398.1)的序列等同值為95.75%,TUB與E. sorghinum(MF987525.1)的序列等同值為99%。采用PAUP v4.0b10構建系統發育樹,將GZDS2018BXT10菌株鑒定為E. sorghinum CBS 179.80,其自舉支持率為100%(圖5)。
2.4 ?病原菌生物學特性
2.4.1 ?溫度對菌株生長的影響 ?研究發現菌株GZDS2018BXT10在體外適宜生長的溫度范圍較廣,但對高溫更為敏感,當溫度上升至31 ℃,菌株生長極為緩慢,但菌株尚未死亡。將菌株置于28 ℃或更低溫度下,菌株生長恢復正常(圖6)。
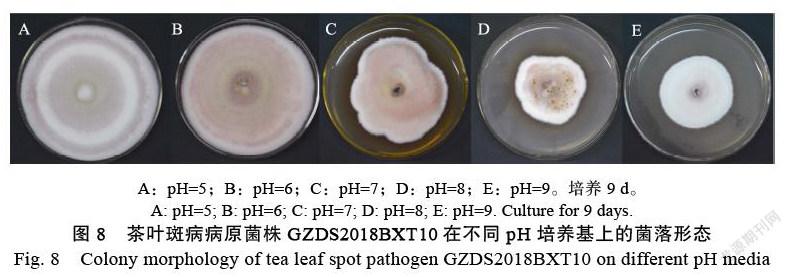
2.4.2 ?pH對菌株生長的影響 ?研究發現GZDS2018BXT10菌株的最適pH為6,其菌落生長速率最快,菌絲豐度最大。當pH高于7時,菌落生長變慢(圖7)。但在不同pH條件下,菌絲色素的分泌有較大差異,pH為5、6、7時,色素分泌較多,菌落顏色呈紅褐色。當pH為8時,菌落形狀不規則,菌絲絨毛狀,并伴有黃色分泌物(圖8)。
2.4.3 ?不同碳源對菌株生長的影響 ?供試菌株GZDS2018BXT10在不同碳源培養基上的生長速率有一定差異。其中,在山梨糖條件下,生長速度相對較慢,有分生孢子的產生。菌株在D-果糖、蔗糖、淀粉、乳糖、山梨糖培養基上產生乳白色菌絲(圖9),在甘油和葡萄糖培養基上為白色菌絲。菌絲豐度分析表明,淀粉培養基上的菌絲生長量最多(表1)。
2.4.4 ?不同氮源對菌株生長的影響 ?由圖10可知,供試菌株GZDS2018BXT010在蛋氨酸、蛋白胨、甘氨酸、亮氨酸、賴氨酸、尿素、異亮氨酸的培養基上的生長速率有一定的差異。其中,在蛋氨酸、亮氨酸條件下的生長速率相對較緩慢(表2)。菌株在各種氮源上的色素分泌也不完全相同,可產生白色(圖10G)、淡黃色(圖10E,圖10F,圖10H)、乳白色(圖10A,圖10D)的菌絲。此外,菌絲豐度也不完全相同,菌株在蛋白胨、甘氨酸培養基上產生量最多,在蛋氨酸、亮氨酸培養基上產生量最少(表2)。
3 ?討論
本文采用形態學、分子生物學、多基因系統發育樹和致病性試驗等方法,從貴州省獨山縣百泉鎮井橋村朵朝組茶葉斑病中發現致病菌高粱附球菌(E. sorghinum)。基于LSU、ITS、RBP2和TUB 4個基因或核酸序列,Chen等[16]構建格孢腔菌目(Pleosporales)中最大的家族亞隔孢殼科(Didymellaceae)的多基因系統發育樹,并將Epicoccum屬列為其中1個clade。本研究將E. sorghinum GZDS2018BXT10等多個代表性菌株鑒定為E. sorghinum CBS 179.80。E. sorghinum CBS 179.80定位在Epicoccum的clade上。研究表明,E. sorghinum最早被稱為Phoma sorghina[17]。據Chen等[16]報道,E. sorghinum CBS 179.80是從波多黎各的高粱(Sorghum vulgare)上分離獲得,E. sorghinum CBS 727.68是從法國的柑橘(Citrus sp.)上分離獲得,E. sorghinum LC4860是從中國的茶樹(Camellia sinensis)上分離獲得。E. sorghinum可引起煙草[18]、紅花酢漿草(Oxalis debilis)[19]、白合[20]、白芨(Bletilla striata)[21]、芋艿[22]、七葉一枝花(Paris polyphylla)[23]、馬唐(Digitaria sanguinalis)[24]和卷心菜(Brassica parachinensis)[25]等植物產生葉斑病。在本課題組報道之前,Chen等[16]也從我國茶樹上分離獲得一個菌株E. sorghinum LC4860,但未詳細說明所分離茶樹的樣本情況以及該菌株是否引起茶樹致病。本研究從貴州省獨山縣茶園的茶樹葉斑病病葉中分離獲得多種菌株,并發現E. sorghinum GZDS2018BXT10等代表性菌株對茶樹葉片可產生病斑,并且在室內和田間條件下所導致的葉部病斑與田間自然發生病害的癥狀有一定的相似性。然而,課題組也從采集葉部病害組織中分離了多個其他種類的病原菌或內生菌。課題組從病斑產生速率、病斑大小、是否存在子實體等方面初步比較了前期分離的病原菌Phoma segeticola var. camelliae[9]、Didymella bellidis[26]、Alternaria longipes[27]、Pseudopestalotiopsis camelliae-sinensis[7]的致病特征。發現E. sorghinum所致葉斑病的病斑產生速率快于Phoma segeticola var. camelliae、Didymella bellidis等菌株所致的病斑速率,E. sorghinum所致的病斑大于Phoma segeticola var. camelliae、Didymella bellidis
等菌株所致的病斑。E. sorghinum、Phoma segeticola var. camelliae、Didymella bellidi所致的病斑形狀與Pseudopestalotiopsis camelliae-sinensis所致病斑形狀不同,Pseudopestalotiopsis camelliae-sinensis所致病斑有輪紋狀,后期產生子實體[7]。此外,也有研究表明,E. sorghinum可通過真菌復合體的形式,引起高粱產生灰霉病[28]。E. sorghinum也可與其他真菌形成復合體,引起Paspalum guenoarum種子的萌發率降低[29]。因此,不能排除E. sorghinum與其他微生物通過各種形式的相互作用,導致茶樹產生葉斑病。
研究E. sorghinum真菌在體外的生長特性,對于該真菌的生物學特性、殺菌劑抑菌活性篩選及作用機制、藥劑對靶活性評價及利用率研究等均有重要意義。對菌株GZDS2018BXT10在不同培養基上的生長速率、產孢特性、對氮源和碳源的利用,以及在PDA上最適溫度和最適pH進行系統評價,發現GZDS2018BXT10適合在PDA、OA、MEA培養基上生長,該菌株在3種培養基上的大小具有一定的差異。氮源和碳源利用試驗表明,菌株GZDS2018BXT10的菌落生長速率和色素分泌與培養基組分相關。溫度和pH篩選條件試驗表明,菌株在PDA上最適溫度為22 ℃,曾慧蘭等[30]報道,E. sorghinum在pH同為6的條件下生長速率較快,菌株在PDA上的最適溫度為25 ℃,與本研究菌株GZDS2018BXT10的最適pH一致。同時,曾慧蘭等[30]研究表明,最適碳源為乳糖、葡萄糖,最適氮源為牛肉浸膏,而本研究最適碳源為葡萄糖、甘油,最適氮源為蛋白胨,二者存在一定差異。因此,課題組將在未來重點開展以下幾個方面的研究:(1)E. sorghinum對茶樹莖、葉、果和花等組織部位的致病性;(2)E. sorghinum對不同茶樹品種的致病性;(3)E. sorghinum對茶樹組織致病程度與溫度、濕度、光照、茶樹樹齡等因子間的相關性;(4)E. sorghinum與其他幾種微生物菌株在侵染茶樹組織間的關系;(5)E. sorghinum及其他幾類微生物菌株的代謝物的主要組分對E. sorghinum和其他幾類重要微生物菌株的生長、分生孢子萌發形成等影響。此外,課題組系統研究了E. sorghinum在體外適宜生長的溫度、pH,在PDA、OA、MEA等培養基上的生長和色素分泌等情況,對今后進行茶樹葉斑病藥劑篩選、殺菌劑作用機制和田間防控研究等具有重要參考價值。
參考文獻
[1] Li D X, Bao X T, Ren Y F, et al. First report of Lasiodip-lodia theobromae causing leaf spot on tea plant in Guizhou Province of China[J]. Plant Disease, 2019, 103(2): 374.
[2] Bao X T, Dharmasena D S P, Li D X, et al. First report of Epicoccum sorghinum causing leaf spot on tea in China[J]. Plant Disease, 2019, 103(12): 3282.
[3] Wang X, Yin Q X, Jiang S L, et al. First report of Didymella bellidis causing tea leaf spot in China[J]. Plant Disease, 2020, 104(4): 1254.
[4] 陳 ?松, 任亞峰, 李冬雪, 等. 貴州茶樹病害可持續控制技術措施的研究與應用路徑探索[J]. 中國植保導刊, 2018, 38(10): 85-90.
[5] Wang Y C, Hao X Y, Wang L, et al. Diverse Colletotrichum species cause anthracnose of tea plants (Camellia sinensis (L.) O. Kuntze) in China[J]. Scientific Reports, 2016, 6(1): 35287.
[6] Wang Y C, Fei X Lu, Hao Q H, et al. Diversity of Pestalo-tiopsis -like species causing gray blight disease of tea plants (Camellia sinensis) in China, including two novel Pestalo-tiopsis species, and analysis of their pathogenicity[J]. Plant Disease, 2019, 103(10): 2548-2558.
[7] 李冬雪, 趙曉珍, 王 ?勇, 等. 貴州惠水縣茶輪斑病病原菌的鑒定[J]. 熱帶作物學報, 2018, 39(9): 1827-1833.
[8] 任亞峰, 包興濤, 李冬雪, 等. 茶樹葉斑病病原菌可可毛色二孢菌的鑒定[J]. 植物病理學報, 2019, 49(6): 857-861.
[9] 趙曉珍, 王 ?勇, 李冬雪, 等. 茶樹新病害病原菌Phoma segeticola var. camelliae的形態學特征及系統學分析[J]. 植物病理學報, 2018, 48(4): 556-559.
[10] 王 ?雪, 王 ?勇, 尹橋秀, 等. 貴州省余慶縣茶褐枯病病原菌的鑒定[J]. 植物保護, 2020, 46(2): 101-106.
[11] 安小麗, 武 ?嫻, 任亞峰, 等. 茶葉斑病病原菌茶擬盤多毛孢(Pseudopestalotiopsis theae)的鑒定及生物學特性[J]. 中國植保導刊, 2020, 40(1): 12-19, 47.
[12] 文小東, 宋星陳, 王 ?勇, 等. 茶輪斑病病原菌(Pseudopestalotiopsis camelliae-sinensis)生物學特性研究[J]. 中國植保導刊, 2018, 38(10): 19-25.
[13] 韋 ?唯, 任亞峰, 李冬雪, 等. 茶樹葉部病害病原菌Phoma segeticola var. camelliae的生物學特性研究[J]. 中國植保導刊, 2018, 38(12): 14-19.
[14] 包興濤, 李冬雪, 任亞峰, 等. 茶樹病害病原菌Lasiodiplodia theobromae生物學特性研究[J]. 中國植保導刊, 2019, 39(4): 5-12.
[15] 王 ?雪, 尹橋秀, 李冬雪, 等. 茶褐枯病病原菌(Colletotrichum camelliae)生物學特性研究[J]. 中國植保導刊, 2019, 39(6): 5-11.
[16] Chen Q, Hou L W, Duan W J, et al. Didymellaceae revi-sited[J]. Studies in Mycology, 2017, 87: 105-159.
[17] Oliveira R C, Goncalves S S, Silva C D C, et al. Polyphasic characterization of Epicoccum sorghinum: A tenuazonic acid producer isolated from sorghum grain[J]. International Journal of Food Microbiology, 2019, 292: 1-7.
[18] Yuan G Q, Liao T, Tan H W, et al. First report of leaf spot caused by Phoma sorghina on tobacco in China[J]. Plant Disease, 2016, 100(8): 1790.
[19] Chen X L, Wang Y H, Luo T. First report of leaf spot caused by Phoma sorghina on Oxalis debilis in China[J]. Plant Disease, 2017, 101(6): 1047.
[20] Zeng H, Lu Q, Li R. First report of leaf spot of Lily caused by Epicoccum sorghinum in China[J]. Plant Disease, 2018, 102(12): 2648.
[21] Zhou H, Liu P P, Qiu S, et al. Identity of Epicoccum sorghi-num causing leaf spot disease of Bletilla striata in China[J]. Plant Disease, 2018, 102(5): 1039.
[22] Liu P Q, Wei M Y, Zhu L, et al. First report of leaf spot on Taro caused by Epicoccum sorghinum in China[J]. Plant Disease, 2018, 102(3): 682.
[23] Fu R T, Chen C, Wang J, et al. First report of Epicoccum sorghinum causing leaf spot on Paris polyphylla in China[J]. Plant Disease, 2019, 103(6): 1426.
[24] Kang Y, Zhang J X, Wan Q, et al. First report of leaf brown spot caused by Epicoccum sorghinum on Digitaria sanguinalis in China[J]. Plant Disease, 2019, 103(7): 1787.
[25] Yu L, She X M, Lan G B, et al. First report of leaf spot caused by Epicoccum sorghinum on Chinese flowering cab-bage (Brassica parachinensis) in China[J]. Plant Disease, 2019, 103(11): 2966.
[26] Wang X, Yin Q X, Jiang S L, et al. First report of Didymella bellidis causing tea leaf spot in China[J]. Plant Disease, 2020, 104(4): 1254.
[27] 楊志英, 盧佳欣, 李 ?濤, 等. 貴州開陽地區茶葉斑病相關病原菌長柄鏈格孢菌(Alternaria longipes)的研究[J]. 中國植保導刊, 2020, 40(11): 5-12, 34.
[28] Navi S S, Bandyopadhyay R, Reddy R K, et al. Effects of wetness duration and grain development stages on sorghum grain mold infection[J]. Plant Disease, 2005, 89(8): 872-878.
[29] Gasparetto B F, Franke L B, Andrade C C L. First report of Bipolaris micropus, Curvularia geniculata, Epicoccum sorg-hinum, and Fusarium incarnatum on Paspalum guenoarum seeds in Rio Grande do Sul, Brazil[J]. Plant Disease, 2017, 101(9): 1679.
[30] 曾慧蘭, 盧其能, 曾鵬遠, 等. 百合葉尖干枯病病原菌的鑒定、生物學特性及其對殺菌劑的敏感性研究[J]. 園藝學報, 2018, 45(12): 2407-2416.
責任編輯:謝龍蓮

