CRISPR/Cas9基因編輯技術(shù)的發(fā)展及其在植物中的應用
廖嘉明, 李春梅, 張石虎, 李布野, 歐陽昆唏*, 陳曉陽*
(1.華南農(nóng)業(yè)大學林學與風景園林學院, 廣州 510642; 2.五華縣林業(yè)局, 廣東 梅州 514400)
基因編輯技術(shù)指能夠靶向編輯生物體內(nèi)的目標基因,實現(xiàn)對特定DNA片段的刪除、插入、定點突變等的技術(shù)。與傳統(tǒng)的類轉(zhuǎn)錄激活因子效應物核酸酶(transcription activator-like effector nucleases, TALEN)[1]和鋅指核酸酶(zinc finger nuclease, ZFN)[2]基因編輯技術(shù)相比,成簇規(guī)律間隔短回文重復(clustered regularly interspaced short palindromic repeat, CRISPR)基因組編輯系統(tǒng)具有突變效率高、準確度高、載體構(gòu)建簡單等特點,成為全球最為流行的基因編輯技術(shù),獲得了2020年的諾貝爾化學獎[3]。CRISPR/Cas基因編輯技術(shù)極大地促進了生命科學的發(fā)展。除了用于疾病治療、藥物研發(fā)、基因功能研究,該技術(shù)在農(nóng)作物的遺傳改良領域也起到重要作用。
本文介紹了CRISPR/Cas系統(tǒng)的作用機理以及其在作物和林木遺傳育種中的研究進展和應用,進一步就該系統(tǒng)在植物遺傳育種應用中的技術(shù)優(yōu)化進行了探討,并對其發(fā)展前景進行了展望。
1 CRISPR/Cas系統(tǒng)
1.1 CRISPR/Cas系統(tǒng)的發(fā)現(xiàn)
1987年,Ishino等[4]在大腸桿菌iap基因的3′端側(cè)翼區(qū)發(fā)現(xiàn)了一段由高度同源的29個核苷酸組成的重復序列,且彼此之間被32個核苷酸的間隔序列隔開(圖1)。對原核生物基因組序列的分析結(jié)果顯示,在古細菌和細菌的基因組中存在25~50 bp長度的短重復序列,中間間隔著大小相似的獨特序列[5]。到2002年,將這種特殊的重復序列結(jié)構(gòu)稱為成簇規(guī)律性間隔的短回文重復序列(CRISPR),同時發(fā)現(xiàn)在CRISPR序列附近存在一些保守基因,這些基因被命名為Cas基因[6]。2005年,CRISPR中的間隔序列首次被證實與病毒和細菌的遺傳物質(zhì)序列具有同源性[7]。這些具有同源性的間隔序列是細胞受到外源遺傳物質(zhì)入侵后產(chǎn)生的痕跡,以使它們產(chǎn)生適應性免疫,因此,推測CRISPR序列在細菌基因組中的廣泛存在可能對外來DNA的入侵起防御和保護作用[8]。Barrangou等[9]通過細菌和噬菌體的相關(guān)試驗證明,細菌中CRISPR與相關(guān)的Cas基因一起對噬菌體產(chǎn)生抗性,表明CRISPR/Cas系統(tǒng)參與了細菌適應性免疫反應,因此,認為CRISPR/Cas系統(tǒng)可能被開發(fā)為一種病毒防御機制系統(tǒng)。之后研究發(fā)現(xiàn),當噬菌體首次入侵宿主細菌時,CRISPR/Cas系統(tǒng)同時裂解噬菌體和質(zhì)粒DNA,整合噬菌體的一段DNA序列到基因組CRISPR位點中,然后表達CRISPR RNA(crRNA);當噬菌體再次入侵時,crRNA表達,Cas蛋白利用crRNAs靶向外源遺傳物質(zhì)干擾噬菌體的入侵[10-12]。也就是說,當噬菌體入侵時,CRISPR/Cas系統(tǒng)的防御保護作用由RNA介導,是一種獲得性免疫系統(tǒng),初步驗證了CRISPR/Cas系統(tǒng)的生物學功能。

圖1 大腸桿菌iap基因重復序列比較[4]
1.2 CRISPR/Cas系統(tǒng)的分類
有一組保守的CRISPR相關(guān)基因與CRISPR的重復序列和間隔序列相鄰,它們編碼Cas蛋白,不同的Cas蛋白可能參與CRISPR/Cas系統(tǒng)作用的一個或多個階段[6]。根據(jù)Cas蛋白的種類及組合的不同可將CRISPR/Cas系統(tǒng)分為三種主要類型:TypeⅠ、TypeⅡ和TypeⅢ,其中Cas1和Cas2蛋白在所有類型中都存在[13-14]。
Type Ⅰ的特征蛋白是一個大型蛋白Cas3(圖2),具有單鏈解旋酶和DNase活性以及水解ATP的能力。Cas3將外源DNA作為目標,識別并解旋外源DNA的互補鏈,使其與crRNA配對形成R環(huán)結(jié)構(gòu),再利用核酸酶活性使非互補鏈斷裂。TypeⅡ的特征蛋白是Cas9(圖2),最典型的Cas9蛋白首次發(fā)現(xiàn)于釀膿鏈球菌(Streptococcuspyogenes)中,該蛋白中至少含有兩個核酸酶結(jié)構(gòu)域、一個類RuvC的核酸酶結(jié)構(gòu)域(N端附近)和一個HNH核酸酶結(jié)構(gòu)域[13]。雙鏈RNA結(jié)構(gòu)由反式作用crRNA(trans-activating crRNA,tracrRNA)與crRNA通過堿基互補配對形成,引導CRISPR相關(guān)蛋白Cas9在目標DNA中引入雙鏈斷裂,其中核酸酶結(jié)構(gòu)域HNH裂解互補鏈,而類RuvC結(jié)構(gòu)域裂解非互補鏈[13-14]。由于TypeⅡ免疫系統(tǒng)需要的Cas蛋白相對簡單,因此CRISPR/Cas9系統(tǒng)是目前應用最普遍的系統(tǒng)。TypeⅢ型Cas蛋白又可分為兩種亞型:TypeⅢ-A和TypeⅢ-B。TypeⅢ-A亞型的靶向是DNA;而TypeⅢ-B亞型的靶向是RNA,主要參與crRNA的成熟以及剪切外源入侵遺傳物質(zhì)[13],其特征蛋白為Cas10(圖2)。
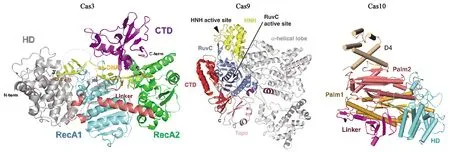
圖2 Cas3[15]、Cas9[16]、Cas10[17]蛋白主要結(jié)構(gòu)域
1.3 CRISPR/Cas及其衍生系統(tǒng)的作用機制
1.3.1CRISPR/Cas系統(tǒng) CRISPR/Cas9系統(tǒng)作為研究最為深入且應用最為廣泛的系統(tǒng),主要由Cas9蛋白、crRNA和tracrRNA三部分組成。首先,tracrRNA和RNaseⅢ對precrRNA(precursor crRNA)進行加工得到成熟的crRNA,crRNA與tracrRNA互補配對后引導Cas9蛋白結(jié)合并剪切雙鏈DNA[11],其中Cas9蛋白通過與目標序列3′端的PAM序列(通常為“NGG”)進行識別。為了使CRISPR/Cas9系統(tǒng)的使用更加地簡便,研究者將crRNA和tracrRNA合并設計成一個sgRNA(single guide RNA),經(jīng)驗證sgRNA能引導Cas9蛋白切割雙鏈DNA[14-18]。Cas9蛋白與目標DNA結(jié)合后,利用核酸內(nèi)切酶活性切割靶序列,產(chǎn)生DNA雙鏈斷裂(double-strand break,DSB)。而修復DSB有兩種方式[19]:一種是自然條件下的非同源末端連接(nonhomologous end-joining,NHEJ)方式,修復概率高,但修復過程容易出錯,如引入個別堿基的插入、缺失或替換;另一種方式是同源重組修復(homology-directed repair,HDR),可以將外源DNA供體片段重組整合到DNA雙鏈斷裂的位置,但在自然條件下出現(xiàn)的概率較低,所以細胞修復DSB的方式主要為NHEJ[18](圖3)。這兩種DSB修復方式在真核生物細胞中高度保守,因此,在很多物種中均可以進行精確的基因編輯[20]。
另一種使用較為廣泛的是CRISPR/Cas12a系統(tǒng)(也稱CRISPR/Cpf1),能特異性識別5′端連續(xù)2個或3個胸腺嘧啶(T)的PAM序列[21]。相較于CRISPR/Cas9系統(tǒng),CRISPR/Cpf1系統(tǒng)不需tracrRNA參與,僅需在crRNA引導下即可對DNA雙鏈進行切割;且該系統(tǒng)中crRNA比sgRNA更短,其蛋白也比Cas9蛋白更小,有助于構(gòu)建裝載量小和多基因編輯的載體[22-23]。
1.3.2CRISPR/Cas衍生系統(tǒng) 科學家們還開發(fā)出了不依賴DSB的CRISPR/Cas系統(tǒng),包括堿基編輯器[24]和引導編輯器[25]等在內(nèi)的精準基因編輯系統(tǒng)。
目前常用的堿基編輯系統(tǒng)主要有胞嘧啶堿基編輯器(cytosine base editor,CBE)和腺嘌呤堿基編輯器(adenine base editor,ABE)(圖3),這兩類堿基編輯系統(tǒng)主要利用胞嘧啶脫氨酶或腺嘌呤脫氨酶與Cas9缺口酶(nicking Cas9,nCas9)融合,融合蛋白在sgRNA介導下對靶位點進行精準的堿基編輯,最終實現(xiàn)C·G堿基對向T·A堿基對的轉(zhuǎn)換或A·T堿基對向G·C堿基對的轉(zhuǎn)換。雖然堿基編輯器是可用于進行堿基轉(zhuǎn)換的強大工具,但不能用于進行堿基顛換、插入或缺失。因此,在植物中尋找可使用的新型基因組工程方法顯得尤為重要。
Anzalone等[25]開發(fā)的引導編輯器(prime editors,PEs)(圖3)能彌補堿基編輯器存在的問題。PEs系統(tǒng)由nSpCas9(H840A)、引導編輯向?qū)NA(prime editing extended guide RNA,pegRNA)和逆轉(zhuǎn)錄酶M-MLV(moloney murine leukemia virus reverse transcriptase)三部分組成。其中,pegRNA是在gRNA序列的3′末端添加引物結(jié)合位點(prime binding sites,PBS)和攜帶編輯信息的逆轉(zhuǎn)錄(reverse transcription,RT)模板。PEs系統(tǒng)是切口酶H840A-逆轉(zhuǎn)錄酶M-MLV融合蛋白,主要在pegRNA介導下進行編輯,可在植物基因組的特定位點引入堿基-堿基轉(zhuǎn)換或少量堿基的定點缺失和插入,也可以在沒有供體DNA或雙鏈斷裂的情況下對哺乳動物細胞中的堿基進行編輯,這種編輯器將基因組編輯提升到了一個新的水平。另外,Lin等[26]對一種引導編輯系統(tǒng)(prime editing system,PPE)進行優(yōu)化,通過密碼子、啟動子和編輯條件優(yōu)化調(diào)整了啟動子編輯器在植物中的應用,編輯效率高達21.8%。盡管PPE系統(tǒng)的效率低于堿基編輯器,但在開展植物育種和功能基因組學研究中具有巨大的潛力。
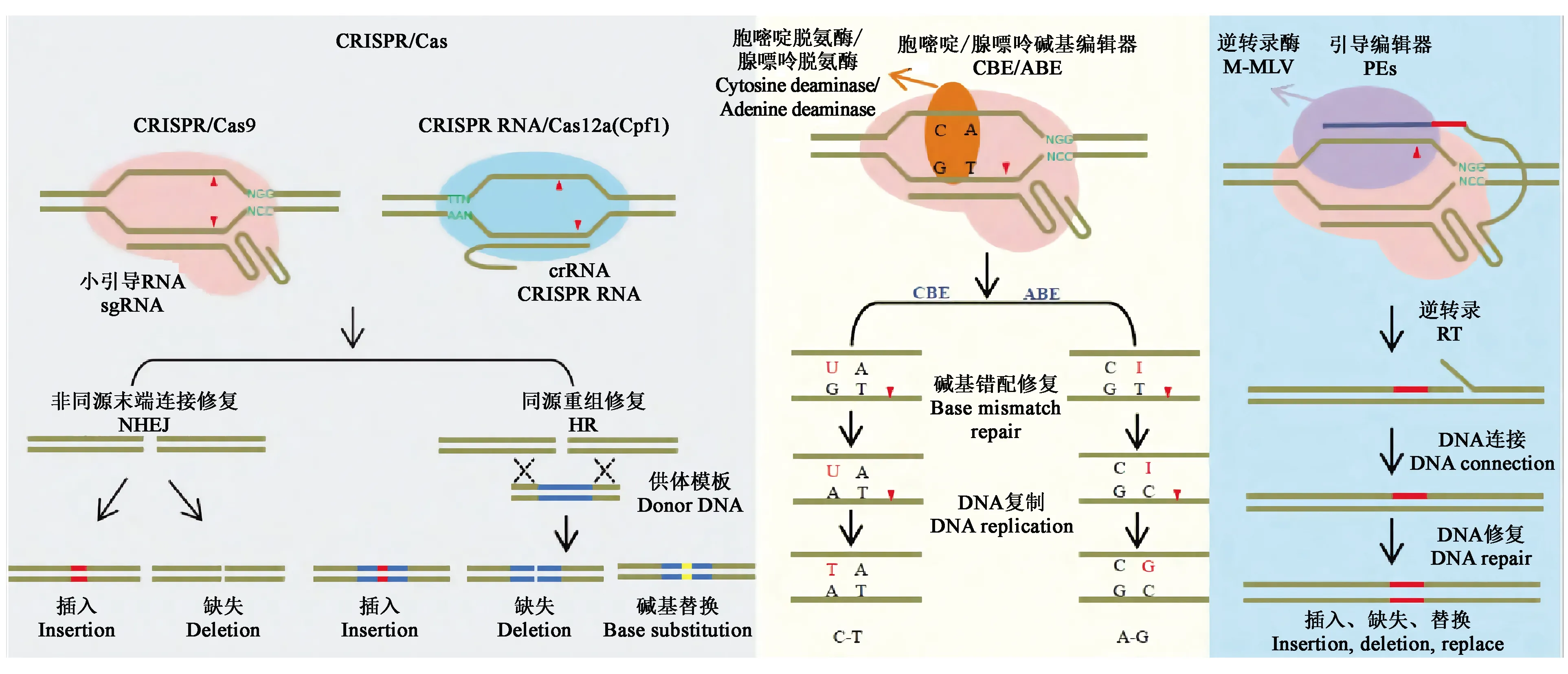
圖3 CRISPR/Cas系統(tǒng)及衍生技術(shù)示意圖[23]
2 CRISPR/Cas9系統(tǒng)的應用
2013年,Li等[27]利用CRISPR/Cas9基因編輯技術(shù)在擬南芥和煙草中進行基因精準編輯,首次在植物基因組中運用CRISPR/Cas9系統(tǒng)且驗證了其在植物基因編輯方面的可行性。隨后,研究人員也陸續(xù)在不同植物中開展CRISPR/Cas9系統(tǒng)的應用研究。目前,該系統(tǒng)還處于初始應用階段,隨著技術(shù)的不斷完善進步,它將會改變傳統(tǒng)育種方式,在植物性狀改良、加快育種進程等方面發(fā)揮重要作用。
2.1 在農(nóng)作物基因編輯中的應用
與傳統(tǒng)育種方法相比,CRISPR/Cas系統(tǒng)能快速精準改良目標性狀、顯著縮短育種周期。目前,CRISPR/Cas系統(tǒng)在改良作物產(chǎn)量、品質(zhì)、抗病性和抗除草劑以及基因功能研究中均起到了重要作用。
王加峰等[28]利用CRISPR/Cas9系統(tǒng)靶向突變了調(diào)控水稻千粒重的TGW6基因,結(jié)果表明,T1代純合缺失突變體千粒重顯著增加。Li等[29]以中花11作為轉(zhuǎn)化材料定點敲除了Gn1a、DEP1、GS3及IPA1基因,T2代純合缺失突變體植株的籽粒數(shù)目及籽粒長度顯著增加。改變細胞分裂素穩(wěn)態(tài)可提高谷物產(chǎn)量,Wang等[30]和Zhang等[31]對小麥、水稻中的細胞分裂素激活酶通過編輯或敲除編碼細胞分裂素氧化酶/脫氫酶(CKX)基因均得到了高產(chǎn)的株系[30-31]。
研究者利用CRISPR/Cas9系統(tǒng)對作物的品質(zhì)進行改良,如對水稻的香氣基因OsBADH2進行編輯,獲得了香米突變體[32],加快了香稻的育種進程;山東省農(nóng)業(yè)科學院作物研究所小麥分子育種創(chuàng)新團隊利用農(nóng)桿菌介導的CRISPR/Cas9系統(tǒng)分別對與面粉吸水率密切相關(guān)的Pinb基因、與淀粉品質(zhì)相關(guān)的Waxy基因、與面團褐變相關(guān)的Ppo基因以及面粉黃色素含量相關(guān)的Psy基因進行精準打靶,獲得了一批具有新優(yōu)異等位基因的小麥新資源[33]。Waltz[34]定向突變了雙孢菇(Agaricusbisporus)的多酚氧化酶基因PPO,發(fā)現(xiàn)突變體材料的多酚氧化酶活性降低了30%,抗褐變能力得到顯著提高。此外,該系統(tǒng)還有助于培育富含類胡蘿卜素[35]和γ-氨基丁酸[36]、減少植酸[37]和高油酸含量[38]的優(yōu)質(zhì)作物。
利用CRISPR/Cas9系統(tǒng)修飾相關(guān)基因可獲得抗性植株。袁隆平團隊與Tang等[39]通過靶向敲除水稻中與鎘離子吸收和積累相關(guān)的基因,得到了對抗鎘毒害的水稻品種。試驗表明,對水稻中的SWEET11、SWEET13和SWEET14基因的啟動子進行突變,可產(chǎn)生具有廣譜抗性的水稻品系[40]。敲除植物敏感基因也是產(chǎn)生廣譜病毒抗性的有效途徑,如敲除黃瓜eIF4E基因,可以使黃瓜獲得對馬鈴薯病毒的廣譜抗性[41]。
編輯除草劑靶向基因也可以獲得內(nèi)源抗性的作物。Li等[42]以NHEJ修復方式對水稻EPSPS基因保守區(qū)域兩個重要氨基酸進行定點置換,T0代即得到了抗草甘膦的水稻突變體;Zhang等[43]通過CRISPR/Cas9系統(tǒng)誘導小麥A1992V取代ACCase獲得了抗喹禾靈小麥。
CRISPR/Cas9系統(tǒng)可同時對多個基因進行編輯,因此,基于CRISPR/Cas9系統(tǒng)的多基因編輯技術(shù)應運而生,Shan等[44]運用CRISPR/Cas9系統(tǒng)對水稻的四個基因進行定點編輯,得到了白化且矮化的T1代植株。CRISPR/Cas9系統(tǒng)編碼優(yōu)化RNA時也可以同時在多個位點產(chǎn)生突變,且這種突變能夠正常遺傳給后代[45];Ma等[20]同時對水稻中7個基因進行敲除;Yu等[46]通過CRISPR/Cas9系統(tǒng)同時對擬南芥中多個基因編輯得到了傳統(tǒng)雜交難以得到的三基因突變體。由此可見,多基因編輯技術(shù)尤其適用于家族成員多或功能冗余的基因功能研究。
2.2 在林木基因編輯中的應用
與農(nóng)作物相比,傳統(tǒng)林木育種具有育種周期長、遺傳背景復雜等生物學特點,導致林木遺傳改良的進程緩慢。將CRISPR/Cas9系統(tǒng)應用于林木改良極大地促進了林木基因組功能和遺傳改良的研究進程。
楊樹作為林木中的模式植物,CRISPR/Cas9系統(tǒng)在楊樹功能基因組研究和基因工程育種中都有著廣泛的應用。2015年,F(xiàn)an等[47]利用該系統(tǒng)靶向敲除了毛白楊(Populustomentosa)的八氫番茄紅素脫氫酶基因(phytoenedesaturase,PDS)獲得白化表型植株。同年,Zhou等[48]利用該系統(tǒng)成功靶向編輯種間雜種銀灰楊(P.tremula×alba)中4CL1和4CL2基因,突變體莖稈呈紅褐色,且發(fā)現(xiàn)SNP接近或位于PAM位點內(nèi)時能完全抑制基因打靶作用。對參與調(diào)控楊樹側(cè)芽發(fā)生的直系同源基因BRC1和BRC2進行靶向敲除時,BRC2基因突變體的分支數(shù)顯著多于野生型,且在莖節(jié)處產(chǎn)生異位葉片;BRC1基因突變體的分支數(shù)也明顯增加;由此表明,BRC1和BRC2參與調(diào)控楊樹側(cè)芽發(fā)生,且有著不同的作用機制和表達模式[49]。由CRISPR/Cas9介導產(chǎn)生的楊樹NST/SND同源基因四重突變體的木質(zhì)部和韌皮部部分細胞缺少次生細胞壁,包括木纖維細胞、木射線薄壁細胞和韌皮纖維細胞,導致該突變體幾乎無法直立,由此說明NST/SND同源基因參與楊樹次生壁的形成[50]。綜上所述,CRISPR/Cas9系統(tǒng)可快速高效地敲除兩個以上內(nèi)源基因,從而獲得多重突變體楊樹株系,為開展基因功能研究和楊樹遺傳改良奠定了基礎。
近年來,CRISPR/Cas9系統(tǒng)被用于林木抗病性、生長發(fā)育和果實品質(zhì)等特性的改良[51]。在柑橘屬(Citrusspp.),應用CRISPR/Cas9定向編輯柑橘中調(diào)控潰瘍病感病反應的關(guān)鍵基因CsLOB1及其啟動子序列,提高了柑橘對潰瘍病的抗性[52]。Charrier等[53]首次利用CRISPR/Cas9系統(tǒng)定向突變梨樹的PcTFL1.1基因,獲得了花期提前的突變體植株。Chang等[54]利用CRISPR/Cas9系統(tǒng)同時對石榴中的兩個UDP-糖基轉(zhuǎn)移酶基因PgUGT進行編輯,突變體安石榴苷的含量降低了40%。
咖啡、可可和橡膠樹的CRISPR/Cas9基因編輯系統(tǒng)也相繼被建立。利用CRISPR/Cas9系統(tǒng)靶向編輯咖啡樹CcPDS基因,得到表型黃化、弱小的純合突變體[55]。可可黑果病可造成可可大面積減產(chǎn),研究表明,降低可可TcNPR3基因的表達有利于提高可可對疫霉菌的抗性[56],從而降低黑果病的得病率。Fister等[57]發(fā)現(xiàn)在可可離體葉片上注射含CRISPR/Cas9基因編輯載體的農(nóng)桿菌,48 h后接種疫霉菌后,實驗組的病斑面積較對照組顯著減小。Fan等[58]率先建立了橡膠樹CRISPR/Cas9系統(tǒng),直接傳遞CRISPR/Cas9核糖核蛋白(ribose nucleoprotein,RNPs)在橡膠樹中靶向誘變,以橡膠樹FT和TFL基因為靶點,設計了5種sgRNA,利用PEG介導法將含有Cas9-sgRNA重組質(zhì)粒導入橡膠的原生質(zhì)體中,靶向突變頻率為3.74%~20.11%。
3 CRISPR/Cas9系統(tǒng)的優(yōu)化與發(fā)展
盡管CRISPR/Cas9基因編輯技術(shù)發(fā)展迅速,且得到了廣泛應用,但目前,該系統(tǒng)一些技術(shù)方面的問題仍有待進一步改進和探討:如脫靶現(xiàn)象、PAM區(qū)的限制性、編輯效率以及生物安全監(jiān)管等。脫靶現(xiàn)象嚴重限制了該技術(shù)的應用。研究表明,通過使用合適的Cas蛋白或提高sgRNA序列的特異性可降低或者消除脫靶現(xiàn)象[59];靶點GC含量在50%~70%時打靶效率較高[20]。有效拓展CRISPR系統(tǒng)PAM位點范圍是該技術(shù)在育種中廣泛應用的關(guān)鍵所在。由于Cas9需要靶位點NGG的PAM序列,限制了基因組中靶位點選擇的自由度,為解決此問題,開發(fā)出了可增強基因組編輯范圍的新型CRISPR/Cas9工具。雖然來自釀膿鏈球菌的Cas9(SpCas9)使用最廣泛,但是僅極少數(shù)DNA序列符合靶位點旁邊存在兩個G堿基這一特殊要求。Chatterjee等[60]從犬鏈球菌(Streptococcuscanis)中鑒定出Cas9(ScCas9),發(fā)現(xiàn)ScCas9具有更廣泛地靶向DNA序列的能力;Cas9酶將靶向位置從最初基因組上的10%位點擴大到將近50%;并進一步設計出具有增強基因組編輯能力的新蛋白,極大地拓寬了DNA序列[61-62]。人工改造的變體xCas9、SpCas9-NG[63]和SpRY[64]也極大地擴展了CRISPR/Cas系統(tǒng)的編輯范圍。提高同源重組(homologous recombination,HDR)效率也至關(guān)重要,Aird等[65]將供體DNA與Cas9/gRNA核糖核蛋白復合體連接,使DSB處供體DNA的濃度增加,從而提高Cas9介導的同源重組修復效率。
相較于草本植物和農(nóng)作物,木本植物中CRISPR/Cas9系統(tǒng)的應用尚處于基因編輯體系建立的初步階段。除上述幾種普遍存在的問題外,林木自身特性也存在一些限制:①木本植物sgRNA在線設計軟件數(shù)據(jù)庫較少,因此,建立針對木本植物的sgRNA設計和檢測脫靶效應的公共網(wǎng)絡平臺,收集并建立更多樹種的基因組數(shù)據(jù)庫能顯著提高CRISPR/Cas9系統(tǒng)在林木林木遺傳育種的應用效率[66];②傳統(tǒng)遺傳轉(zhuǎn)化方法常伴有外源基因的插入,生長周期較短的植物可通過后代分離群體獲得無外源基因污染的轉(zhuǎn)化植株,但木本植物普遍采用無性繁殖方式且生長周期較長,其突變體后代通常帶有外源DNA的污染,由此可能會產(chǎn)生基因污染等生態(tài)風險問題。向細胞內(nèi)導入Cas9/sgRNA核糖核蛋白復合物可解決外源DNA污染問題,但多數(shù)木本植物的組培再生體系或穩(wěn)定的遺傳轉(zhuǎn)化體系還未完全完善,極大地限制了CRISPR系統(tǒng)在林木中的應用,因此,建立和完善木本植物原生質(zhì)體制備及再生體系將促進基因編輯育種在林木中的應用[66]。
CRISPR/Cas系統(tǒng)作為一項變革性的新興技術(shù),隨著基因編輯技術(shù)的普及可能導致生物安全監(jiān)管困難等問題。各國都沒有現(xiàn)成的監(jiān)管經(jīng)驗,在技術(shù)監(jiān)管和風險防控上均保持較高的謹慎態(tài)度。近期開發(fā)的一種外源成分檢測器(foreign element detector,F(xiàn)ED)可在外源成分信息未知的情況下對全基因組重測序數(shù)據(jù)進行分析,可精確鑒定出外源成分的片段長度及在基因組上的插入位置,為全球基因組編輯產(chǎn)品的應用和安全監(jiān)管提供了一個重要工具平臺[67]。我國基因編輯技術(shù)的研發(fā)雖然居全球領先地位,但仍然尚未出臺基因編輯產(chǎn)品的相關(guān)管理政策,其相關(guān)產(chǎn)業(yè)面臨技術(shù)領先、管理滯后、應用空白的局面。該平臺的建立有望為我國基因編輯產(chǎn)品的開發(fā)和應用提供安全保障。
4 展望
CRISPR/Cas系統(tǒng)是一種功能強大的基因組編輯系統(tǒng),它對基因功能研究以及作物性狀的遺傳改良具有重要意義,顯著促進了植物科學的快速發(fā)展。雖然目前該編輯系統(tǒng)還存在很多不足,但其相較于傳統(tǒng)育種的優(yōu)勢顯而易見,尤其在林木育種方面,將極大地縮短林木育種周期,對林木基因功能研究也起到巨大的推動作用。經(jīng)過優(yōu)化和改良的CRISPR/Cas基因編輯系統(tǒng)將成為培育植物新品種的主要手段之一,在植物遺傳改良方面具有廣闊的發(fā)展和應用前景。

